Ouabain
az Ouabain egy szívglikozid, amely gátolja az ATP-függő nátrium-kálium cserét a sejtmembránokon keresztül. Az ouabain kötődése a nátrium-kálium szivattyúhoz (más néven Na+/K+ ATPáz) megakadályozza a megfelelő működéséhez szükséges konformációs változásokat. Ez befolyásolja az intracelluláris ion összetételét különböző módokon, különböző hatásokkal, a sejttől és az adagtól függően. A vegyületet ezért felhasználták az orvostudományban, mind terápiás, mind az aktív aktív membrán transzporthoz kapcsolódó kutatásokban.
Célfehérje: Na + / K + ATPáz

A Na+/K+ ATPáz aktívan szállítja a káliumot a sejtbe, a nátriumot pedig az extracelluláris térbe az alább bemutatott általános séma szerint. Ez a transzmembrán fehérje három alegységből áll, alfa, béta és gamma, amelyek dimerizálódhatnak más pumpákkal in vivo. A kristályszerkezet sugárirányban szimmetrikus hexamer, amikor az élő szövetekben a fehérjék valószínűleg kétoldalúan társulnak. Az alfa lánc rózsaszín/kék, a béta lánc sárga/zöld színnel jelenik meg. A kettő közül az alfa alegység játszik vezető szerepet a fehérje működésében. Az alfa hélixek kötege a fehérje közepén helyezkedik el hidrofób maradványok a motívum külső részén, portált nyitva a lipid kettős rétegen keresztül. Ezen a transzmembrán doménen belül koordinálják az alfa alegység maradékai a nátrium-vagy káliumionokat. A kétréteg citoplazmatikus oldalán (a béta alegységtől legtávolabb) található nagy domén oldatban lebeg, és felelős az ATP megkötéséért és hidrolizálásáért. Mint sok foszfoészter-hidrolízis fehérje enzimnél, a foszfátcsoportokat is összehangolják az A-val . A nagy energiájú foszfát hasításból felszabaduló energiát konformációs változások útján továbbítják a transzmembrán doménbe, ahol az ionokat koncentrációs gradiensükkel szemben kényszerítik. Az extracelluláris oldalon az mozog, hogy megakadályozza a káliumionok disszociációját a sejtbe való belépésük során. Egy harmadik gamma alegység (lila/narancs) a béta alegységgel együtt hozzájárul a transzmembrán domének foszfolipid kétréteghez történő rögzítéséhez.
normál működés Na+ / K+ ATPáz két fázis között egyirányban változik, E1 és E2. Az E1 fázisban a sejt belsejében kötődik a na+ – hoz és az ATP-hez. A hidrolízis után a foszforellált fehérje kiüríti az ADP-t, és megváltoztatja az E2 konformációját, lehetővé téve a 3NA+ disszociációját a membrán extracelluláris oldalán. A fehérje ezután megköti a 2K+ – t, és hidrolizálja a kötött szervetlen foszfátot, ami E1-re fordul. Közvetlenül a K+ E2 állapothoz való kötődése előtt az Ouabain a szivattyú belsejében lévő maradékokhoz kötődik, megakadályozva az E1-be való visszatérést (így a magnézium kofaktor enzimatikusan kötött )
Ouabain szerkezet és kötés
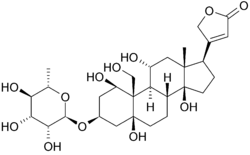
az alábbiakban az oubain szerkezete látható két dimenzióban. A molekula egy módosított koleszterinhez glikozidos kötéssel (tehát glikoziddal) kötött cukorból áll. A molekula nagy részét körülvevő hidroxilcsoportok, valamint az észterek mindkét végén hozzájárulnak a membránhoz kötött nátrium-kálium szivattyúhoz való kötődéséhez. három dimenzióban is látható. Az így bemutatott molekuláris geometriával és sztereokémiával tisztábban láthatjuk a poláris szén-oxigén és a nem poláris szén-szén kötések eloszlását a molekulát körülvevő térben. Ez sokkal könnyebbé teszi az inhibitor kötődésének vizualizálását. Az Ouabain az alfa-hélix köteg belsejében lévő fehérjéhez tartozik. a maradékok komponensei némileg segítenek az ouabain koordinálásában a Van der Waals erők révén, de a maradékok, a glutamin, az aszparaginsav és a treonin, valamint az alanin amidkötése körülveszik a ligandum hidroxil-és karbonilcsoportjait, 2-4 Angström hosszúságú hidrogénkötéseket képezve. Ez nemcsak a gyógyszert tartja a helyén, hanem megakadályozza a fehérje működéséhez szükséges konformációs változást.
szívizom-és Ionpumpa-gátlás
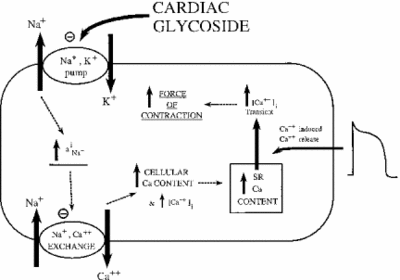
A Na+/K+ ATPáz gátlása közvetett hatással van a szívizomsejtek kontraktilis erejére vagy inotrófiájára. A citoplazmatikus nátriumkoncentráció növekedésével egy nátrium-kalcium-hőcserélő aktiválódik, ezáltal növelve a kalcium sejtkoncentrációját. A kalcium egy második hírvivő számos jelátviteli / szabályozó útvonalon. Az izomsejtek citoplazmájába történő felszabadulása összehúzódást jelez, magyarázva az ouabain alacsony dózisainak pozitív hatását a szív introfiájára. Az alábbi kép az összes szívglikozidnak a miokardiális szövetre gyakorolt hatását ábrázolja. Amint látható, a nátrium-kálium szivattyú gátlása emelkedett citoplazmatikus nátriumot okoz, amely aktiválja a nátrium-kalcium szivattyút, ami növeli a citoplazmatikus kalciumot. Ez növeli azt az erőt, amellyel a sejt összehúzódik.
helyes adagolás esetén az ouabain hatékonynak bizonyul a szívelégtelenség és az aritmiák kezelésében. Az ouabain aktivitás azonban közvetett módon hozzájárulhat a szívizomsejtek nátriummal való túlterheléséhez. A passzív Na + csatornákat általában inaktiválják, ha a membránpotenciál a legmagasabb. Amikor újra kinyílnak vagy nem záródnak be, túl sok nátrium szivároghat a sejtbe, ami az ATP pazarló kiadásait és/vagy a koordinálatlan izomösszehúzódást okozza. Ezt késői I-Na-nak hívják. A nátrium és a kalcium emelkedésével a Ca2 + – kalmodulin-függő kináz aktiválódik, viszont foszforilálja és aktiválja a passzív Na+ csatornákat. Amikor az ouabain hatásai ilyen módon felerősödnek, a gyógyszer több kárt okozhat, mint hasznot. Kutatások kimutatták, hogy a késői I-Na elleni küzdelem hatékony módja a Ca gátlása2 + – kalmodulin-függő kináz (Hoyer et al. 2011).