Idiopathic intracranial hypertension
Assessment | Biopsychology | Comparative |Cognitive | Developmental | Language | Individual differences |Personality | Philosophy | Social |
Methods | Statistics |Clinical | Educational | Industrial |Professional items |World psychology |
Biological:Behavioural genetics · Evolutionary psychology · Neuroanatomy · Neurochemistry · Neuroendocrinology ·Neuroscience · Psychoneuroimmunology · Physiological Psychology · Psychopharmacology(Index, Outline)
MRI brain.jpg|
| ICD-10 | G932 | |
|---|---|---|
| ICD-9 | 348.2 | |
| OMIM | 243200 | |
| DiseasesDB | 1331 | |
| MedlinePlus | 000351 | |
| eMedicine | neuro/329 oph/190 neuro/537 | |
| Maglia | {{{MeshNumber}}} | |
ipertensione intracranica Idiopatica (IIH), a volte chiamato dai vecchi nomi di ipertensione endocranica benigna (BIH) o pseudotumor cerebri (PTC), è una malattia neurologica caratterizzata da un aumento della pressione intracranica (pressione di tutto il cervello) in assenza di un tumore o di altre malattie. I sintomi principali sono mal di testa, nausea e vomito, nonché tinnito pulsatile (ronzio nelle orecchie sincrono con l’impulso), visione doppia e altri sintomi visivi. Se non trattata, può portare a gonfiore del disco ottico nell’occhio, che può progredire fino alla perdita della vista.
AIIH viene diagnosticata una scansione cerebrale (per escludere altre cause) e una puntura lombare; la puntura lombare può anche fornire un sollievo temporaneo e talvolta permanente dai sintomi. Alcuni rispondono ai farmaci (con il farmaco acetazolamide), ma altri richiedono un intervento chirurgico per alleviare la pressione. La condizione può verificarsi in tutti i gruppi di età, ma è più comune nelle giovani donne, specialmente quelle con obesità.
Segni e sintomi
Il sintomo più comune di IIH è il mal di testa, che si verifica in quasi tutti i casi (92-94%). È caratteristicamente peggio al mattino, generalizzato nel carattere e palpitante nella natura. Può essere associato a nausea e vomito. Il mal di testa può essere aggravato da qualsiasi attività che aumenta ulteriormente la pressione intracranica, come tosse e starnuti. Il dolore può anche essere sperimentato nel collo e nelle spalle. Molti hanno l’acufene pulsatile, una sensazione di fruscio in una o entrambe le orecchie (64-87%); questo suono è sincrono con l’impulso. Vari altri sintomi, come intorpidimento delle estremità, debolezza generalizzata, perdita dell’olfatto e incoordinazione, sono riportati più raramente; nessuno è specifico per IIH. Nei bambini possono essere presenti numerosi segni e sintomi non specifici.
L’aumento della pressione porta alla compressione e alla trazione dei nervi cranici, un gruppo di nervi che derivano dal tronco cerebrale e forniscono il viso e il collo. Più comunemente, è coinvolto il nervo abducens (sesto nervo). Questo nervo fornisce il muscolo che tira l’occhio verso l’esterno. Quelli con paralisi del sesto nervo quindi sperimentano una visione doppia orizzontale che è peggiore quando si guarda verso il lato interessato. Più raramente, il nervo oculomotore e il nervo trocleare (terzo e quarto nervo paralisi, rispettivamente) sono interessati; entrambi svolgono un ruolo nei movimenti oculari. Il nervo facciale (settimo nervo cranico) è interessato occasionalmente result il risultato è debolezza totale o parziale dei muscoli dell’espressione facciale su uno o entrambi i lati del viso.
L’aumento della pressione porta al papilledema, che è il gonfiore del disco ottico, il punto in cui il nervo ottico entra nel bulbo oculare. Ciò si verifica in quasi tutti i casi di IIH, ma non tutti sperimentano sintomi da questo. Coloro che sperimentano sintomi in genere riportano “oscuramenti visivi transitori”, episodi di difficoltà a vedere che si verificano in entrambi gli occhi ma non necessariamente allo stesso tempo. Il papilledema non trattato a lungo termine porta alla perdita visiva, inizialmente nella periferia ma progressivamente verso il centro della visione.
L’esame fisico del sistema nervoso è tipicamente normale a parte la presenza di papilledema, che si vede all’esame dell’occhio con un piccolo dispositivo chiamato oftalmoscopio o più in dettaglio con una telecamera del fondo oculare. Se ci sono anomalie del nervo cranico, queste possono essere notate all’esame dell’occhio sotto forma di strabismo (terza, quarta o sesta paralisi del nervo) o come paralisi del nervo facciale. Se il papilledema è stato di lunga data, i campi visivi possono essere ristretti e l’acuità visiva può essere diminuita. Si raccomanda il test del campo visivo mediante perimetria automatizzata (Humphrey) poiché altri metodi di test potrebbero essere meno accurati. Il papilledema di lunga data porta all’atrofia ottica, in cui il disco appare pallido e la perdita visiva tende ad essere avanzata.
Cause
“Idiopatico” significa “di eziologia sconosciuta”. Pertanto, l’IIH può essere diagnosticato solo se non esiste una spiegazione alternativa per i sintomi. La pressione intracranica può essere aumentata a causa di farmaci come derivati della vitamina A ad alte dosi (ad esempio isotretinoina per l’acne), antibiotici tetracicline a lungo termine (per una varietà di condizioni della pelle) e contraccettivi ormonali. Ci sono numerose altre malattie, condizioni per lo più rare, che possono portare a ipertensione intracranica. Se c’è una causa di fondo, la circostanza è definita “ipertensione intracranica secondaria”. Le cause comuni di ipertensione endocranica secondaria includono apnea ostruttiva del sonno (un disturbo respiratorio correlato al sonno), lupus eritematoso sistemico (LES), malattia renale cronica e malattia di Behçet.
Meccanismo
La causa di IIH non è nota. La regola di Monro-Kellie afferma che la pressione intracranica (letteralmente: pressione all’interno del cranio) è determinata dalla quantità di tessuto cerebrale, liquido cerebrospinale (CSF) e sangue all’interno della volta cranica ossea. Esistono quindi tre teorie sul motivo per cui la pressione potrebbe essere sollevata in IIH: un eccesso di produzione di CSF, aumento del volume di sangue o tessuto cerebrale, o ostruzione delle vene che drenano il sangue dal cervello.
La prima teoria, quella dell’aumento della produzione di liquido cerebrospinale, è stata proposta nelle prime descrizioni della malattia. Tuttavia, non ci sono dati sperimentali che supportano un ruolo per questo processo in IIH.
La seconda teoria postula che un aumento del flusso sanguigno al cervello o un aumento del tessuto cerebrale stesso può causare la pressione aumentata. Poche prove si sono accumulate per sostenere il suggerimento che l’aumento del flusso sanguigno gioca un ruolo, ma entrambi i campioni bioptici e vari tipi di scansioni cerebrali hanno mostrato un aumento del contenuto di acqua del tessuto cerebrale. Non è chiaro il motivo per cui questo potrebbe essere il caso.
La terza teoria suggerisce che il flusso di sangue dal cervello può essere compromesso o congestionato. Solo in una piccola percentuale di pazienti è stato dimostrato il restringimento sottostante dei seni cerebrali o delle vene. La congestione del sangue venoso può derivare da una pressione venosa generalmente aumentata, che è stata collegata all’obesità.
Diagnosi
La diagnosi può essere sospettata sulla base della storia e dell’esame. Per confermare la diagnosi, oltre ad escludere cause alternative, sono necessarie diverse indagini; ulteriori indagini possono essere eseguite se la storia non è tipica o il paziente ha maggiori probabilità di avere un problema alternativo: bambini, uomini, anziani o donne che non sono in sovrappeso.
Indagini
Il neuroimaging, di solito con tomografia computerizzata (CT / CAT) o risonanza magnetica (MRI), esclude le lesioni di massa. In IIH queste scansioni possono essere normali, anche se piccoli o ventricoli a fessura e “segno sella vuoto” (appiattimento della ghiandola pituitaria a causa di una maggiore pressione) può essere visto. Un venogramma MR viene eseguito anche in tutti i casi (o secondo alcuni esperti solo in casi atipici) per escludere la possibilità di ostruzione venosa o trombosi del seno venoso cerebrale.
La puntura lombare viene eseguita per misurare la pressione di apertura, nonché per ottenere il liquido cerebrospinale (CSF) per escludere diagnosi alternative. Se la pressione di apertura è aumentata, CSF può essere rimosso per sollievo (vedi sotto). Il CSF viene esaminato per cellule anormali, livelli di glucosio e proteine; in IIH, tutti sono entro i limiti normali. Occasionalmente, la misurazione della pressione può essere normale nonostante i sintomi molto suggestivi. Ciò può essere attribuibile al fatto che la pressione del CSF può fluttuare nel corso della giornata. Se il sospetto rimane alto, potrebbe essere necessario eseguire un monitoraggio più a lungo termine dell’ICP mediante un catetere a pressione.
Classificazione
I criteri originali per IIH sono stati descritti da Dandy nel 1937.
1Signs & i sintomi di aumento della ICP – CSF pressione >25 cmH2O
2No segni di localizzazione con l’eccezione di paralisi del nervo abducente
3Normal CSF composizione
4Normal piccolo (fessura) ventricoli di imaging senza intracranica di massa
Essi sono stati modificati da Smith nel 1985 per diventare il “modificato Dandy criteri”. Smith incluse l’uso di immagini più avanzate: Dandy aveva richiesto la ventricolografia, ma Smith lo sostituì con la tomografia computerizzata. In un documento del 2001, Digre e Corbett modificarono ulteriormente i criteri di Dandy. Hanno aggiunto il requisito che il paziente sia sveglio e vigile, poiché il coma preclude un’adeguata valutazione neurologica e richiede l’esclusione della trombosi del seno venoso come causa sottostante. Inoltre, aggiungono il requisito che non venga trovata altra causa per l’ICP sollevato.
1Symptoms di aumentata pressione endocranica (cefalea, nausea, vomito, visivi transitori oscuramenti, o papilledema)
2No segni di localizzazione con l’eccezione del nervo abducente (vi) paralisi del nervo
3 il paziente è sveglio e vigile
4Normal CT/risultati della risonanza magnetica senza evidenza di trombosi
5LP pressione di apertura >25 cmH2O e biochimici normali e citologici composizione del CSF
6No altra spiegazione per l’aumento della pressione intracranica
In una revisione 2002, Friedman e Jacobson propone un insieme alternativo di criteri, derivato da Smith. Questi richiedono l’assenza di sintomi che non potrebbero essere spiegati da una diagnosi di IIH, ma non richiedono l’effettiva presenza di alcun sintomo (come il mal di testa) attribuibile a IIH. Questi criteri richiedono anche che la puntura lombare venga eseguita con il paziente disteso lateralmente, poiché una puntura lombare eseguita in posizione eretta può portare a misurazioni artificialmente ad alta pressione. Friedman e Jacobson inoltre non insistono sul SIGNOR venografia per ogni paziente; piuttosto, questo è richiesto solo in casi atipici (vedi “diagnosi” sopra).
Trattamento
L’obiettivo primario nel trattamento dell’IIH è la prevenzione della perdita visiva e della cecità, nonché il controllo dei sintomi. L’IIH è trattato principalmente attraverso la riduzione della pressione del CSF e, se del caso, la perdita di peso. IIH può risolversi dopo il trattamento iniziale, può andare in remissione spontanea (anche se può ancora ricadere in una fase successiva), o può continuare cronicamente.
Puntura lombare
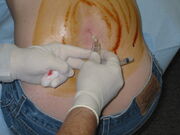
Una puntura lombare in corso. Una vasta area sul retro è stata lavata con un disinfettante a base di iodio lasciando colorazione marrone. In questa immagine il paziente è seduto in posizione verticale, il che può rendere la procedura più facile da eseguire ma rende inaffidabile qualsiasi misurazione della pressione di apertura.
Il primo passo nel controllo dei sintomi è il drenaggio del liquido cerebrospinale mediante puntura lombare. Se necessario, questo può essere eseguito contemporaneamente a un LP” diagnostico”. In alcuni casi, questo è sufficiente per controllare i sintomi e non è necessario alcun ulteriore trattamento.
La procedura può essere ripetuta se necessario, ma questo è generalmente preso come spunto che possono essere necessari trattamenti aggiuntivi per controllare i sintomi e preservare la vista; LPs ripetuti sono considerati spiacevoli dai pazienti. A volte sono necessari ripetuti LP per controllare urgentemente l’ICP se la vista si deteriora rapidamente.
Farmaco
Il trattamento medico meglio studiato è l’acetazolamide (Diamox), che agisce inibendo l’enzima anidrasi carbonica e riduce la produzione di CSF da sei a 57 per cento. Può causare i sintomi di ipopotassiemia (bassi livelli di potassio nel sangue), che includono debolezza muscolare e formicolio alle dita. Acetazolamide non può essere utilizzato in gravidanza, come ha dimostrato di causare anomalie embrionali negli studi sugli animali, e negli esseri umani ha dimostrato di causare acidosi metabolica, nonché interruzioni nei livelli di elettroliti nel sangue nel neonato. La furosemide diuretica viene talvolta utilizzata se l’acetazolamide non è tollerata, ma questo ha scarso effetto sull’ICP.
Vari analgesici (antidolorifici) possono essere utilizzati nel controllo del mal di testa. Oltre agli agenti convenzionali come il paracetamolo, una bassa dose di antidepressivo amitriptilina e il topiramato anticonvulsivante hanno mostrato qualche ulteriore beneficio per il sollievo dal dolore.
L’uso di steroidi per ridurre l’ICP è controverso; possono essere utilizzati in papilledema grave, ma per il resto il loro uso è scoraggiato.
Chirurgia
Nel trattamento dell’IIH esistono due principali procedure chirurgiche: decompressione della guaina del nervo ottico e fenestrazione e smistamento. La chirurgia normalmente sarebbe offerta solo se la terapia medica non ha successo o non è tollerata. La scelta tra queste due procedure dipende dal problema predominante in IIH. Nessuna delle due procedure è perfetta: entrambi possono causare complicazioni significative, ed entrambi possono eventualmente non riuscire a controllare i sintomi. Non ci sono studi randomizzati controllati per guidare la decisione su quale procedura è migliore.
La fenestrazione della guaina del nervo ottico è un’operazione oftalmologica che comporta la realizzazione di un’incisione nel rivestimento del tessuto connettivo del nervo ottico nella sua porzione dietro l’occhio. Non è del tutto chiaro come protegge l’occhio dalla pressione sollevata, ma può essere il risultato di una deviazione del CSF nell’orbita o della creazione di un’area di tessuto cicatriziale che abbassa la pressione. Gli effetti sulla pressione intracranica stessa sono più modesti. Inoltre, la procedura può portare a complicazioni significative, tra cui la cecità nell ‘ 1-2%. La procedura è quindi raccomandata principalmente in coloro che hanno sintomi di mal di testa limitati ma papilledema significativo o visione minacciata, o in coloro che hanno subito un trattamento non riuscito con uno shunt o hanno una controindicazione per la chirurgia dello shunt.
La chirurgia dello shunt, di solito eseguita dai neurochirurghi, comporta la creazione di un condotto attraverso il quale il CSF può essere drenato in un’altra cavità del corpo. La procedura iniziale è di solito uno shunt lomboperitoneale (LP), che collega lo spazio subaracnoideo nella colonna lombare con la cavità peritoneale. Generalmente, una valvola di pressione è inclusa nel circuito per evitare un eccessivo drenaggio quando il paziente è eretto e quindi ha un ICP relativamente alto. Lo smistamento LP fornisce sollievo a lungo termine in circa la metà dei casi; altri richiedono la revisione dello shunt, spesso in più di un’occasione, di solito a causa dell’ostruzione dello shunt. Se lo shunt lomboperitoneale necessita di revisioni ripetute, può essere preso in considerazione uno shunt ventricoloatriale o ventricoloperitoneale. Questi shunt vengono inseriti in uno dei ventricoli laterali del cervello, di solito mediante chirurgia stereotassica, e quindi collegati rispettivamente all’atrio destro del cuore o alla cavità peritoneale. Data la ridotta necessità di revisioni negli shunt ventricolari, è possibile che questa procedura diventi il tipo di shunt di prima linea.
Nei casi di obesità grave, è stato dimostrato che la chirurgia di bypass gastrico porta a un netto miglioramento dei sintomi.
Prognosi
Non è noto quale percentuale di persone con IIH rimetterà spontaneamente e quale percentuale svilupperà la malattia cronica.
IIH normalmente non influisce sull’aspettativa di vita. Le principali complicanze da IIH derivano da papilledema non trattato o resistente al trattamento. In varie serie di casi, il rischio a lungo termine di una visione significativamente influenzata da IIH è segnalato per trovarsi ovunque tra il 10 e il 25%.
Epidemiologia
L’incidenza di IIH è fortemente determinata dal sesso e dal peso corporeo. Le cifre nelle donne sono nelle donne tra 20 e 45 anni.
In media, IIH si verifica in circa 1 ogni 100.000 persone e può verificarsi nei bambini e negli adulti. L’età media alla diagnosi è di 30 anni. IIH si verifica prevalentemente nelle donne, soprattutto nelle età 20-45, che sono quattro-otto volte più probabilità rispetto agli uomini di essere colpiti. Sovrappeso e obesità predispongono fortemente una persona a IIH: le donne che sono più del dieci per cento sopra il loro peso corporeo ideale sono tredici volte più probabilità di sviluppare IIH, e questa cifra va fino a diciannove volte nelle donne che sono più del venti per cento sopra il loro peso corporeo ideale. Negli uomini esiste anche questa relazione, ma l’aumento è solo cinque volte in quelli oltre il 20% sopra il loro peso corporeo ideale.
Nonostante diverse segnalazioni di IIH nelle famiglie, non esiste una causa genetica nota per IIH. Persone di tutte le etnie possono sviluppare IIH. Nei bambini, non vi è alcuna differenza di incidenza tra maschi e femmine.
Dai database nazionali di ammissione ospedaliera sembra che la necessità di un intervento neurochirurgico per IIH sia aumentata notevolmente nel periodo tra il 1988 e il 2002. Questo è stato attribuito almeno in parte alla crescente prevalenza dell’obesità, anche se parte di questo aumento può essere spiegato dalla maggiore popolarità dello smistamento sulla fenestrazione della guaina del nervo ottico.
Storia
Il primo rapporto dell’IIH fu del medico tedesco Heinrich Quincke, che lo descrisse nel 1893 sotto il nome di meningite sierosa. Il termine “pseudotumor cerebri” fu introdotto nel 1904 dal suo connazionale Max Nonne. Numerosi altri casi sono apparsi in letteratura successivamente; in molti casi, la pressione intracranica sollevata può effettivamente essere il risultato di condizioni di base. Ad esempio, l’idrocefalo otitico riportato dal neurologo londinese Sir Charles Symonds potrebbe essere il risultato di trombosi del seno venoso causata da infezione dell’orecchio medio. I criteri diagnostici per IIH sono stati sviluppati nel 1937 dal neurochirurgo di Baltimora Walter Dandy; Dandy ha anche introdotto la chirurgia decompressiva subtemporale nel trattamento della condizione.
I termini “benigno” e “pseudotumore” derivano dal fatto che l’aumento della pressione intracranica può essere associato a tumori cerebrali. I pazienti nei quali non è stato riscontrato alcun tumore sono stati quindi diagnosticati con “pseudotumor cerebri” (una malattia che imita un tumore al cervello). La malattia è stata ribattezzata “ipertensione endocranica benigna” nel 1955 per distinguerla dall’ipertensione intracranica a causa di malattie potenzialmente letali (come il cancro); tuttavia, questo è stato anche ritenuto fuorviante perché qualsiasi malattia che può accecare qualcuno non dovrebbe essere considerata benigna, e il nome è stato quindi rivisto nel 1989 in “ipertensione intracranica idiopatica (senza causa identificabile)”.
La chirurgia dello shunt è stata introdotta nel 1949; inizialmente sono stati utilizzati shunt ventricoloperitoneali. Nel 1971 sono stati riportati buoni risultati con lo smistamento lomboperitoneale. Rapporti negativi sullo smistamento negli 1980 hanno portato a un breve periodo (1988-1993) durante il quale la fenestrazione del nervo ottico (che era stata inizialmente descritta in una condizione non correlata nel 1871) era più popolare. Da allora, lo smistamento è raccomandato prevalentemente, con eccezioni occasionali.
Vedi anche
- Ipertensione
- 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 Raccoglitore di DK, Horton JC, Lawton MT, McDermott MW (Marzo 2004). Ipertensione intracranica idiopatica. Neurochirurgia 54 (3): 538-51; discussione 551-2.
- Sismanis A (luglio 1998). Tinnito pulsatile. Un’esperienza di 15 anni. Am J Otol 19 (4): 472-7.
- 3.0 3.1 3.2 3.3 3.4 3.5 3.6 Soler D, Cox T, Bullock P, Calver DM, Robinson RO (gennaio 1998). Diagnosi e gestione dell’ipertensione endocranica benigna. Arco. Dis. Bambino. 78 (1): 89–94.
- 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Friedman DI, Jacobson DM (2002). Criteri diagnostici per l’ipertensione intracranica idiopatica. Neurologia 59 (10): 1492-1495.
- 5,00 5,01 5,02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 Acheson JF (2006). Idiopathic intracranial hypertension and visual function. Br. Med. Bull. 79-80 (1): 233–44.
- 6.0 6.1 6.2 Dandy WE (October 1937). Intracranial pressure without brain tumor – diagnosis and treatment. Ann. Surg. 106 (4): 492–513.
- Smith JL (1985). Whence pseudotumor cerebri?. J. Clin. Neuroophthalmol. 5 (1): 55–6.
- 8.0 8.1 Digre KB, Corbett JJ (2001). Idiopathic intracranial hypertension (pseudotumor cerebri): A reappraisal. Neurologist 7: 2–67.
- Curry WT, Butler WE, Barker FG (2005). Rapidamente crescente incidenza di procedure di smistamento del liquido cerebrospinale per l’ipertensione intracranica idiopatica negli Stati Uniti, 1988-2002. Neurochirurgia 57 (1): 97-108; discussione 97-108.
- Quincke HI (1893). Meningite sierosa. Samml. Klin. Vtr. 67: 655.
- Nonne M (1904). Ueber Falle vom Symptomkomplex “Tumor Cerebri” mit Ausgang in Heilung (Pseudotumor Cerebri). Dtsch. Z. Nervenheilk. 27 (3-4): 169–216.
- 12.0 12.1 12.2 Johnston I (2001). Lo sviluppo storico del concetto di pseudotumore. Neurochirurgia. Messa a fuoco 11 (2): 1.
- Symonds CP (1931). Idrocefalo otitico. Cervello 54 (3705): 55-71.
- Foley J (1955). Forme benigne di ipertensione intracranica; idrocefalo tossico e otitico. Cervello 78 (1): 1-41.
- Corbett JJ, Thompson HS (ottobre 1989). La gestione razionale dell’ipertensione intracranica idiopatica. Arco. Neurolo. 46 (10): 1049–51.
- Bandyopadhyay S (2001). Pseudotumor cerebri. Arco. Neurolo. 58 (10): 1699–701.
- Idiopathic intracranial hypertension at the Open Directory Project
|
v·d·e
Nervous system disorders, primarily CNS (G04–G47, 323–349) |
||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inflammation |
|
Both/either
|
||||||||||||||||||||||
| Brain/ encephalopathy |
|
|||||||||||||||||||||||
| Spinal cord/ myelopathy |
Syringomyelia · Syringobulbia · Morvan’s syndrome · Vascular myelopathy (Foix-Alajouanine syndrome) · Spinal cord compression |
|||||||||||||||||||||||
| Both/either |
|
|
||||||||||||||||||||||
| {| class=”navbox collapsible nowraplinks” style=”margin:auto; “ | ||||||||||||||||||||||||
|
··
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|}
This page uses Creative Commons Licensed content from Wikipedia (view authors).