ウアバイン
ウアバインは、細胞膜を横切るATP依存性ナトリウム-カリウム交換を阻害する強心配糖体である。 ウアバインのナトリウム-カリウムポンプ(Na+/K+ATPaseとも呼ばれる)への結合は、その適切な機能に必要な立体配座の変化を防止する。 これは、細胞および投与量に応じて、様々な効果を有する様々な方法で細胞内イオン組成に影響を及ぼす。 従って混合物は治療上としてそして活動的で活動的な膜の輸送と関連している研究で医学で、利用されました。
ターゲットタンパク質: Na+/K+ATPase

Na+/K+ATPaseは、以下に示す一般的なスキームに従って、カリウムを細胞内に、ナトリウムを細胞外空間に積極的に輸送する。 この膜貫通タンパク質は、α、β、γの3つのサブユニットから構成され、生体内で他のポンプと二量体化する可能性があります。 結晶構造は、放射状に対称な六量体であり、生きている組織では、タンパク質が両側に会合する可能性が最も高い。 アルファ鎖はピンク/青で、ベータ鎖は黄色/緑で示されています。 このうち、αサブユニットはタンパク質の機能において主導的な役割を果たしている。 タンパク質の中心にあるαヘリックスの束は、モチーフの外側に疎水性残基を配置し、脂質二重層を介してポータルを開く。 Αサブユニットの残基がナトリウムまたはカリウムイオンを配位するのは、この膜貫通ドメイン内にある。 二分子層の細胞質側の大きなドメイン(ベータサブユニットから最も遠い)は溶液中に浮遊し、ATPの結合および加水分解を担う。 ホスホエステル加水分解の多くのタンパク質酵素と同様に、リン酸基はaと配位している。 高エネルギーりん酸開裂から放出されたエネルギーは,イオンがその濃度勾配に対して強制される膜貫通ドメインへの配座変化を介して伝達される。 細胞外側では、細胞内への侵入中のカリウムイオンの解離を防止するために移動する。 第三のガンマサブユニット(紫/オレンジ)は、ベータサブユニットと一緒に、リン脂質二重層への膜貫通ドメインのアンカリングに貢献しています。
正常に機能するNa+/K+ATPaseは、e1とE2の二つの相の間で一方向に変化する。 E1期では、細胞の内部でNa+とATPに結合します。 加水分解後、リン酸化されたタンパク質はADPを放出し、立体配座をE2に変化させ、3na+が膜の細胞外側で解離することを可能にする。 その後、タンパク質は2K+に結合し、結合した無機リン酸を加水分解し、E1に戻る。 K+がE2状態に結合する直前に、ウアバインはポンプ内の残基に結合し、E1への遷移を防止する(したがって、マグネシウム補因子は酵素的に結合している)
ウアバイン構造と結合
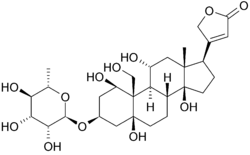
以下は、二次元のウバインの構造である。 分子はグリコシド結合(それ故にグリコシド)によって変更されたコレステロールに区切られる砂糖から成っています。 分子の多くを取り囲むヒドロキシル基は、いずれかの端のエステルとともに、膜結合ナトリウム-カリウムポンプへの結合に寄与する。 また、三次元で見ることができます。 このように表示された分子の形状と立体化学により、分子を取り巻く空間における極性炭素-酸素および非極性炭素-炭素結合の分布をより明確に これにより、阻害剤の結合を視覚化することがはるかに容易になる。 Ouabainはアルファ螺旋形の束の内部に沿う蛋白質にあります。 残基の成分はファンデルワールス力を介してウアバインを調整するのに多少役立つが、残基、グルタミン、アスパラギン酸、トレオニンはアラニンのアミド結合とともに配位子のヒドロキシル基とカルボニル基を取り囲み、長さが2-4オングストロームの水素結合を形成する。 これは、薬物を所定の位置に保持するだけでなく、タンパク質の機能に必要な立体配座の変化を防止する。
心筋およびイオンポンプ阻害
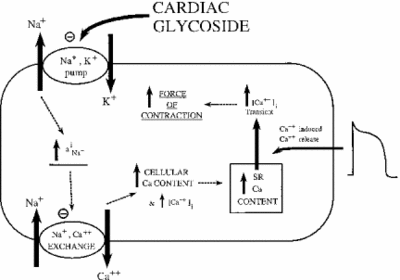
Na+/K+ATPaseの阻害は、心筋細胞の収縮強度またはinotrophyに間接的な影響を及ぼす。 細胞質ナトリウム濃度の増加により、ナトリウム-カルシウム交換体が活性化され、それによってカルシウムの細胞濃度が増加する。 カルシウムは、多くのシグナル伝達/調節経路における第二のメッセンジャーである。 筋肉細胞の細胞質へのその放出は収縮を示し、心臓introphyに対する低用量のウアバインの正の効果を説明する。 下の画像は、心筋組織に対するすべての強心配糖体のこの効果を示しています。 示されているように、ナトリウム-カリウムポンプの阻害は、細胞質カルシウムの増加を引き起こすナトリウム-カルシウムポンプを活性化する細胞質 これにより、セルが収縮する力が増加します。
正しく投与された場合、ウアバインは心不全や不整脈の治療に有効であることが証明されています。 しかし、ウアバイン活性は、ナトリウムによる心筋細胞の過負荷に間接的に寄与し得る。 受動的なNa+チャネルは、通常、膜電位が最も高いときに不活性化される。 それらが再び開くか、または閉まらないときたくさんのナトリウムは細胞に漏ることができATPの無駄な支出や調整されていない筋肉収縮を引き起こ これは後期I-Naと呼ばれています。 ナトリウムとカルシウムの上昇に伴い、Ca2+-カルモジュリン依存性キナーゼが活性化され、受動的なNa+チャネルがリン酸化され、活性化される。 Ouabainの効果がこのように増幅されるとき、薬剤はよいよりより多くの害を引き起こすことができます。 研究は、後期i−Naに対抗する効果的な方法が、Ca2+−カルモジュリン依存性キナーゼの阻害によるものであることを示している(Hoyer e t a l. 2011).