Grenser I Immunologi
- Introduksjon
- T-Og B-Cellerommene og To Konvensjonelle Stromalcelleundergrupper
- En Nylig Identifisert Stromal Undergruppe, Marginale Retikulære Celler
- MRCs og Antigeninngangsveien i Sloer
- Mrcs Og Organizer Stromal Celler I SLO Utvikling
- Forholdet Mellom Mrc og Andre Stromale Undergrupper
- Remodeling Av Sloer og Tertiære Lymfoide Strukturer
- Konklusjon
- Interessekonflikt
- Anerkjennelser
Introduksjon
Sekundære lymfoide organer / vev (Sloer) er avgjørende for effektiv induksjon av adaptive immunresponser. Flere Typer Sloer, inkludert lymfeknuter( lns), milt og mukosalassosiert lymfoid vev (Malter) som Peyers patcher (PPs), er strategisk plassert gjennom ulike steder i kroppen. Sloer er et forseggjort filter som prøver antigener og er utstyrt med svært følsomme immunsensorer. For å samle og filtrere fremmede antigener inneholder SLOs spesialiserte vevstrukturer som er forbundet med endotelet eller epitelet. Immunceller som lymfocytter, dendrittiske celler (DCs) og makrofager akkumuleres til høye tettheter og danner rom. En bemerkelsesverdig funksjon som er felles for Alle Sloer er den segregerte lokaliseringen Av B-celler og T-celler. Arkitekturen Til Sloer støttes av flere typer ikke-hematopoietiske stromale celler av mesenkymal opprinnelse, som konstruerer nettverk og definerer rom (Mueller Og Germain, 2009; Roozendaal og Mebius, 2011). Stromale nettverk gir ikke bare et funksjonelt fotfeste, men også et rom for immuncelleaktiviteter, samt et fysisk rammeverk for vevet. Videre indikerer økende bevis at stromalceller også spiller kritiske roller i immuncellefunksjon og homeostase (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Sloer er programmert til å utvikle seg fra anlagen som oppstår på visse steder og i begrensede perioder i fosteret og spedbarnet. I tillegg er stromalceller kjent for å være viktige for SLO-utvikling og vedlikehold (Mebius, 2003). Her fokuserer jeg på en nylig identifisert stromal delmengde, marginale retikulære celler (Mrc), og oppsummerer deres egenskaper. Jeg diskuterer også forholdet Mellom Mrc og vevsstruktur, andre stromale undergrupper og immunologiske funksjoner.
T-Og B-Cellerommene og To Konvensjonelle Stromalcelleundergrupper
som beskrevet ovenfor lokaliseres b-celler og T-celler til forskjellige regioner innenfor Sloer. B-celler akkumuleres for å danne follikler (b-sone) i ytre cortex under kapselen i LNs eller i ytre periarteriolar lymfoid kappe (PALS) i milten. En klynge av store follikler er kjernevevet Til PPs. Under immunresponser danner aktiverte b-celler i folliklene germinale sentre, hvor de skiller seg til høyaffinitets antistoffprodusenter (Cyster et al., 2000). I kontrast lokaliseres T-celler til et eget område (t-sone) ved siden av folliklene, dvs. paracortex i LNs, indre PALS i milten eller interfollikulær region (IFR) i PPs. DCs akkumuleres også I t-sonen for å presentere antigen og prime T-celler (Steinman et al., 1997).
det finnes to forskjellige typer mesenkymale stromale undergrupper i b-og T-sonene (Figur 1a). Follikulære dendrittiske celler (fdcs) danner et tett nettverk i sentrum av folliklene og har fått stor oppmerksomhet på grunn av deres betydning i antistoffproduksjon Av B-celler (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs express CR1 / CD35, CD23, og noen Ganger MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Derimot omfatter et forseggjort nettverk av fibroblastiske retikulære celler (FRCs) stillaset Til t-sonen, som produserer podoplanin/gp38 og forskjellige ekstracellulære matriks (ECM) komponenter (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Generelt er immuncellemigrasjon og lokalisering regulert av en rekke kjemokiner (Mackay, 2001). Hvilende lymfocytter og modne DCs er svært lydhør overfor «homeostatiske kjemokiner» (Cyster, 1999; Mü et al 2003). I samsvar med dette er det klare korrelasjoner mellom kjemokiner produsert av stromale celledelmengder og lokalisering av immunceller som uttrykker de tilsvarende reseptorene; CXCL13 produsert Av FDCs er et tiltrekkende middel av b-celler som uttrykker CXCR5, MENS CCL19 og CCL21 fra T-sone frcs tiltrekker Seg T-celler og modne DCs gjennom den felles reseptoren CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Videre antas lymfocytter som migrerer robust i vevsparenchyma for å skanne antigener å bruke stromale nettverk som fotfeste(Bajé et al 2006). En rekke faktorer produsert av stromal undergrupper er også nødvendig for aktivering og overlevelse av immunceller (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Derfor er strukturen og funksjonen til stromal-nettverket i hvert rom sannsynligvis optimalisert for aktiviteten til immuncelleundergrupper.
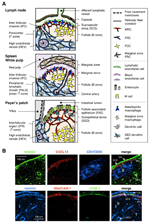
FIGUR 1. Stromal celle undergrupper og vev strukturer Av SLOs. (A) Skjematisk fremstilling av vev strukturer i mus SLOs, med vekt på stromal celler og antigen-transport apparat. Stromale elementer, inkludert mesenkymale, endoteliale og epitelceller samt myeloide celler som makrofager og dendritiske celler (oppført i høyre panel), trekkes for vekt. (B) Øvre: vevsrammen konstruert av tre forskjellige typer stromale celler i den ytre kortikale regionen AV LN. Fluorescerende immunostaining av en mus LN seksjon. I den øvre mikrografen er det en liten hvilefollikkel (B) uten et germinal senter, som støttes av FDCs som uttrykker CR1/CD35, men uoppdagelige nivåer AV CXCL13. I stedet danner Mrc et laminin + CXCL13 + retikulært nettverk i den ytre kanten av follikkelen under kapselen (CA) og SCS. Nettverket konstruert Av FRCs i paracortex (T) er laminin + CXCL13-CR1 / CD35 -. Nedre: MAdCAM-1 + MRC-laget er nært forbundet MED LYVE – 1 + lymfatisk endotellag i SCS. Merk AT MRC-laget er utvidet TIL IFC-omradet.stromalnettet I t-sonen består Av FRCs og EN ECM-bunt kjent som en retikulær fiber, som danner en «kanal» som letter passasjen av lavmolekylære stoffer (Gretz et al., 1997, 2000; Nolte et al., 2003). Denne ledningen transporterer ulike faktorer og oppløselige antigener dypt inne i vevet, mens partikler og store molekyler hovedsakelig utelukkes fra lymfocyttrommene. Faktisk transporteres lymfebårne kjemokiner fra perifert vev raskt til den høye endotelvenen gjennom ledningen for å kontrollere mobiliseringen av sirkulerende celler inn I LNs (Palframan et al., 2001). I tillegg er noen bosatt DCs direkte kontakt kanal og fange lymfe-borne antigener (Sixt et al., 2005).
En Nylig Identifisert Stromal Undergruppe, Marginale Retikulære Celler
den ytre margen AV ln cortex, like under kapsel, er omgitt av subkapsulær sinus (SCS; Figur 1a). Luminal overflaten AV SCS er dekket med lymfatiske endotelceller og deres kortikale side er støttet av basalmembranen, kalt «gulvet» (Szakal et al., 1983). Spesielt innenfor IFRs, retikulære fibre spredt ut fra gulvet i paracortex (Gretz et al., 1997). Det er viktig at et tynt lag av retikulær struktur også observeres i den ytre delen av folliklene. FRC-lignende stromale celler i follikulært retikulum uttrykker CXCL13 og MAdCAM-1, men ikke Ccl21, noe som indikerer at disse cellene er forskjellige Fra T-sone FRCs, mens FDC-markøren CR1 / CD35 var uoppdaget eller bare svakt uttrykt i disse cellene (Katakai et al .( 2008, Figur 1B og 2A). FDCs genererer ikke retikulære fibre, og følgelig er den retikulære markøren ER-TR7 nesten fraværende i midten av folliklene (Katakai et al., 2004a, b). I tillegg uttrykker retikulære celler i den subkapsulære regionen SPESIFIKT RANKL/TRANCE, som er EN tnf-familie cytokin som er avgjørende for LN-utvikling (Dougall et al., 1999; Kong Et al., 1999). Derfor ble disse stromale cellene antatt å være en ny stromal delmengde og ble utpekt marginale retikulære celler (Mrc; Katakai et al., 2008). Av notatet, en betydelig MENGDE CXCL13 er konstitutivt uttrykt I MRCs i hvile små follikler selv Om FDCs uttrykke undetectable nivåer AV CXCL13 (Figur 1b). Det er godt etablert at den ytre kanten AV PALS i milten, spesielt det som ligger over folliklene, grenser Til Et MAdCAM-1 + stromallag. Cellene som utgjør foringen av kjellermembranen under den marginale sinus (MS) uttrykker OGSÅ CXCL13 og RANKL, noe som indikerer at disse cellene er En Type Mrc (Katakai et al., 2008). I Malter danner retikulære celler som Ligner På Mrc et nettverk i subepitelial dome (SED)-regionen like under kjellermembranen i follikelassosiert epitel (FAE; Katakai et al., 2008; Knoop et al., 2009). Samlet sett antas MRCs å være en stromal delmengde som er vanlig For Sloer, men forskjellig fra FDCs og FRCs.
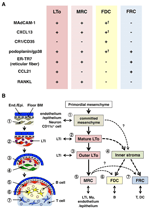
FIGUR 2. Forholdet Mellom Mrc og andre stromal celle undergrupper I Sloer. (A) Mønster av markør uttrykk i stromal celle undergrupper. Ekspresjonsnivåene For MAdCAM-1, CXCL13 og podoplanin / gp38 i Fdc er ofte svake eller ikke-detekterbare ved immunhistokjemi (†). (B) Skjematisk av en generalisert MODELL AV SLO utvikling med plasseringen av stromal celle undergrupper (venstre) og en antatte genealogi av stromal celle undergrupper (høyre). Tall som indikerer celleelementer i venstre tegning representerer stromalcelledelsett vist i riktig skjema. BM, basalmembran; Slutten./ Epi., endotelial eller epitellag.
MRCs og Antigeninngangsveien i Sloer
Sekundære lymfoide organer er preget av spesielle strukturer som filtrerer og transporterer antigener inn i lymfocyttrommene (Figur 1a). LNs er forbundet med lymfekar for å undersøke lymfebårne antigener. Fordi de afferente lymfatene er åpne FOR SCS, er sinus lymfatisk endotel og gulvkjellermembran som den fremre overflaten AV ln-filteret. Milten filtrerer blod, hvor grener av den sentrale arterien åpner FOR MS og marginal sone (MZ), hvor immunceller undersøker blodinnholdet. I disse spesialiserte sinusstrukturer er grensebarrierene lymfatiske endotelet i SCS AV LN og blodendotelet i MS i milten, som begge støttes av MRC retikulum. INTERESSANT ER CD169 + metallofile makrofager selektivt fordelt nær sinusforingen over folliklene, hvorav noen legger seg over endotelbarrieren og overfører partikkelantigener fra sinus lumen inn i lymfocyttkammeret (Szakal et al., 1983; Taylor et al., 2005; Carrasco og Batista, 2007; Phan et al., 2009). DCs som bærer antigener fra vevet via lymfekarene, kommer TIL SCS og beveger seg deretter inn i paracortex over gulvet i interfollikulærkanalen (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). I MALTs fungerer FAE som barrieren der en spesialisert epitelcelle kalt M-celler overfører bakterier eller partikler fra tarmlumen til underliggende DCs eller makrofager (Kraehenbuhl og Neutra, 2000). Derfor støtter Mrc det frontlinjede antigen-transportapparatet i hver SLO. Den grunnleggende utformingen Av SLOs er at folliklene primært er arrangert mot stedet for antigeninngang og ledsages Av T-soner. Således, fra et stromalt synspunkt, synes hele vevsarkitekturen å være organisert mot MRC-laget.Selv om De immunologiske funksjonene Til Mrc forblir unnvikende, ble det tidligere vist at rørnettet konstruert Av Mrc i ytre follikel transporterer små oppløselige antigener til follikulære b-celler Og Fdc (Bajé og Germain, 2009; Roozendaal et al., 2009). DE FLESTE CD169 + makrofager er plassert på den kortikale siden AV scs-gulvet og stikker ut en forlengelse i sinuslumen for å fange partikler (Phan et al., 2009). Dermed Kan MRCs være involvert i lokalisering, morfologi og funksjon av disse makrofager. M-celleutvikling i PPs krever RANKL-RANK signalering, som sannsynligvis styres av ET RANKL-uttrykkende MRC-nettverk like under FAE (Knoop et al ., 2009). Inhibering AV LT-banen, som avskaffer MRC-signaturer i milthvit masse, forstyrrer MS-strukturen (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Videre, forhøyet ICAM-1, VCAM-1, OG CXCL13 uttrykk innebærer At MRCs er involvert i den dynamiske interstitiell migrasjon av follikulære b-celler som en funksjonell stillas. CD169 + makrofager har vist seg å levere partikulære antigener direkte til antigen-spesifikke b-celler i dette området (Carrasco og Batista, 2007; Phan et al., 2009), noe som tyder på AT MRC-nettverksmediert kontroll av b-cellemigrasjon kan påvirke denne prosessen. Siden Mrc er også til stede I IFC-regionen, de muligens regulere transmigrasjon Av DCs fra SCS mot t-sonen.
Mrcs Og Organizer Stromal Celler I SLO Utvikling
Sekundære lymfoide organer utvikles fra anlagen, som er aggregater av mesenkymale og hematopoietiske celler assosiert med kar eller epitel, på et definert sted og periode i fosteret eller spedbarnet (Mebius, 2003). En kritisk hendelse i utviklingen AV SLO anlagen er akkumuleringen AV CD45 + CD4 + CD3-hematopoietiske celler, som også er kjent som lymfoid vev inducer (LTi) celler som interagerer med mesenkymale stromale celler kalt lymfoid vev organizer (LTo) celler (Mebius et al., 1997). En tnf-familie cytokin, lymfotoksin (LT)-α1β som uttrykkes Av LTi-celler overfører signaler til LTo-celler via LT-β reseptor. LTo-celler induserer deretter ekspresjonen AV adhesjonsmolekyler, inkludert ICAM-1, VCAM-1 og MAdCAM-1, og kjemokiner CXCL13, CCL19 og CCL21 (Honda et al., 2001; Cupedo et al., 2004a; Béé et al 2010). SPESIELT ER CXCL13 spesielt viktig for å tiltrekke LTi-celler til anlagen via sin reseptor CXCR5 (Finke et al., 2002; Luther et al., 2003; Jørgen et al., 2003). Det antas at en positiv tilbakemeldingssløyfe, dvs. nylig innvandrende lti-celler som produserer LT, aktiverer LTo stromale celler, og fremmer organisasjonen av anlagen. Etter hvert som lymfocytter begynte å samle seg etter fødselen, ekspanderer vevet og de rom som støttes av forskjellige stromale celledelmengder induseres (Cupedo et al., 2004b; Bajé og Germain 2009).
Marginale retikulære celler og LTo-celler uttrykker et veldig likt mønster av forskjellige markører (Figur 2a), noe som tyder på at det er noe forhold mellom disse to stromale cellene. LTo-celler synes å være mer konsentrert i den marginale regionen AV LN anlagen ved siden av lymfatisk sinus av presumptive SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Dette LTo-cellelaget ser ut til å ekspandere utad med veksten av anlagen, som til slutt ser ut TIL Å bli MRC-laget (Katakai et al., 2008). På samme måte som lymfocytter akkumuleres rundt den sentrale arterien i postnatal milt, Utvides LTo-celler som uttrykker MAdCAM-1 og RANKL med laget og blir MRCs i den hvite massen. Disse funnene tyder sterkt på At Mrc er en direkte etterkommer Av LTo stroma, som bevarer Egenskapene Til LTo-celler på spesialiserte steder innenfor Sloer. SELV RAG-mangelfulle mus utviser et subkapsulært MRC-lag i atrofisk LNs og krympet periarterial MRC-kappe i milten, noe som indikerer AT MRC-utvikling skjer uavhengig av B-og T-celler og er programmert før deres kolonisering (Katakai et al ., 2008). Siden Sloer effektivt prøver antigener for å utløse immunresponser, må antigenoppsamlende strukturer som er konstruert under utvikling opprettholdes etterpå. Følgelig er det rimelig at disse vevstrukturer opprettholdes av organisatorlignende stromale celler gjennom voksen alder.
Forholdet Mellom Mrc og Andre Stromale Undergrupper
Figur 2b viser mulig slektsforskning av stromale undergrupper i Sloer. I embryoet er det primordiale mesenkymet som ligger i nærheten av vaskulaturen eller epitelet forpliktet til å danne anlage-kjernen og tiltrekker LTi-celler. Nerveceller eller andre mindre karakteriserte celler er også involvert i den første prosessen (Veiga-Fernandes et al., 2007; van De Pavert et al., 2009). Akkumuleringen Av lti-celler letter modningen av mesenkymale celler i LTo-celler, noe som til slutt letter konstruksjonen av grunnarkitekturen. Vanligvis Har LTo-celler en tendens til å konsentrere seg i periferien av anlagen og utvide utover med vevsvekst, mens stromale celler utviser svake eller ingen LTo-signaturer omvendt øker i den indre delen av anlagen. Postnatal kolonisering av b-og T-celler fører til rom med induksjon av konvensjonelle stromale undergrupper.
hvis dette skjemaet er riktig, følger det at alle stromal-undergrupper i Voksne Sloer er opprinnelig avledet fra LTo-celler. Dermed Har MRCs som bevarer Egenskapene Til LTo-celler muligheten til å skille seg inn I FDCs eller FRCs? Mrc deler mange signaturer med andre undergrupper (Figur 2a), noe som tyder på at dette er mulig. En spekulasjon er At Mrc fungerer som stromale stamceller som kontinuerlig leverer alle stromale undergrupper gjennom voksen alder. Selv om denne ideen er spennende, vil det kreve forsiktig vurdering og videre validering i fremtiden. Mesenkymceller er generelt svært fleksible i naturen, avhengig av omgivelsene, og dermed kan spesifikke egenskaper enkelt endres. Utvidet dyrking av stromale celler isolert fra LNs resulterer i tapt uttrykk for mange gener, spesielt homeostatiske kjemokiner (Katakai et al., 2004a; Tomei et al., 2009). Dette antyder at in vivo fenotyper av stromalcelledelsmengder opprettholdes optimalt av vevsforholdene, som er reversible og ikke på grunn av terminal differensiering. I tillegg induserer inflammatoriske stimuli den robuste proliferasjonen av stromalceller og den dramatiske remodeling Av Sloer (Katakai et al., 2004a; Chyou et al., 2011). Derfor, Selv Om Mrc – er kan konverteres til andre undergrupper, kan konvensjonelle stromale undergrupper også fornyes selv og være utskiftbare i Voksne Sloer.
Remodeling Av Sloer og Tertiære Lymfoide Strukturer
under immunresponser blir stromale strukturer i Sloer dramatisk ombygd (Gretz et al., 1997; Katakai et al.( 2004a). Noen infeksjoner forårsaker en alvorlig forstyrrelse av vevstrukturer i LNs og milt hvitmasse innen få dager, som gjenopprettes når patogenene er utryddet (Mueller et al ., 2007a, b; Jørgensen et al.( 2008; Johannes Og Abraham, 2009). Denne restaureringsprosessen rekapitulerer sannsynligvis en selvorganiserende prosess via en tilbakemeldingsreaksjon som LIGNER SLO-utvikling. Det er viktig At LTi-lignende celler også er tilstede i voksent vev og regulerer infeksjonsrelatert remodeling av Sloer (Kim et al., 2003; Scandella et al., 2008). Selv Om MRCs rolle i slike prosesser er ukjent, har de muligens en organisasjonsrolle i samarbeid med LTi-lignende celler og bestemmer den ytre rammen Av Sloer under gjenoppbygging.
ved kronisk betennelse forbundet med ulike organpatologier fører et stort antall infiltrerende lymfocytter ofte til organisasjoner som ligner Sloer, kjent som tertiært lymfoidvev (TLTs; Drayton et al., 2006). B-og T-celler er segregerte og tilsvarende nettverk av stromalcelleundergrupper induseres. Det ville være interessant å avgjøre om Mrc er tilstede i disse ektopiske lymfoide strukturer; IMIDLERTID observeres IKKE MRC-lignende celler og relaterte vevstrukturer I Tlt som utviklet seg under mus autoimmun gastritt (Katakai et al., 2006, 2008). Det bør understrekes at Tlt er fundamentalt ikke programmert lymfoide organisasjoner og naturlig ikke forbinder med antigen-transport strukturer. Derfor Er MRCs sannsynligvis fraværende i TLTs. Selv om stromalceller som er fenotypisk lik Mrc kan induseres i noen lesjoner, ville De ikke bli identifisert Som Mrc med mindre de nært forbinder med den spesifikke endotel-eller epitelstrukturen og danner et lagdelt retikulum ved ytre follikler.
Konklusjon
Marginale retikulære celler er en unik stromalcelleundergruppe som er vanlig For Sloer. Mrc er klart forskjellig fra konvensjonelle undergrupper som er indusert eller modnet gjennom interaksjoner med lymfocytter etter fødselen, og er direkte avledet fra LTo stromale celler i anlagen og uavhengig av lymfocytter. Nettverket Av MRCs er nært forbundet med Antigen-transport apparat Av SLOs og antas å direkte eller indirekte kontrollere antigen levering til lymfocytt avdelinger samt lokalisering og migrasjon av immunceller. MRCs sannsynligvis spille sentrale roller i å opprettholde SLO strukturer som det ytre rammeverket og kan konverteres til andre stromal undergrupper ved steady state eller under vev remodeling. Det vil være viktig å kollektivt vurdere alle stromale delmengder, vevstrukturer og immunologiske mikromiljøer for å forstå SLO-systemet grundig.
Interessekonflikt
forfatteren erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
dette arbeidet ble delvis støttet Av Tilskudd til Ung Forsker og For Vitenskapelig Forskning På Innovative Områder fra Departementet For Utdanning, Kultur, Sport, Vitenskap og Teknologi I Japan.
Bajé, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. og Germain, R. N. (2006). Stromalcellenettverk regulerer lymfocyttinngang, migrasjon og territorialitet i lymfeknuter. Immunitet 25, 989-1001.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Bajé, M., Og Germain, R. N. (2009). B-celle follikkel utvikling remodels rørsystemet og tillater løselig antigen levering til follikulære dendritiske celler. Blod 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Bal ④zs, M., Czöpö, T., Weih, D. S., Arnold, H. H. og Weih, F. (2007). Distinkte roller av lymfotoksin-beta-signalering og homeodomain transkripsjonsfaktor Nkx2. 3 i ontogeni av endotelrom i milt. Cellevev Res. 328, 473-486.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Béé, C., Hvit, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., Og Caamañ, J. H. (2010). Ontogeni av stromal organizer celler under lymfeknute utvikling. J. Immunol. 184, 4521–4530.
Pubmed Abstract/Pubmed Full Text
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bö, J., Mü, A., Og Fö, R. (2011). Afferente lymfederiverte T-celler og DCs bruker forskjellige kjemokin-reseptor CCR7-avhengige veier for å komme inn i lymfeknude og intranodal migrasjon. Nat. Immunol. 12, 879–887.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Carrasco, Y. R., Og Batista, F. D. (2007). B-celler erverver partikkelformet antigen i et makrofagrikt område ved grensen mellom follikkelen og den subkapsulære sinus av lymfeknudepunktet. Immunitet 27, 160-171.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., Og Lu, T. t. (2011). Koordinert regulering av lymfeknute vaskulær-stromal vekst først Av CD11c + celler og deretter Av T-og B-celler. J. Immunol. 187, 5558–5567.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., And Mebius, R. E. (2004a). Presumptive lymfeknudearrangører er differensielt representert ved utvikling av mesenteriske og perifere noder. J. Immunol. 173, 2968–2975.
Pubmed Abstract/Pubmed Full Text
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., De Waal-Malefyt, R., Kraal, G., Cyster, J. G., Og Mebius, R. E. (2004b). Initiering av cellulær organisasjon i lymfeknuter reguleres av ikke-b-celle-avledede signaler og er ikke avhengig AV cxc chemokine ligand 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract/Pubmed Full Text
Cyster, J. G. (1999). Kjemokiner og cellemigrasjon i sekundære lymfoide organer. Vitenskap 286, 2098-2102.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A. og Ngo, V. N. (2000). Follikulære stromale celler og lymfocytt homing til follikler. Immunol. Åp 176: 181-193.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., cosman, D., Anderson, D., Morrissey, P. j., Peschon, J. J., Og Schuh, J. (1999). RANG er viktig for utvikling av osteoklast og lymfeknute. Gener Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H., Og Ruddle, N. h. (2006). Lymfoid organutvikling: fra ontogeni til neogenese. Nat. Immunol. 7, 344–353.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, Mj, Rennert, Pd, Choi, Y., Og Littman, D. R. (2004). En viktig funksjon For nukleær reseptor RORy (t) i generering av føtal lymfoid vev inducer celler. Nat. Immunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., Og Kraehenbuhl, J. (2002). CD4 + CD3-celler induserer Peyers patchutvikling: rolle av α4β 1 integrinaktivering AV CXCR5. Immunitet 17, 363-373.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, Ms, Collier, Ar, Boyd, Rl, Og Turley, Sj (2010). Lymfeknutefibroblastiske retikulære celler presenterer perifert vevantigen direkte under steady-state og inflammatoriske tilstander. J. Exp. Med. 207, 689–697.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Anderson, A. O., Og Shaw, S. (1997). Ledninger, kanaler, korridorer og kanaler: kritiske arkitektoniske elementer som letter celleinteraksjoner i lymfeknudebarken. Immunol. Åp 156, 11-24.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., Og Shaw, s. (2000). Lymfebårne kjemokiner og andre molekyler med lav molekylvekt når høye endotelvener via spesialiserte kanaler, mens en funksjonell barriere begrenser tilgangen til lymfocyttmikromiljøene i lymfeknudebarken. J. Exp. Med. 192, 1425–1440.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., Og Nishikawa, S.-I. (2001). Molekylært grunnlag for hematopoietisk / mesenkymal interaksjon under initiering Av Peyers plaster organogenese. J. Exp. Med. 193, 621–630.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Yx, Miele, G., Og Aguzzi, a. (2005). Lymfotoksin-β reseptoravhengige gener i lymfeknute og follikulære dendritiske celletranskriptomer. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., Og Shaw, S. (2001). Romlig og molekylær organisering av lymfeknute T-celle cortex: et labyrintisk hulrom avgrenset av et epitellignende monolag av fibroblastiske retikulære celler forankret til basalmembranlignende ekstracellulær matrise. Int. Immunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H., Og Shimizu, a. (2004a). Lymfeknutefibroblastiske retikulære celler konstruerer stromal retikulum via kontakt med lymfocytter. J. Exp. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, Jh, Gonda, H., Sugai, M., Og Shimizu, a. (2004b). En ny retikulær stromal struktur i lymfeknute cortex: en immuno-plattform for interaksjoner mellom dendritiske celler, T-celler og B-celler. Int. Immunol. 16, 1133–1142.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., Og Shimizu, A. (2006). Spontan storskala lymfoid neogenese og balansert autoimmunitet versus toleranse i magen Av H+ / K+ – ATPase-reaktiv tcr transgen mus. J. Immunol. 177, 7858–7867.Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T. og Shimizu ,a. (2008). Organizer-lignende retikulære stromal celle lag felles for voksne sekundære lymfoide organer. J. Immunol. 181, 6189–6200.Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, Md, Og Lane, P. J. (2003). CD4 + CD3-tilbehørsceller kostimulerer primet CD4 T-celler GJENNOM OX40 og CD30 på steder Der T-celler samarbeider Med B-celler. Immunitet 18, 643-654.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H. og Williams, I. R. (2009). RANKL er nødvendig og tilstrekkelig til å initiere utvikling av antigen-prøvetaking m-celler i tarmepitelet. J. Immunol. 183, 5738–5747.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. og Miyasaka, m. (1996). Den milt marginale sonen er fraværende i alymphoplastic aly mutant mus. Eur. J. Immunol. 26, 669–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., og Penninger, J. M. (1999). OPGL er en nøkkelregulator for osteoklastogenese, utvikling av lymfocytter og organogenese av lymfeknuter. Natur 397, 315-323.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Kraehenbuhl, J. P., Og Neutra, M. R. (2000). Epiteliale m-celler: differensiering og funksjon. Annu. Rev. Celle Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., Og Luther, S. A. (2007). Fibroblastiske retikulære celler i lymfeknuter regulerer homeostasen til naive T-celler. Nat. Immunol. 8, 1255–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., Og Turley, S. J. (2011). Regulert frigjøring av nitrogenoksid ved nonhematopoietisk stroma styrer utvidelse av aktivert t-cellebasseng i lymfeknuter. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., Og Cyster, J. G. (2000). Coexpression av chemokines ELC og SLC Av t sone stromal celler og sletting AV ELC genet i plt / plt mus. Proc. Natl. Acad. Sci. Usa 97, 12694-12699.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Luther, S. A., Ansel, K. M. Og Cyster, J. G. (2003). Overlappende roller AV CXCL13, interleukin 7 reseptor α og CCR7 ligander i lymfeknuteutvikling. J. Exp. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, C. R. (2001). Kjemokiner: immunologiens høye påvirkningsfaktorer. Nat. Immunol. 2, 95–101.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B. Det er en av de mest kjente artene I Verden. (2012). Transkripsjonell profilering av stroma fra betente og hvilende lymfeknuter definerer immunologiske kjennetegn. Nat. Immunol. 13, 499–510.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Mebius, R. E., Rennert, P., Og Weissman, I. L. (1997). Utvikling av lymfeknuter samler CD4 + CD3-LTß + celler som kan differensiere TIL APC -, NK-celler og follikulære celler, men ikke T-eller B-celler. Immunitet 7, 493-504.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Mebius, R. E. (2003). Organogenese av lymfoide vev. Nat. Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R. og Matloubian, M. (2007a). Regulering av homeostatisk kjemokin ekspresjon og cellehandel under immunrespons. Vitenskap 317, 670-674.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P. og Ahmed, R. (2007b). Viral målretting av fibroblastiske retikulære celler bidrar til immunosuppresjon og utholdenhet under kronisk infeksjon. Proc. Natl. Acad. Sci. U. S. A. 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Og Germain, R. N. (2009). Stromal celle bidrar til homeostase og funksjonalitet av immunsystemet. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mü, G., Hö, U. E. og Lipp, M. (2003). VIRKNINGEN AV CCR7 OG CXCR5 på lymfoid organutvikling og systemisk immunitet. Immunol. Åp 195, 117-135.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nolte, M. A., Belië, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., And Mebius, R. E. (2003). Et rørsystem distribuerer kjemokiner og små blodbårne molekyler gjennom den milt hvite massen. J. Exp. Med. 198, 505–512.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O. ,Og Fö, R. (2003). Samarbeidsmekanismer AV CXCR5 og CCR7 i utvikling og organisering av sekundære lymfoide organer. J. Exp. Med. 197, 1199–1204.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A. og von Andrian, U. h. (2001). Inflammatorisk kjemokin transport og presentasjon I HEV: en fjernkontrollmekanisme for monocytt rekruttering til lymfeknuter i betent vev. J. Exp. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Phan, T. G., Grønn, J. A., Grå, E. E., Xu, Y., Og Cyster, J. G. (2009). Immunkompleks relay ved subkapsulære sinuskapsler og noncognate b-celler driver antistoffaffinitetsmodning. Nat. Immunol. 10, 786–793.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Roozendaal, R., Memel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. e., von Andrian, U. H., Og Carroll, M. C. (2009). Kanaler formidler transport av lavmolekylært antigen til lymfeknutefollikler. Immunitet 30, 264-276.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Roozendaal, R., And Mebius, R. E. (2011). Stromal celle-immuncelleinteraksjoner. Annu. Rev. Immunol. 29, 23–43.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T., Og Ludewig, B. (2008). Restaurering av lymfoid organintegritet gjennom samspillet mellom lymfoid vev-inducerceller med stroma I t-cellesonen. Nat. Immunol. 9, 667–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B. og Sorokin, L. (2005). Rørsystemet transporterer oppløselige antigener fra afferent lymfe til residente dendrittiske celler i T-celleområdet i lymfeknuten. Immunitet 22, 19-29.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M., Og Inaba, K. (1997). Dendritiske celler i t-celleområdene av lymfoide organer. Immunol. Åp 156, 25-37.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
St John, Al, Og Abraham, S. N. (2009). Salmonella forstyrrer lymfeknutearkitektur VED TLR4-mediert undertrykkelse av homeostatiske kjemokiner. Nat. Med. 15, 1259–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W., Og Fagarasan, S. (2010). Sensing av miljøstimuli av follikulære dendritiske celler fremmer immunoglobulin en generasjon i tarmen. Immunitet 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C., Og McEvoy, L. M. (1997). Spesialisering av mucosal follikulære dendritiske celler avslørt av mucosal addressin-celle adhesjon molekyl – 1 skjerm. J. Immunol. 158, 5584–5588.
Pubmed Abstract/Pubmed Full Text
Szakal, A. K., Holmes, K. L., Og Tew, J. G. (1983). Transport av immunkomplekser fra subkapsulær sinus til lymfeknudefollikler på overflaten av nonphagocytiske celler, inkludert celler med dendritisk morfologi. J. Immunol. 131, 1714–1727.
Pubmed Abstract/Pubmed Full Text
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., Og Gordon, S. (2005). Makrofagreseptorer og immungjenkjenning. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., Og Szakal, A. K. (1997). Follikulære dendritiske celler og presentasjon av antigen og kostimulerende signaler Til B-celler. Immunol. Åp 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., Og Swartz, M. a. (2009). Fluid flow regulerer stromal celle organisasjon OG ccl21 uttrykk i en vev-konstruert lymfeknute mikromiljø. J. Immunol. 183, 4273–4283.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
van De Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F. I tillegg til dette har Vi også et bredt utvalg av artikler, som Vi kan bruke til å finne ut mer om.I 2009 har vi også et bredt utvalg av artikler, som vi kan bruke til å finne ut mer om. Kjemokin CXCL13 er viktig for lymfeknuteinitiering og induseres av retinsyre og neuronal stimulering. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., Og Kioussis, D. (2007). Tyrosinkinase reseptor ret er en nøkkel regulator Av Peyers patch organogenesis. Natur 446, 547-551.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Victoratos, P., Laggel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., Og Kollias, G. (2006). FDC-spesifikke funksjoner av p55TNFR og IKK2 i utviklingen AV FDC-nettverk og antistoffresponser. Immunitet 24, 65-77.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., Og Chaplin, D. D. (2009). Lymfotoksin LTa1ß2 kontrollerer postnatal og voksen milt marginal sinus vaskulær struktur og funksjon. Immunitet 30, 408-420.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text