Ouabaina
Ouabaina jest glikozydem nasercowym, który hamuje zależną od ATP wymianę sodowo-potasową przez błony komórkowe. Wiązanie ouabainy z pompą sodowo-potasową (zwaną również Atpazą Na+/K+) zapobiega zmianom konformacyjnym niezbędnym do jej prawidłowego funkcjonowania. Wpływa to na wewnątrzkomórkowy skład jonów na różne sposoby, z różnymi efektami, w zależności od komórki i dawki. Związek ten został zatem wykorzystany w medycynie, zarówno jako środek terapeutyczny, jak i w badaniach związanych z aktywnym aktywnym transportem błon.
białko docelowe: Na+/K+ Atpaza

Na+/K+ Atpaza aktywnie transportuje potas do komórki, a sód do przestrzeni pozakomórkowej zgodnie z ogólnym schematem przedstawionym poniżej. To białko przezbłonowe składa się z trzech podjednostek, alfa, beta i gamma, które mogą dimeryzować się z innymi pompami in vivo. Struktura krystaliczna jest promieniowo symetrycznym heksamerem, gdy w żywych tkankach białka najprawdopodobniej łączą się dwustronnie. Łańcuch alfa jest pokazany w kolorze różowym / niebieskim, a łańcuch beta w kolorze żółtym / zielonym. Z tych dwóch podjednostek Alfa odgrywa wiodącą rolę w funkcjonowaniu białka. Wiązka Helis alfa w centrum białka umieszcza hydrofobowe pozostałości Na Zewnątrz motywu, otwierając portal przez dwuwarstwę lipidową. To właśnie wewnątrz tej domeny transbłonowej pozostałości podjednostki Alfa koordynują jony sodu lub potasu. Duża domena po cytoplazmatycznej stronie dwuwarstwy (najdalej od podjednostki beta) unosi się w roztworze i jest odpowiedzialna za wiązanie i hydrolizę ATP. Podobnie jak w przypadku wielu enzymów białkowych hydrolizy fosfoestrów, grupy fosforanowe są koordynowane z a . Energia uwolniona z wysokoenergetycznego rozszczepiania fosforanów jest przenoszona poprzez zmiany konformacyjne do domeny transbłonowej, gdzie jony są wymuszane na gradiencie ich stężenia. Po stronie pozakomórkowej ruchy zapobiegają dysocjacji jonów potasu podczas ich wejścia do komórki. Trzecia podjednostka gamma (fioletowa / pomarańczowa), wraz z podjednostką beta, przyczynia się do zakotwiczenia domen transbłonowych do dwuwarstwy fosfolipidowej.
normalne funkcjonowanie Na+/K+ Atpaza zmienia się jednokierunkowo między dwiema fazami, E1 i E2. W fazie E1 wiąże Na+ i ATP wewnątrz komórki. Po hydrolizie fosforelowane białko wyrzuca ADP i zmienia konformację na E2, umożliwiając dysocjację 3Na+ po zewnątrzkomórkowej stronie błony. Następnie białko wiąże 2K+ i hydrolizuje związany fosforan nieorganiczny, powodując powrót do E1. Tuż przed wiązaniem K+ ze stanem E2 Ouabaina wiąże się z pozostałościami wewnątrz pompy, zapobiegając przejściu z powrotem do e1 (w ten sposób kofaktor magnezowy koordynuje Wiązanie enzymatyczne )
struktura ouabainy i Wiązanie
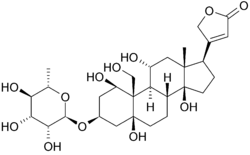
Poniżej znajduje się struktura Oubainy w dwóch wymiarach. Cząsteczka składa się z cukru związanego ze zmodyfikowanym cholesterolem przez wiązanie glikozydowe (stąd glikozyd). Grupy hydroksylowe otaczające większość cząsteczki, wraz z estrami na obu końcach, przyczyniają się do jej wiązania z membranową pompą sodowo-potasową. można go również zobaczyć w trzech wymiarach. Dzięki geometrii molekularnej i stereochemii wyświetlonej w ten sposób, można wyraźniej zobaczyć rozkład polarnych wiązań węgiel-tlen i Niepolarnych wiązań węgiel-węgiel w przestrzeni otaczającej cząsteczkę. Ułatwia to wizualizację wiązania inhibitora. Ouabaina jest do białka wzdłuż wewnętrznej wiązki Alfa-helisy. składniki reszt pomagają nieco koordynować ouabainę przez siły Van der Waalsa, ale pozostałości, glutamina, kwas asparaginowy i treonina, wraz z wiązaniem amidowym alaniny, otaczają grupy hydroksylowe i karbonylowe ligandu, tworząc wiązania wodorowe o długości od 2 do 4 angstromów. To nie tylko utrzymuje lek na miejscu, ale zapobiega zmianom konformacyjnym niezbędnym do funkcjonowania białka.
hamowanie mięśnia sercowego i pompy jonowej
hamowanie na+/K+ ATPazy ma pośredni wpływ na siłę skurczową lub inotrofię komórek mięśnia sercowego. Poprzez wzrost cytoplazmatycznego stężenia sodu aktywowany jest wymiennik sodowo-wapniowy, zwiększając w ten sposób stężenie komórkowe wapnia. Wapń jest drugim przekaźnikiem w wielu szlakach sygnałowych/regulacyjnych. Jego uwalnianie do cytoplazmy komórek mięśniowych sygnalizuje skurcz, wyjaśniając pozytywny wpływ niskich dawek ouabainy na introfię serca. Poniższy obraz przedstawia ten wpływ wszystkich glikozydów nasercowych na tkankę mięśnia sercowego. Jak pokazano, hamowanie pompy sodowo-potasowej powoduje podwyższenie cytoplazmatycznego sodu, który aktywuje pompę sodowo-wapniową, powodując wzrost cytoplazmatycznego wapnia. Zwiększa to siłę, z jaką komórka się kurczy.
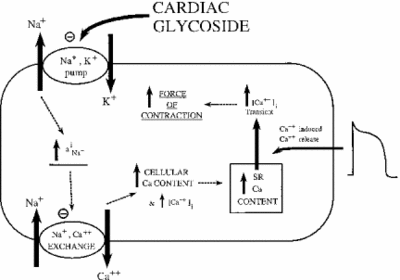
przy prawidłowym podaniu ouabain okazuje się skuteczny w leczeniu niewydolności serca i arytmii. Jednak aktywność ouabainy może pośrednio przyczyniać się do przeciążenia komórek mięśnia sercowego sodem. Pasywne kanały Na+ są zwykle inaktywowane, gdy potencjał membrany jest najwyższy. Kiedy ponownie się otwierają lub nie zamykają, zbyt duża ilość sodu może przedostać się do komórki, powodując marnotrawstwo ATP i/lub nieskoordynowany skurcz mięśni. To się nazywa późne I-Na. Wraz ze wzrostem sodu i wapnia aktywowana jest kinaza zależna od Ca2+ – kalmoduliny, z kolei fosforylująca i aktywująca pasywne kanały Na+. Gdy efekty ouabain są wzmacniane w ten sposób, lek może powodować więcej szkód niż pożytku. Badania wykazały, że skutecznym sposobem zwalczania późnego I-Na jest hamowanie kinazy zależnej od Ca2+-kalmoduliny (Hoyer i wsp . 2011).