frontiere în Imunologie
- Introducere
- Compartimente de celule T și B și două subseturi de celule stromale convenționale
- un Subset Stromal nou identificat, celule reticulare marginale
- MRC și calea de intrare a antigenului în SLOs
- MRC și organizator celulele stromale în dezvoltarea SLO
- relația dintre MRC și alte subseturi stromale
- Remodelarea SLOs și a structurilor limfoide terțiare
- concluzie
- Declarație privind conflictul de interese
- mulțumiri
Introducere
organele/țesuturile limfoide secundare (Slo) sunt esențiale pentru inducerea eficientă a răspunsurilor imune adaptive. Mai multe tipuri de SLOs, inclusiv ganglionii limfatici (LNs), splina și țesuturile limfoide asociate mucoasei (MALTs), cum ar fi patch-urile lui Peyer (PPs), sunt poziționate strategic în diferite locuri din corp. Slo-urile sunt un filtru elaborat care eșantionează antigeni și este echipat cu senzori imuni extrem de sensibili. Pentru a colecta și filtra antigene străine, Slo-urile conțin structuri de țesut specializate care sunt asociate cu endoteliul sau epiteliul. Celulele imune, cum ar fi limfocitele, celulele dendritice (DCs) și macrofagele se acumulează la densități mari și formează compartimente. O caracteristică remarcabilă comună tuturor Slo-urilor este localizarea segregată a celulelor B și a celulelor T. Arhitectura SLOs este susținută de mai multe tipuri de celule stromale non-hematopoietice de origine mezenchimală, care construiesc rețele și definesc compartimente (Mueller și Germain, 2009; Roozendaal și Mebius, 2011). Rețelele stromale oferă nu numai un punct de sprijin funcțional, ci și un spațiu pentru activitățile celulelor imune, precum și un cadru fizic pentru țesut. Mai mult, Dovezile din ce în ce mai mari indică faptul că celulele stromale joacă, de asemenea, roluri critice în funcția celulelor imune și homeostazia (Link și colab., 2007; Fletcher și colab., 2010; Suzuki și colab., 2010; Lukacs-Kornek și colab., 2011). Slo-urile sunt programate să se dezvolte din anlagen care apar în anumite locuri și în perioadele restrânse la făt și Sugar. În plus, celulele stromale sunt cunoscute a fi importante pentru dezvoltarea și întreținerea SLO (Mebius, 2003). Aici, mă concentrez pe un subset stromal identificat recent, celule reticulare marginale (MRC) și rezum caracteristicile acestora. De asemenea, discut relația dintre MRC și structura țesuturilor, alte subseturi stromale și funcții imunologice.
Compartimente de celule T și B și două subseturi de celule stromale convenționale
după cum s-a descris mai sus, celulele B și celulele T se localizează în regiuni distincte din Slo. Celulele B se acumulează pentru a forma foliculi (zona B) în cortexul exterior sub capsulă în LNs sau în teaca limfoidă periarteriolară exterioară (PALS) din splină. Un grup de foliculi mari este țesutul de bază al PPs. În timpul răspunsurilor imune, celulele B activate din foliculi formează centre germinale, unde se diferențiază în producători de anticorpi cu afinitate ridicată (Cyster și colab., 2000). În schimb, celulele T se localizează într-o zonă separată (zona T) adiacentă foliculilor, adică paracortexul din LNs, amicii interiori din splină sau regiunea interfoliculară (IFR) din PPs. DCs se acumulează, de asemenea, în zona T pentru a prezenta antigen și celule T prime (Steinman și colab., 1997).
există două tipuri diferite de subseturi stromale mezenchimale în zonele B și T (figura 1a). Celulele dendritice foliculare (FDC) formează o rețea densă în centrul foliculilor și au primit o atenție considerabilă datorită importanței lor în producerea de anticorpi de către celulele B (Tew și colab., 1997; Cyster și colab., 2000; Victoratos și colab., 2006; Suzuki și colab., 2010). Fdcs exprimă CR1 / CD35, CD23 și, ocazional, MAdCAM-1 (Szabo și colab., 1997; Cyster și colab., 2000). În schimb, o rețea elaborată de celule reticulare fibroblastice (FRC) cuprinde schela zonei T, care produce podoplanină/gp38 și diverse componente ale matricei extracelulare (ECM) (Gretz și colab., 1997; Luther și colab., 2000; Kaldjian și colab., 2001; Katakai și colab., 2004a, b). În general, migrația și localizarea celulelor imune sunt reglementate de o varietate de chemokine (Mackay, 2001). Limfocitele de odihnă și DC-urile mature sunt foarte receptive la „chemokine homeostatice” (Cyster, 1999; m Electicller et al 2003). În concordanță cu aceasta, există corelații clare între chemokinele produse de subseturile de celule stromale și localizarea celulelor imune care exprimă receptorii corespunzători; CXCL13 produs de FDCs este un atractiv al celulelor B care exprimă CXCR5, în timp ce CCL19 și CCL21 din zona T FRCs atrag celulele T și DCs mature prin receptorul comun CCR7 (Cyster, 1999; Cyster și colab., 2000; Luther și colab., 2000). Mai mult, se crede că limfocitele care migrează puternic în parenchimul țesutului pentru a scana antigene utilizează rețelele stromale ca punct de sprijin (Baj Xvnoff et al 2006). O varietate de factori produși de subseturile stromale sunt, de asemenea, necesari pentru activarea și supraviețuirea celulelor imune (Cyster și colab., 2000; Huber și colab., 2005; Link și colab., 2007; Suzuki și colab., 2010; Lukacs-Kornek și colab., 2011; Malhotra și colab., 2012). Prin urmare, structura și funcția rețelei stromale din fiecare compartiment este probabil optimizată pentru activitatea subseturilor de celule imune.
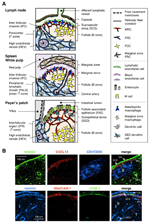
figura 1. Subseturi de celule stromale și structuri tisulare ale Slo. (A) Reprezentarea schematică a structurilor tisulare în Slo-urile de șoarece, cu accent pe celulele stromale și pe aparatul care transportă antigenul. Elementele stromale, inclusiv celulele mezenchimale, endoteliale și epiteliale, precum și celulele mieloide, cum ar fi macrofagele și celulele dendritice (enumerate în panoul din dreapta), sunt desenate pentru accentuare. (B) superior: cadrul de țesut construit de trei tipuri diferite de celule stromale în regiunea corticală exterioară a LN. Imunostimularea fluorescentă a unui șoarece în secțiune. În micrograful superior, există un mic folicul de repaus (B) fără un centru germinal, care este susținut de FDC care exprimă CR1/CD35, dar niveluri nedetectabile de CXCL13. În schimb, MRC-urile formează o rețea reticulară laminină + CXCL13 + în marginea exterioară a foliculului sub capsulă (CA) și SCS. Rețeaua construită de FRCs în paracortex (T) este laminină+CXCL13-CR1/CD35-. Inferior: Stratul MAdCAM – 1 + MRC este strâns asociat cu stratul endotelial limfatic LYVE-1 + în SCS. Rețineți că stratul MRC este extins la zona IFC.
rețeaua stromală din zona T este compusă din FRCs și un pachet ECM cunoscut sub numele de fibră reticulară, care formează o „conductă” care facilitează trecerea substanțelor cu greutate moleculară mică (Gretz și colab., 1997, 2000; Nolte și colab., 2003). Această conductă transportă diverși factori și antigeni solubili adânc în țesut, în timp ce particulele și moleculele mari sunt excluse predominant din compartimentele limfocitelor. Într-adevăr, chemokinele transmise limfatic din țesuturile periferice sunt transportate rapid către venula endotelială înaltă prin conductă pentru a controla mobilizarea celulelor circulante în LNs (Palframan și colab., 2001). În plus, unele DC-uri rezidente contactează direct conducta și captează antigene transmise de limfă (Sixt și colab., 2005).
un Subset Stromal nou identificat, celule reticulare marginale
marginea exterioară a cortexului LN, chiar sub capsulă, este înconjurată de sinusul subcapsular (SCS; figura 1a). Suprafața luminală a SCS este acoperită cu celule endoteliale limfatice, iar partea lor corticală este susținută de membrana bazală, numită „podea” (Szakal și colab., 1983). În special în cadrul IFRs, fibrele reticulare se întind de la podea în paracortex (Gretz și colab., 1997). Important, un strat subțire de structură reticulară este, de asemenea, observat în regiunea exterioară a foliculilor. Celulele stromale asemănătoare FRC din reticulul folicular exprimă CXCL13 și MAdCAM-1, dar nu CCL21, ceea ce indică faptul că aceste celule sunt distincte de FRC din zona T, în timp ce markerul FDC CR1/CD35 a fost nedetectat sau doar slab exprimat în aceste celule (Katakai și colab., 2008; figurile 1B și 2A). FDC nu generează fibre reticulare și, în consecință, markerul reticular ER-TR7 este practic absent în centrul foliculilor (Katakai și colab., 2004a, b). În plus, celulele reticulare din regiunea subcapsulară exprimă în mod specific RANKL/TRANCE, care este o citokină din familia TNF care este esențială pentru dezvoltarea LN (Dougall și colab., 1999; Kong și colab., 1999). Prin urmare, aceste celule stromale au fost considerate a fi un nou subset stromal și au fost desemnate celule reticulare marginale (MRC; Katakai și colab., 2008). De remarcat, o cantitate substanțială de CXCL13 este exprimată constitutiv în MRC în foliculii mici în repaus, chiar dacă FDC exprimă niveluri nedetectabile de CXCL13 (figura 1b). Este bine stabilit că marginea exterioară a prietenilor din splină, în special cea care se află peste foliculi, este mărginită de un strat stromal MAdCAM-1+. Celulele care constituie căptușeala membranei bazale sub sinusul marginal (MS) exprimă, de asemenea, CXCL13 și RANKL, indicând faptul că aceste celule sunt un tip de MRC (Katakai și colab., 2008). În malț, celulele reticulare similare cu MRC formează o rețea în regiunea cupolei subepiteliale (SED) chiar sub membrana bazală a epiteliului asociat foliculului (FAE; Katakai și colab., 2008; Knoop și colab., 2009). Luate împreună, MRC-urile sunt considerate a fi un subset stromal comun Slo-urilor, dar distinct de FDCs și FRC-uri.
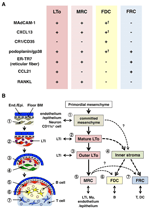
figura 2. Relația dintre MRC și alte subseturi de celule stromale în Slo. (A) model de Expresie marker în subseturi de celule stromale. Nivelurile de Expresie ale MAdCAM-1, CXCL13 și podoplanin/gp38 în FDC-uri sunt adesea slabe sau nedetectabile prin imunohistochimie (XV). (B) schematică a unui model generalizat de dezvoltare SLO cu locațiile subseturilor de celule stromale (stânga) și o genealogie presupusă a subseturilor de celule stromale (dreapta). Numerele care indică elementele celulare din desenul din stânga reprezintă subseturi de celule stromale prezentate în schema din dreapta. BM, membrana bazală; capăt./ Epinefrină., strat endotelial sau epitelial.
MRC și calea de intrare a antigenului în SLOs
organele limfoide secundare sunt caracterizate de structuri specifice care filtrează și transportă antigeni în compartimentele limfocitelor (figura 1a). LNs sunt conectate cu vasele limfatice pentru a studia antigenele transmise de limfa. Deoarece limfaticele aferente sunt deschise SCS, endoteliul limfatic sinusal și membrana subsolului podelei sunt, așa cum s-a spus, suprafața frontală a filtrului LN. Splina filtrează sângele, în care ramurile arterei centrale se deschid către SM și zona marginală (MZ), unde celulele imune examinează conținutul de sânge. În aceste structuri sinusale specializate, barierele de frontieră sunt endoteliul limfatic din SCS al LN și endoteliul sanguin din SM al splinei, ambele fiind susținute de reticulul MRC. Interesant este că macrofagele metalofile CD169 + sunt distribuite selectiv în apropierea căptușelii sinusului peste foliculi, dintre care unele se așează peste bariera endotelială și transmit antigene de particule din lumenul sinusului în compartimentul limfocitelor (Szakal și colab., 1983; Taylor și colab., 2005; Carrasco și Batista, 2007; Phan și colab., 2009). DCs care transportă antigene din țesuturi prin vasele limfatice ajung la SCS și ulterior se deplasează în paracortex pe podeaua canalului interfolicular (IFC; Steinman și colab., 1997; Katakai și colab., 2004b; Braun și colab., 2011). În malț, FAE funcționează ca bariera în care o celulă epitelială specializată numită celule M transferă bacterii sau particule din lumenul intestinal către DCs sau macrofage subiacente (Kraehenbuhl și Neutra, 2000). Prin urmare, MRC-urile susțin aparatul de transport al antigenului din prima linie în fiecare SLO. Designul de bază al SLOs este că foliculii sunt aranjați în primul rând spre locul de intrare a antigenului și sunt însoțiți de zone T. Astfel, din punct de vedere stromal, întreaga arhitectură tisulară pare să fie organizată spre stratul MRC.
deși funcțiile imunologice ale MRC-urilor rămân evazive, s-a demonstrat anterior că rețeaua de conducte construită de MRC-uri în foliculul exterior transportă mici antigene solubile către celulele B foliculare și FDC-uri (Baj Xvnoff și Germain, 2009; Roozendaal și colab., 2009). Majoritatea macrofagelor CD169 + sunt poziționate în partea corticală a podelei SCS și ies în afară o extensie în lumenul sinusului pentru a capta particule (Phan și colab., 2009). Astfel, MRC – urile ar putea fi implicate în localizarea, morfologia și funcția acestor macrofage. Dezvoltarea celulelor M în PPs necesită semnalizare RANKL-RANK, care este probabil controlată de o rețea MRC care exprimă RANKL chiar sub FAE (Knoop și colab., 2009). Inhibarea căii LT, care elimină semnăturile MRC în pulpa albă splenică, perturbă structura MS (Koike și colab., 1996; Balogh și colab., 2007; Katakai și colab., 2008; Zindl și colab., 2009). Mai mult, expresia crescută ICAM-1, VCAM-1 și cxcl13 implică faptul că MRC-urile sunt implicate în migrarea interstițială dinamică a celulelor B foliculare ca schelă funcțională. S-a demonstrat că macrofagele CD169+ livrează direct antigene de particule către celulele B specifice antigenului din această zonă (Carrasco și Batista, 2007; Phan și colab., 2009), sugerând că controlul mediat de rețeaua MRC al migrației celulelor B poate avea impact asupra acestui proces. Deoarece MRC-urile sunt prezente și în regiunea IFC, ele reglează eventual transmigrarea DCs din SCS către zona T.
MRC și organizator celulele stromale în dezvoltarea SLO
organele limfoide secundare se dezvoltă din anlagen, care sunt agregate de celule mezenchimale și hematopoietice asociate cu vasele sau epiteliul, la un loc și o perioadă definite la făt sau sugar (Mebius, 2003). Un eveniment critic în dezvoltarea SLO anlagen este acumularea de CD45+CD4+CD3 – celule hematopoietice, care sunt, de asemenea, cunoscute sub numele de celule inductoare de țesut limfoid (LTi) care interacționează cu celulele stromale mezenchimale numite celule Organizatoare de țesut limfoid (LTo) (Mebius și colab., 1997). O citokină din familia TNF, limfotoxina (LT)-ctf1, care este exprimată de celulele LTi, transmite semnale către celulele LTo prin intermediul receptorului LT-CTF. Celulele LTo induc ulterior expresia moleculelor de adeziune, inclusiv ICAM-1, VCAM-1 și MAdCAM-1 și chemokinele CXCL13, CCL19 și CCL21 (Honda și colab., 2001; Cupedo și colab., 2004a; B. În special, CXCL13 este deosebit de important în atragerea celulelor LTi către anlagen prin intermediul receptorului său CXCR5 (Finke și colab., 2002; Luther și colab., 2003; Ohl și colab., 2003). Se presupune că o buclă de feedback pozitiv, adică. celulele LTi nou imigrante care produc LT activează în continuare celulele stromale LTo, promovând organizarea anlagenului. Pe măsură ce limfocitele au început să se acumuleze după naștere, țesutul se extinde și compartimentele susținute de diferite subseturi de celule stromale sunt induse (Cupedo și colab., 2004b; Baj si Germain 2009).
Celulele reticulare marginale și celulele LTo exprimă un model foarte similar al diferiților markeri (figura 2a), sugerând că există o relație între aceste două celule stromale. Celulele LTo par a fi mai concentrate în regiunea marginală a anlagenului Ln adiacent sinusului limfatic al SCS prezumtiv (Finke și colab., 2002; Cupedo și colab., 2004a; Eberl și colab., 2004; Katakai și colab., 2008). Acest strat de celule LTo pare să se extindă în exterior odată cu creșterea anlagenului, care în cele din urmă pare să devină stratul MRC (Katakai și colab., 2008). La fel, pe măsură ce limfocitele se acumulează în jurul arterei centrale din splina postnatală, celulele LTo care exprimă MAdCAM-1 și RANKL se extind cu stratul și devin MRC în pulpa albă. Aceste constatări sugerează cu tărie că MRC-urile sunt un descendent direct al LTO stroma, care păstrează caracteristicile celulelor LTo în site-urile specializate din Slo. Chiar și șoarecii cu deficit de cârpă prezintă un strat MRC subcapsular în LNs atrofic și învelișuri MRC periarteriale micșorate în splină, indicând faptul că dezvoltarea MRC are loc independent de celulele B și T și este programată înainte de colonizarea lor (Katakai și colab., 2008). Deoarece Slo-urile prelevează eficient antigene pentru a declanșa răspunsuri imune, structurile de colectare a antigenului care sunt construite în timpul dezvoltării trebuie menținute ulterior. În consecință, este rezonabil ca aceste structuri tisulare să fie menținute de celule stromale asemănătoare organizatorilor pe tot parcursul maturității.
relația dintre MRC și alte subseturi stromale
figura 2b prezintă posibila genealogie a subseturilor stromale în Slo. În embrion, mezenchimul primordial care se află în imediata apropiere a vasculaturii sau a epiteliului se angajează să formeze nucleul anlage și atrage celulele LTi. Celulele nervoase sau alte celule mai puțin caracterizate sunt, de asemenea, implicate în procesul inițial (Veiga-Fernandes și colab., 2007; van de Pavert și colab., 2009). Acumularea celulelor LTi facilitează maturarea celulelor mezenchimale în celule LTo, ceea ce facilitează în cele din urmă construirea arhitecturii de bază. De obicei, celulele LTo tind să se concentreze la periferia anlajului și să se extindă spre exterior cu creșterea țesutului, în timp ce celulele stromale care prezintă semnături LTO slabe sau deloc cresc invers în porțiunea interioară a anlajului. Colonizarea postnatală a celulelor B și T duce la compartimente cu inducerea subseturilor stromale convenționale.
dacă această schemă este corectă, rezultă că toate subseturile stromale din Slo-urile adulte sunt inițial derivate din celulele LTo. Astfel, MRC-urile care păstrează caracteristicile celulelor LTo au capacitatea de a se diferenția în FDCs sau FRC-uri? MRC-urile împărtășesc multe semnături cu alte subseturi (figura 2A), sugerând că acest lucru este posibil. O speculație este că MRC-urile funcționează ca celule stem stromale care furnizează continuu toate subseturile stromale de-a lungul vârstei adulte. Deși această idee este interesantă, va necesita o analiză prudentă și o validare ulterioară în viitor. Celulele mezenchimale sunt, în general, foarte flexibile în natură, în funcție de mediul înconjurător și, prin urmare, caracteristicile specifice pot fi ușor schimbate. Cultivarea extinsă a celulelor stromale izolate din LNs duce la pierderea expresiei pentru multe gene, în special chemokine homeostatice (Katakai și colab., 2004a; Tomei și colab., 2009). Acest lucru sugerează că fenotipurile in vivo ale subseturilor de celule stromale sunt menținute optim de circumstanțele tisulare, care sunt reversibile și nu se datorează diferențierii terminale. În plus, stimulii inflamatori induc proliferarea robustă a celulelor stromale și remodelarea dramatică a Slo (Katakai și colab., 2004a; Chyou și colab., 2011). Prin urmare, deși MRC-urile ar putea fi convertite în alte subseturi, subseturile stromale convenționale ar putea, de asemenea, să se reînnoiască și să fie interschimbabile în Slo-urile adulte.
Remodelarea SLOs și a structurilor limfoide terțiare
în timpul răspunsurilor imune, structurile stromale din SLOs sunt remodelate dramatic (Gretz și colab., 1997; Katakai și colab., 2004a). Unele infecții provoacă o perturbare severă a structurilor tisulare din LNs și pulpa albă splenică în câteva zile, care este restabilită pe măsură ce agenții patogeni sunt eradicați (Mueller și colab., 2007a, b; Scandella și colab., 2008; Sfântul Ioan și Avraam, 2009). Acest proces de restaurare recapitulează probabil un proces de auto-organizare printr-o reacție de feedback similară dezvoltării SLO. Important, celulele asemănătoare LTi sunt, de asemenea, prezente în țesuturile adulte și reglează remodelarea Slo asociată infecției (Kim și colab., 2003; Scandella și colab., 2008). Deși rolul MRC – urilor în astfel de procese nu este cunoscut, ele pot avea un rol de organizare în colaborare cu celule asemănătoare LTi și determină cadrul exterior al Slo-urilor în timpul reconstrucției.
în inflamația cronică asociată cu diferite patologii ale organelor, un număr mare de limfocite infiltrate duc adesea la organizații similare cu Slo, cunoscute sub numele de țesuturi limfoide terțiare (Tlts; Drayton și colab., 2006). Celulele B și T sunt segregate și sunt induse rețele corespunzătoare de subseturi de celule stromale. Ar fi interesant să se determine dacă MRC-urile sunt prezente în aceste structuri limfoide ectopice; cu toate acestea, celulele asemănătoare MRC și structurile tisulare conexe nu sunt observate în TLT-urile care s-au dezvoltat în timpul gastritei autoimune de șoarece (Katakai și colab., 2006, 2008). Trebuie subliniat faptul că TLT-urile nu sunt în mod fundamental organizații limfoide programate și, în mod natural, nu se asociază cu structurile care transportă antigenul. Prin urmare, MRC-urile sunt probabil absente în TLT-uri. Chiar dacă celulele stromale care sunt similare fenotipic cu MRC ar putea fi induse în unele leziuni, acestea nu ar fi identificate ca MRC decât dacă se asociază îndeaproape cu structura endotelială sau epitelială specifică și formează un reticul stratificat la foliculii exteriori.
concluzie
Celulele reticulare marginale sunt un subset unic de celule stromale comun SLOs. MRC-urile sunt în mod clar diferite de subseturile convenționale care sunt induse sau maturate prin interacțiuni cu limfocitele după naștere și sunt derivate direct din celulele stromale LTo din anlagen și independente de limfocite. Rețeaua de MRCs este strâns asociată cu aparatul de transport al antigenului SLOs și se crede că controlează direct sau indirect livrarea antigenului în compartimentele limfocitelor, precum și localizarea și migrarea celulelor imune. MRC-urile joacă probabil roluri esențiale în menținerea structurilor SLO ca cadru exterior și pot fi convertite în alte subseturi stromale la starea de echilibru sau în timpul remodelării țesuturilor. Va fi important să se ia în considerare în mod colectiv toate subseturile stromale, structurile tisulare și micromediile imunologice pentru a înțelege în mod cuprinzător sistemul SLO.
Declarație privind conflictul de interese
autorul declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
această lucrare a fost susținută parțial de Grant-in-Aid pentru tineri oameni de știință și pentru cercetarea științifică pe domenii inovatoare de la Ministerul Educației, Culturii, Sportului, științei și Tehnologiei din Japonia.
Baj, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. și Germain, R. N. (2006). Rețelele celulare stromale reglează intrarea, migrația și teritorialitatea limfocitelor în ganglionii limfatici. Imunitatea 25, 989-1001.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Baj, M., și Germain, R. N. (2009). Dezvoltarea foliculului cu celule B remodelează sistemul de conducte și permite livrarea antigenului solubil către celulele dendritice foliculare. Sânge 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Bal Inquxzs, M., CZ Inquxmp Inqully, T., Weih, D. S., Arnold, H. H., and Weih, F. (2007). Roluri distincte ale semnalizării limfotoxinei-beta și ale factorului de transcripție homeodomain Nkx2.3 în ontogenia compartimentelor endoteliale din splină. Țesutul Celular Rez. 328, 473-486.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
b Inktivn Inktivzech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., și Caama Inktivo, J. H. (2010). Ontogenia celulelor organizatorice stromale în timpul dezvoltării ganglionilor limfatici. J. Immunol. 184, 4521–4530.
Pubmed Abstract/Pubmed Full Text
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., b Unkticlter, J., M Unkticlk, A. și F Unkticrster, R. (2011). Celulele T derivate din limfa aferente și DCs utilizează diferite căi dependente de receptorul chemokinei CCR7 pentru intrarea în ganglionul limfatic și migrația intranodală. Nat. Immunol. 12, 879–887.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Carrasco, Y. R. și Batista, F. D. (2007). Celulele B dobândesc antigen de particule într-o zonă bogată în macrofage la limita dintre folicul și sinusul subcapsular al ganglionului limfatic. Imunitatea 27, 160-171.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. și Lu, T. T. (2011). Reglarea coordonată a creșterii vasculare-stromale a ganglionilor limfatici mai întâi de către celulele CD11c+ și apoi de celulele T și B. J. Immunol. 187, 5558–5567.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., de Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., și Mebius, R. E. (2004a). Organizatorii prezumtivi ai ganglionilor limfatici sunt reprezentați diferențiat în dezvoltarea nodurilor mezenterice și periferice. J. Immunol. 173, 2968–2975.
Pubmed Abstract/Pubmed Full Text
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., De Waal-Malefyt, R., Kraal, G., Cyster, J. G. și Mebius, R. E. (2004b). Inițierea organizării celulare în ganglionii limfatici este reglementată de semnale derivate din celule non-B și nu depinde de ligandul chemokin CXC 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract/Pubmed Full Text
Cyster, J. G. (1999). Chemokine și migrarea celulelor în organele limfoide secundare. Știință 286, 2098-2102.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A. și Ngo, V. N. (2000). Celulele stromale foliculare și limfocitele care se apropie de foliculi. Immunol. Apocalipsa 176: 181-193.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J. și Schuh, J. (1999). Rangul este esențial pentru dezvoltarea osteoclastelor și a ganglionilor limfatici. Gene Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H. și Ruddle, N. H. (2006). Dezvoltarea organelor limfoide: de la ontogenie la neogeneză. Nat. Immunol. 7, 344–353.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y. și Littman, D. R. (2004). O funcție esențială pentru receptorul nuclear Rory (t) în generarea celulelor inductoare ale țesutului limfoid fetal. Nat. Immunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M. și Kraehenbuhl, J. (2002). CD4 + CD3-celulele induc dezvoltarea patch-urilor lui Peyer: rolul activării integrinei de către cxcr5 de către centi-x4-X1. Imunitatea 17, 363-373.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, ms, Collier, A. R., Boyd, R. L. și Turley, S. J. (2010). Celulele reticulare fibroblastice ale ganglionilor limfatici prezintă direct antigenul țesutului periferic în condiții de echilibru și inflamatorii. J. Exp. Med. 207, 689–697.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Anderson, A. O. și Shaw, S. (1997). Cabluri, Canale, coridoare și conducte: elemente arhitecturale critice care facilitează interacțiunile celulare în cortexul ganglionilor limfatici. Immunol. Rev. 156, 11-24.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E. și Shaw, S. (2000). Chemokinele transmise prin limfă și alte molecule cu greutate moleculară mică ajung la venule endoteliale ridicate prin conducte specializate, în timp ce o barieră funcțională limitează accesul la micromediul limfocitelor din cortexul ganglionilor limfatici. J. Exp. Med. 192, 1425–1440.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T. și Nishikawa, S.-I. (2001). Baza moleculară pentru interacțiunea hematopoietică / mezenchimală în timpul inițierii organogenezei plasturelui Peyer. J. Exp. Med. 193, 621–630.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, Mr, Heinen, E., Fu, Y. X., Miele, G. și Aguzzi, A. (2005). Limfotoxină-gene dependente de receptor în cromozomul limfatic și transcriptomii celulelor dendritice foliculare. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y. și Shaw, S. (2001). Organizarea spațială și moleculară a cortexului celulelor T ale ganglionilor limfatici: o cavitate labirintică delimitată de un monostrat asemănător epiteliului de celule reticulare fibroblastice ancorate la matricea extracelulară asemănătoare membranei bazale. Int. Immunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H. și Shimizu, A. (2004a). Celulele reticulare fibroblastice ale ganglionilor limfatici construiesc reticulul stromal prin contactul cu limfocitele. J. Exp. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, JH, Gonda, H., Sugai, M. și Shimizu, A. (2004b). O nouă structură stromală reticulară în cortexul ganglionilor limfatici: o imuno-platformă pentru interacțiunile dintre celulele dendritice, celulele T și celulele B. Int. Immunol. 16, 1133–1142.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Katakai, T., Nomura | T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S. și Shimizu, A. (2006). Neogeneza limfoidă spontană la scară largă și autoimunitatea echilibrată față de toleranța în stomacul șoarecelui transgenic TCR reactiv H+/K+-ATPază. J. Immunol. 177, 7858–7867.
Pubmed Abstract/Pubmed Full Text
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T. și Shimizu, A. (2008). Organizator – like reticular stromal cell layer comun pentru organele limfoide secundare adulte. J. Immunol. 181, 6189–6200.
Pubmed Abstract/Pubmed Full Text
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, MD și Lane, P. J. (2003). CD4 + CD3-celulele accesorii costimulează celulele T CD4 amorsate prin OX40 și CD30 în locurile în care celulele T colaborează cu celulele B. Imunitatea 18, 643-654.
Pubmed Abstract / Pubmed Full Text | CrossRef Full Text
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., și Williams, I. R. (2009). RANKL este necesar și suficient pentru a iniția dezvoltarea celulelor m de prelevare a antigenului în epiteliul intestinal. J. Immunol. 183, 5738–5747.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. și Miyasaka, M. (1996). Zona marginală splenică este absentă la șoarecii aly mutanți alimfoplastici. Eur. J. Immunol. 26, 669–675.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J. și Penninger, J. M. (1999). OPGL este un regulator cheie al osteoclastogenezei, dezvoltării limfocitelor și organogenezei ganglionilor limfatici. Natură 397, 315-323.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kraehenbuhl, J. P. și Neutra, Mr (2000). Celulele m epiteliale: diferențiere și funcție. Anu. Rev. Mobil Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Link, A., Vogt, T. K., Favre, S., Britschgi, Mr, Acha-Orbea, H., Hinz, B., Cyster, J. G. și Luther, S. A. (2007). Celulele reticulare fibroblastice din ganglionii limfatici reglează homeostazia celulelor T naive. Nat. Immunol. 8, 1255–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R. și Turley, S. J. (2011). Eliberarea reglementată a oxidului nitric de către stroma nonhematopoietică controlează extinderea bazinului de celule T activate în ganglionii limfatici. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G. și Cyster, J. G. (2000). Coexpresia chemokinelor ELC și SLC de către celulele stromale din zona T și ștergerea genei ELC la șoarecele plt/plt. Proc. Natl. Acad. Sci. SUA 97, 12694-12699.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, S. A., Ansel, K. M., și Cyster, J. G. (2003). Rolurile suprapuse ale cxcl13, receptorul interleukinei 7, liganzii ccr7 și ccr7 în dezvoltarea ganglionilor limfatici. J. Exp. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, C. R. (2001). Chemokine: factorii de impact ai imunologiei. Nat. Immunol. 2, 95–101.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J. și Consorțiul proiectului genomului imunologic. (2012). Profilarea transcripțională a stromei din ganglionii limfatici inflamați și în repaus definește semnele imunologice. Nat. Immunol. 13, 499–510.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E., Rennert, P. și Weissman, I. L. (1997). Ganglionii limfatici în curs de dezvoltare colectează celule CD4 + CD3-Lt XV + care se pot diferenția de celulele APC, NK și celulele foliculare, dar nu celulele T sau B. Imunitatea 7, 493-504.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E. (2003). Organogeneza țesuturilor limfoide. Nat. Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., și Matloubian, M. (2007a). Reglarea expresiei chemokinei homeostatice și a traficului de celule în timpul răspunsurilor imune. Știință 317, 670-674.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P. și Ahmed, R. (2007b). Direcționarea virală a celulelor reticulare fibroblastice contribuie la imunosupresie și persistență în timpul infecției cronice. Proc. Natl. Acad. Sci. SUA 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N. și Germain, R. N. (2009). Celula stromală contribuie la homeostazia și funcționalitatea sistemului imunitar. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
m Okticller, G., H Inktiptpken, U. E. și Lipp, M. (2003). Impactul CCR7 și CXCR5 asupra dezvoltării organelor limfoide și a imunității sistemice. Immunol. Rev. 195, 117-135.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nolte, M. A., Beli-Eestermans, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., și Mebius, R. E. (2003). Un sistem de conducte distribuie chemokine și molecule mici transmise de sânge prin pulpa albă splenică. J. Exp. Med. 198, 505–512.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., și F Unktocrster, R. (2003). Mecanismele de cooperare ale CXCR5 și CCR7 în dezvoltarea și organizarea organelor limfoide secundare. J. Exp. Med. 197, 1199–1204.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A. și von Andrian, U. H. (2001). Transportul și prezentarea chemokinei inflamatorii în HEV: un mecanism de control de la distanță pentru recrutarea monocitelor la ganglionii limfatici în țesuturile inflamate. J. Exp. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Phan, T. G., Verde, J. A., Gri, E. E., Xu, Y., și Cyster, J. G. (2009). Releul complex imunitar prin macrofage sinusale subcapsulare și celule B noncognate conduce maturarea afinității anticorpilor. Nat. Immunol. 10, 786–793.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Roozendaal, R., Mempel, T. R., Ulcior, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H. și Carroll, M. C. (2009). Conductele mediază transportul antigenului cu greutate moleculară mică la foliculii ganglionilor limfatici. Imunitatea 30, 264-276.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Roozendaal, R., și Mebius, R. E. (2011). Celule stromale-interacțiuni celulare imune. Anu. Rev. Immunol. 29, 23–43.
Pubmed Abstract / Pubmed Full Text | CrossRef Full Text
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T. și Ludewig, B. (2008). Restaurarea integrității organelor limfoide prin interacțiunea celulelor inductoare de țesut limfoid cu stroma zonei celulelor T. Nat. Immunol. 9, 667–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, MB, și Sorokin, L. (2005). Sistemul de conducte transportă antigene solubile de la limfa aferentă la celulele dendritice rezidente din zona celulei T a ganglionului limfatic. Imunitatea 22, 19-29.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M. și Inaba, K. (1997). Celulele dendritice din zonele celulelor T ale organelor limfoide. Immunol. Rev. 156, 25-37.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
St John, A. L. și Abraham, S. N. (2009). Salmonella perturbă arhitectura ganglionilor limfatici prin suprimarea mediată de TLR4 a chemokinelor homeostatice. Nat. Med. 15, 1259–1265.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W. și Fagarasan, S. (2010). Detectarea stimulilor de mediu de către celulele dendritice foliculare promovează imunoglobulina A generație în intestin. Imunitatea 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C. și McEvoy, L. M. (1997). Specializarea celulelor dendritice foliculare ale mucoasei revelate prin molecula de adeziune a adresinei celulare a mucoasei-1 afișaj. J. Immunol. 158, 5584–5588.
Pubmed Abstract / Pubmed Full Text
Szakal, A. K., Holmes, K. L., și Tew, J. G. (1983). Transportul complexelor imune de la sinusul subcapsular la foliculii ganglionilor limfatici pe suprafața celulelor nonfagocitare, inclusiv celulele cu morfologie dendritică. J. Immunol. 131, 1714–1727.
Pubmed Abstract/Pubmed Full Text
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D. și Gordon, S. (2005). Receptori macrofagi și recunoaștere imună. Anu. Rev. Immunol. 23, 901–944.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., și Szakal, A. K. (1997). Celulele dendritice foliculare și prezentarea antigenului și a semnalelor costimulatoare către celulele B. Immunol. Rev. 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A. și Swartz, M. A. (2009). Fluxul de Fluid reglează organizarea celulelor stromale și expresia CCL21 într-un micromediu ganglionar creat de țesut. J. Immunol. 183, 4273–4283.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., H Inktiptpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., De Jonge, W. J. și Mebius, R. E. (2009). Chemokina CXCL13 este esențială pentru inițierea ganglionilor limfatici și este indusă de acidul retinoic și stimularea neuronală. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., și Kioussis, D. (2007). Receptorul tirozin kinazei RET este un regulator cheie al organogenezei plasturelui Peyer. Natură 446, 547-551.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., și Kollias, G. (2006). Funcții specifice FDC ale p55TNFR și IKK2 în dezvoltarea rețelelor FDC și a răspunsurilor la anticorpi. Imunitatea 24, 65-77.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D. și Chaplin, D. D. (2009). Limfotoxina Lta1 CT2 controlează structura și funcția vasculară sinusală marginală a splinei postnatale și adulte. Imunitatea 30, 408-420.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text