Geometria moleculară SF6, Structura, forma și polaritatea Lewis
hexafluorura de sulf sau SF6 este un gaz anorganic, cu efect de seră. Este neinflamabil, inodor și incolor și este un izolator excelent. Este o moleculă octaedrică hipervalentă care a fost un subiect interesant de conversație în rândul pasionaților de chimie.Henri Moissan a descoperit existența SF6. De altfel, el este și descoperitorul fluorului. Modul standard de sintetizare SF6 este de a expune S8 la F2. Această metodă determină formarea câtorva fluoruri de sulf, dar acestea pot fi eliminate prin încălzire și apoi folosind NaOH pentru a elimina orice molecule suplimentare SF4.SF6 nu poate fi utilizat imediat după sinteză. Trebuie purificat pentru a scăpa de toate fluorurile reactive. După aceea, trebuie să treacă prin piroliză. aici, în această postare pe blog, vom învăța structura Lewis a SF6 și unghiurile sale de legătură, geometria moleculară și forma care ne pot ajuta să înțelegem proprietățile fizice ale acestei molecule.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Structura oricărei molecule, trebuie mai întâi să cunoaștem numărul total de electroni de valență. Aici vom afla numărul total de electroni de valență pentru SF6 prin adăugarea electronilor de valență atât pentru atomii de sulf, cât și pentru cei de fluor.
numărul total de electroni de valență în SF6 – electroni de valență ai sulfului + electroni de valență ai fluorului
sulful are șase electroni de valență.
fluorul are șapte electroni de valență, dar deoarece există șase atomi de fluor în această moleculă, vom înmulți acest număr cu 6.
= 6 + 7*6
= 6 + 42
= 48 electroni de valență
astfel SF6 are 48 electroni de valență care ne vor ajuta să desenăm structura punct Lewis a SF6.
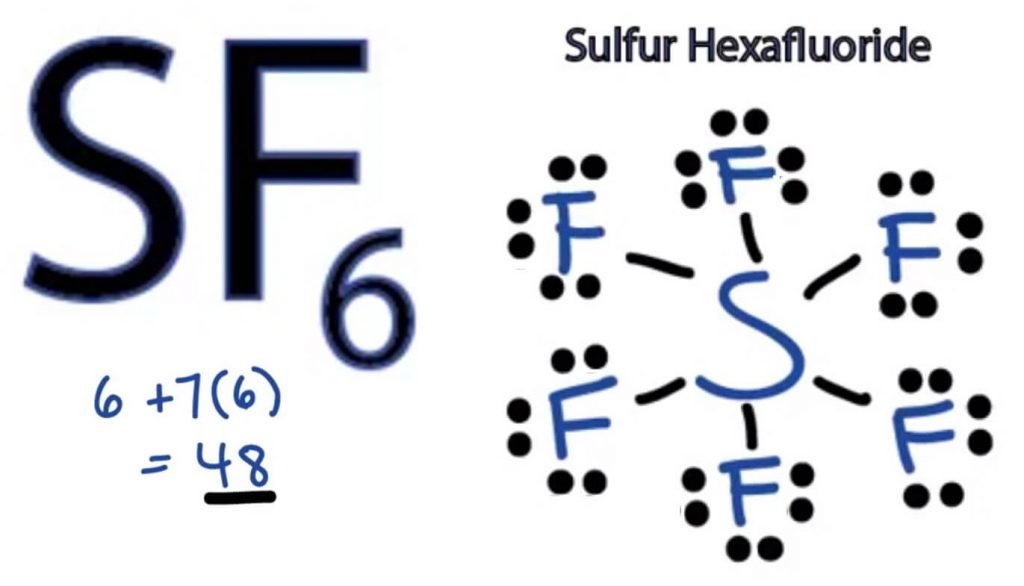
SF6 structura Lewis
structura punct Lewis a oricărei molecule este o reprezentare picturală a atomilor implicați în formarea structurii și a electronilor săi de valență individuali. Această structură ne ajută să cunoaștem formațiunile de legătură din moleculă și dispunerea electronilor în ea.
atomul de sulf va ocupa poziția centrală, deoarece este mai puțin electronegativ decât fluorul. Așadar, așezați-l în centru și toți atomii de fluor din jurul său astfel:
atomul de fluor are nevoie de un singur electron de valență pentru a-și completa octetul. Deoarece fiecare atom urmează regula octetului pentru a atinge o structură stabilă, atomul de fluor va împărți un electron de valență al atomului de sulf. Astfel, sulful va împărți șase dintre electronii săi de valență cu toți atomii de fluor care au ca rezultat formarea a șase legături unice între S și F.
în structura Lewis, arătăm legăturile din structură trasând o linie dreaptă între doi atomi. Deci toate aceste legături vor prelua 12 electroni de valență din 48.
plasați toți electronii de valență rămași în jurul atomilor de fluor și verificați dacă octeții tuturor atomilor de fluor sunt compleți.
odată ce faceți acest lucru, veți vedea electroni de valență în învelișurile exterioare ale tuturor atomilor de fluor, dar sulful are mai mult de 8 electroni în învelișul său exterior. Acest lucru se datorează faptului că este o excepție de la rolul octetului și își poate extinde orbitalul pentru a găzdui mai mulți electroni.
prin urmare, aceasta este structura Lewis corectă a SF6.
hibridizarea SF6
acum, că știm structura Lewis a SF6, putem determina hibridizarea atomilor în moleculă. Aici, pe măsură ce sulful își împarte electronii cu atomii de fluor, ne vom uita la hibridizarea sa.
configurația electronică a SF6 în starea sa de bază este 3s23p4. Dar când împarte electroni și este în stare excitată, perechile de electroni din orbitalii 3S și 3p devin nepereche. Acești electroni se deplasează pentru a umple orbitalii 3D mai înalți. Ca rezultat, se formează șase orbitali hibrizi ( unul din 3s, trei din 3p și doi 3d). Acești orbitali hibrizi sunt cei care găzduiesc electronii împărțiți. Acești orbitali se suprapun cu orbitalii 2p ai atomului de fluor atunci când atomii de sulf și fluor formează legături. Acești șase orbitali se află în cele șase direcții ale formei octaedrului.
prin urmare, hexafluorura de sulf are hibridizare sp3d2.
SF6 unghi de legătură
deoarece sulful își împarte electronii de valență cu 6 atomi de fluor, putem vedea că toți cei șase electroni ai atomului de sulf sunt împărțiți pentru a forma legături. Unghiul de legătură al F-S-F este de 90 de grade.
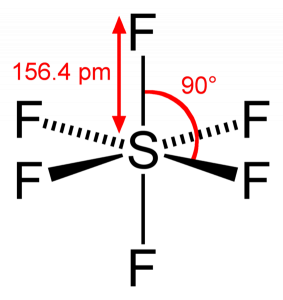
SF6 Geometrie moleculară
când ne uităm la molecula de hexafluorură de sulf, sulful se află în poziția centrală cu atomii de fluor dispuși simetric în jurul său. Atomii sunt plasați în modelul octaedric, ceea ce face ca geometria moleculară a SF6 să fie octaedrică.
forma SF6
privind geometria moleculară a moleculei, putem spune că molecula SF6 are o formă octaedrică, deoarece are opt laturi. Cu toate acestea, atomul central se leagă cu șase atomi de fluor, forma SF6 este octaedrică.

este SF6 polar sau nepolar?
SF6 este o moleculă nepolară. Acest lucru se datorează faptului că teoria VSEPR spune că atunci când șase atomi de fluor sunt aranjați simetric în jurul atomului de sulf, dipolii de legătură sunt anulați. Ca rezultat, este o moleculă nepolară.

De asemenea, are aceleași proprietăți ca moleculele nepolare, cum ar fi faptul că nu sunt solubile în apă și sunt solubile în solvenți organici nepolari.pentru a rezuma acest articol, putem spune că în structura punct Lewis a SF6, toți electronii de valență sunt epuizați, ceea ce duce la formarea a șase legături unice între S-F fără perechi singulare de electroni.
hibridizarea sulfului în această moleculă este sp3d2 cu unghiurile de legătură de 90 de grade.
geometria moleculară a SF6 este octaedrică și este o moleculă nepolară.