SF6 moleculaire geometrie, Lewis structuur, vorm en polariteit
zwavelhexafluoride of SF6 is een anorganisch broeikasgas. Het is niet brandbaar, reukloos en kleurloos en is een uitstekende isolator. Het is een hypervalente octaëdrische molecule die een interessant onderwerp van gesprek onder chemieliefhebbers is geweest.
Henri Moissan ontdekte het bestaan van SF6. Overigens is hij ook de ontdekker van fluor. De standaard manier om SF6 te synthetiseren is om S8 bloot te stellen aan F2. Deze methode veroorzaakt de vorming van een paar zwavelfluoriden, maar die kunnen worden geëlimineerd door verhitting en vervolgens met behulp van NaOH om eventuele extra SF4-moleculen te verwijderen.
SF6 kan niet onmiddellijk na synthese worden gebruikt. Het moet gezuiverd worden om van alle reactieve fluoriden af te komen. Daarna moet het door pyrolyse.
hier in deze blogpost zullen we de Lewis-structuur van SF6 leren en zijn Bindingshoeken, moleculaire geometrie en vorm die ons kunnen helpen de fysische eigenschappen van dit molecuul te begrijpen.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Structuur van elk molecuul, moeten we eerst het totale aantal valentie-elektronen weten. Hier zullen we het totale aantal valentie-elektronen voor SF6 achterhalen door de valentie-elektronen voor zowel zwavel-als fluor-atomen toe te voegen.
totaal aantal valentie-elektronen in SF6-valentie-elektronen van zwavel + valentie-elektronen van Fluor
zwavel heeft zes valentie-elektronen.
Fluor heeft zeven valentie-elektronen, maar omdat er zes Fluor-atomen in dit molecuul zitten, zullen we dit getal vermenigvuldigen met 6.
= 6 + 7*6
= 6 + 42
= 48 valentie-elektronen
dus SF6 heeft 48 valentie-elektronen die ons zullen helpen de Lewis-Dot-structuur van SF6 te tekenen.
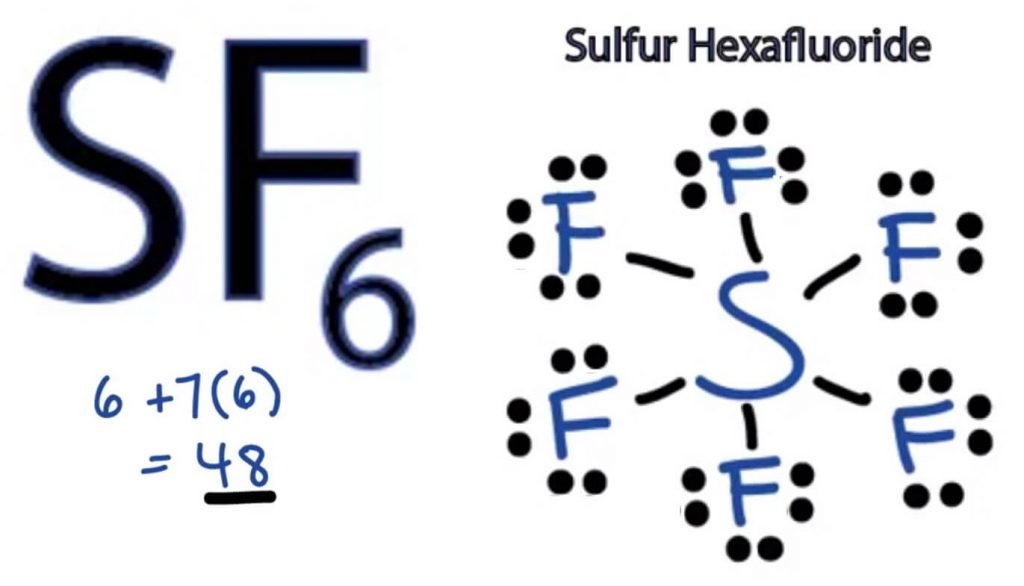
SF6 Lewis-structuur
De Lewis-Dot-structuur van een molecuul is een picturale representatie van de atomen die betrokken zijn bij de vorming van de structuur en de individuele valentie-elektronen. Deze structuur helpt ons de bindingsformaties in het molecuul en de rangschikking van elektronen erin te kennen.
zwavelatoom neemt de centrale positie in omdat het minder elektronegatief is dan Fluor. Dus plaats het in het centrum en alle fluoratomen eromheen als volgt:
Fluor atoom heeft slechts één valentie elektron nodig om zijn octet te voltooien. Aangezien elk atoom de octetregel volgt om een stabiele structuur te bereiken, zal het fluor-atoom één valentie-elektron van het zwavelatoom delen. Zwavel zal dus zes van zijn valentie-elektronen delen met alle fluor-atomen die resulteren in het vormen van zes enkelvoudige bindingen tussen s en F.
In Lewis-structuur laten we de bindingen in de structuur zien door een rechte lijn tussen twee atomen te tekenen. Dus al deze bindingen nemen 12 valentie-elektronen op van de 48.
plaats alle resterende valentie-elektronen rond de fluor-atomen en controleer of de octetten van alle fluor-atomen compleet zijn.
als je dat doet, zie je valentie-elektronen in de buitenste schil van alle Fluor-atomen, maar zwavel heeft meer dan 8 elektronen in de buitenste schil. Dit komt omdat het een uitzondering is op de octetrol en zijn orbitaal kan uitbreiden om meer elektronen te kunnen ontvangen.
Dit is dus de juiste Lewis structuur van SF6.
SF6 hybridisatie
nu we de Lewis structuur van SF6 kennen, kunnen we nu de hybridisatie van atomen in het molecuul bepalen. Hier, terwijl zwavel zijn elektronen deelt met de fluoratomen, zullen we kijken naar de hybridisatie ervan.
De elektronische configuratie van SF6 in de grondtoestand is 3s23p4. Maar als het elektronen deelt en in de opgewekte toestand is, worden de elektronenparen in zowel 3S als 3p orbitalen ongepaard. Deze elektronen bewegen om de hogere vacante 3d orbitalen te vullen. Als gevolg hiervan worden zes hybride orbitalen gevormd (een van 3s, drie van 3p en twee 3d). Deze hybride orbitalen zijn degenen die de gedeelde elektronen huisvesten. Deze orbitalen overlappen met de 2P orbitalen van het fluor-atoom wanneer zwavel-en fluor-atomen bindingen vormen. Deze zes orbitalen zijn in de zes richtingen van de octaëdervorm.
daarom heeft zwavelhexafluoride sp3d2 hybridisatie.
SF6 Bindingshoek
aangezien zwavel zijn valentie-elektronen deelt met 6 fluoratomen, kunnen we zien dat alle zes elektronen van het zwavelatoom worden gedeeld om bindingen te vormen. De bindingshoek van F-S-F is 90 graden.
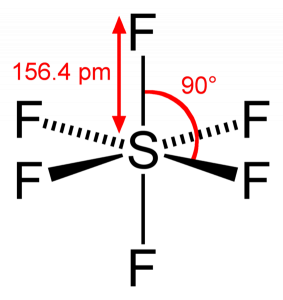
SF6 moleculaire geometrie
wanneer we kijken naar zwavelhexafluoridemolecuul, bevindt zwavel zich in de centrale positie met de fluoratomen symmetrisch eromheen. De atomen worden in het octaëdrale patroon geplaatst, waardoor de moleculaire geometrie van SF6 octaëdraal is.
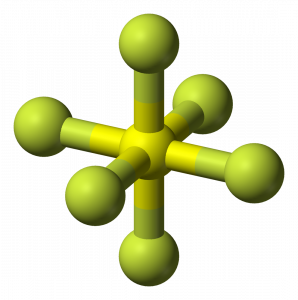
SF6-vorm
kijkend naar de moleculaire geometrie van het molecuul, kunnen we zeggen dat het SF6-molecuul een octahedrale vorm heeft omdat het acht zijden heeft. Het centrale atoom bindt echter met zes fluoratomen, de vorm van SF6 is octaëdrisch.
Is SF6 polair of niet-polair?
SF6 is een niet-polair molecuul. Dit komt omdat de VSEPR-theorie zegt dat wanneer zes fluor-atomen symmetrisch rond het zwavelatoom zijn gerangschikt, de bindingsdipolen worden geannuleerd. Hierdoor is het een niet-polaire molecule.

Het heeft ook dezelfde eigenschappen als apolaire moleculen, zoals niet-oplosbaar in water en oplosbaar in apolaire organische oplosmiddelen.
concluderende opmerkingen
om dit artikel samen te vatten kunnen we zeggen dat in de Lewis-dot-structuur van SF6 alle valentie-elektronen zijn opgebruikt, wat resulteert in het vormen van zes enkelvoudige bindingen tussen S-F zonder eenzame paren elektronen.
de hybridisatie van zwavel in dit molecuul is sp3d2 met een bindingshoek van 90 graden.
De moleculaire geometrie van SF6 is octahedraal en het is een niet-polair molecuul.