gränser i immunologi
- introduktion
- T-och B-Cellfack och två konventionella Stromalcellsundergrupper
- en nyligen identifierad Stromal delmängd, marginella retikulära celler
- MRCs och Antigeninmatningsvägen i SLOs
- MRCs och Organizer Stromalceller i SLO-utveckling
- förhållandet mellan MRCs och andra stromala delmängder
- ombyggnad av SLOs och tertiära lymfoida strukturer
- slutsats
- intressekonflikt uttalande
- erkännanden
introduktion
sekundära lymfoida organ/vävnader (SLOs) är väsentliga för effektiv induktion av adaptiva immunsvar. Flera typer av SLOs, inklusive lymfkörtlar (LNs), mjälte och slemhinneassocierade lymfoida vävnader (malt) såsom Peyers fläckar (PPs), är strategiskt placerade på olika ställen i kroppen. SLOs är ett utarbetat filter som prover antigener och är utrustad med mycket känsliga immunsensorer. För att samla och filtrera främmande antigener innehåller SLOs specialiserade vävnadsstrukturer som är associerade med endotelet eller epitelet. Immunceller såsom lymfocyter, dendritiska celler (DCs) och makrofager ackumuleras till höga densiteter och bildar fack. En anmärkningsvärd egenskap som är gemensam för alla SLOs är den segregerade lokaliseringen av B-celler och T-celler. Slos arkitektur stöds av flera typer av icke-hematopoietiska stromala celler av mesenkymalt ursprung, som konstruerar nätverk och definierar fack (Mueller och Germain, 2009; Roozendaal och Mebius, 2011). Stromala nätverk ger inte bara ett funktionellt fotfäste utan också ett utrymme för immuncellsaktiviteter, liksom en fysisk ram för vävnaden. Dessutom visar växande bevis att stromala celler också spelar kritiska roller i immuncellfunktion och homeostas (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). SLOs är programmerade att utvecklas från anlagen som förekommer på vissa platser och under begränsade perioder hos fostret och spädbarnet. Dessutom är stromalceller kända för att vara viktiga för SLO-utveckling och underhåll (Mebius, 2003). Här fokuserar jag på en nyligen identifierad stromal delmängd, marginella retikulära celler (MRCs) och sammanfattar deras egenskaper. Jag diskuterar också förhållandet mellan MRC och vävnadsstruktur, andra stromala delmängder och immunologiska funktioner.
T-och B-Cellfack och två konventionella Stromalcellsundergrupper
som beskrivits ovan lokaliseras B-celler och T-celler till distinkta regioner inom SLOs. B-celler ackumuleras för att bilda folliklar (B-zon) i den yttre cortexen under kapseln i LNs eller i den yttre periarteriolära lymfoidmanteln (PALS) i mjälten. Ett kluster av stora folliklar är kärnvävnaden hos PPs. Under immunsvar bildar aktiverade B-celler i folliklarna germinala centra, där de differentierar till antikroppsproducenter med hög affinitet (Cyster et al., 2000). Däremot lokaliserar T-celler till ett separat område (T-zon) intill folliklarna, dvs paracortexen i LNs, inre PALS i mjälten eller interfollikulär region (IFR) i PPs. DCs ackumuleras också i T-zonen för att presentera antigen och prime T-celler (Steinman et al., 1997).
det finns två olika typer av mesenkymala stromala delmängder i b-och t-zonerna (Figur 1a). Follikulära dendritiska celler (FDC) bildar ett tätt nätverk i mitten av folliklarna och har fått stor uppmärksamhet på grund av deras betydelse för antikroppsproduktion av B-celler (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs express CR1 / CD35, CD23 och ibland MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Däremot innefattar ett utarbetat nätverk av fibroblastiska retikulära celler (FRCs) ställningen i T-zonen, som producerar podoplanin/gp38 och olika extracellulära matriskomponenter (ECM) (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004A, b). I allmänhet regleras immuncellmigration och lokalisering av en mängd olika kemokiner (Mackay, 2001). Vilande lymfocyter och mogna DC: er är mycket mottagliga för ”homeostatiska kemokiner” (Cyster, 1999; m Obbller et al 2003). I överensstämmelse med detta finns det tydliga korrelationer mellan kemokiner producerade av stromalcellsundergrupper och lokalisering av immunceller som uttrycker motsvarande receptorer; CXCL13 producerad av FDCs är ett lockmedel av B-celler som uttrycker CXCR5, medan CCL19 och CCL21 från T-zon FRC lockar T-celler och mogna DCs genom den gemensamma receptorn CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Dessutom tros lymfocyter som migrerar robust i vävnadsparenkymen för att skanna antigener använda stromala nätverk som fotfäste (Baj Askornoff et al 2006). En mängd olika faktorer som produceras av stromala delmängder krävs också för aktivering och överlevnad av immunceller (Cyster et al., 2000; Huber et al., 2005; länk et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Därför är strukturen och funktionen hos stromalnätet i varje fack sannolikt optimerad för aktiviteten hos immuncellsundergrupper.
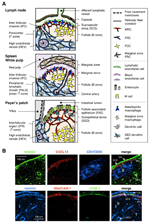
figur 1. Stromala cellundergrupper och vävnadsstrukturer av SLOs. (A) Schematisk representation av vävnadsstrukturer i mus SLOs, med betoning på stromala celler och antigentransportapparaten. Stromala element, inklusive mesenkymala, endotel-och epitelceller samt myeloida celler såsom makrofager och dendritiska celler (listade i den högra panelen), dras för betoning. (B) övre: vävnadsramen konstruerad av tre olika typer av stromala celler i den yttre kortikala regionen av LN. Fluorescerande immunfärgning av en mus ln sektion. I den övre mikrografen finns en liten vilande follikel (B) utan ett germinalt centrum, som stöds av FDCs som uttrycker CR1/CD35 men odetekterbara nivåer av CXCL13. Istället bildar MRCs ett laminin + CXCL13 + retikulärt nätverk i den yttre kanten av follikeln under kapseln (CA) och SCS. Nätverket konstruerat av FRCs i paracortex (T) är laminin+CXCL13-CR1/CD35-. Lägre: MAdCAM-1+ MRC-lager är nära associerat med LYVE-1 + lymfatiskt endotelskikt i SCS. Observera att MRC-skiktet utökas till IFC-området.
stromalnätet i T-zonen består av FRC och ett ECM-bunt som kallas en retikulär fiber, som bildar en ”ledning” som underlättar passagen av ämnen med låg molekylvikt (Gretz et al., 1997, 2000; Nolte et al., 2003). Denna ledning transporterar olika faktorer och lösliga antigener djupt inuti vävnaden, medan partiklar och stora molekyler huvudsakligen utesluts från lymfocytfacken. Faktum är att lymfburna kemokiner från perifera vävnader transporteras snabbt till den höga endotelvenulen genom ledningen för att kontrollera mobiliseringen av cirkulerande celler i LNs (Palframan et al., 2001). Dessutom kontaktar vissa bosatta DC direkt ledningen och fångar lymfburna antigener (Sixt et al., 2005).
en nyligen identifierad Stromal delmängd, marginella retikulära celler
den yttre marginalen av LN cortex, strax under kapseln, är omgiven av subkapsulär sinus (SCS; Figur 1a). Den luminala ytan på SCS är täckt med lymfatiska endotelceller och deras kortikala sida stöds av källarmembranet, kallat ”golvet” (Szakal et al., 1983). Särskilt inom IFRs sprids retikulära fibrer från golvet in i paracortexen (Gretz et al., 1997). Det är viktigt att ett tunt lager av retikulär struktur också observeras i folliklarnas yttersta område. FRC-liknande stromala celler i follikulärt retikulum uttrycker CXCL13 och MAdCAM-1 men inte CCL21, vilket indikerar att dessa celler skiljer sig från T-zon FRC, medan FDC-markören CR1/CD35 var oupptäckt eller endast svagt uttryckt i dessa celler (Katakai et al., 2008; figurerna 1b och 2A). FDCs genererar inte retikulära fibrer, och följaktligen är retikulärmarkören ER-TR7 praktiskt taget frånvarande i mitten av folliklarna (Katakai et al., 2004A, b). Dessutom uttrycker retikulära celler i den subkapsulära regionen specifikt RANKL / TRANCE, vilket är en TNF-familj cytokin som är väsentlig för LN-utveckling (Dougall et al., 1999; Kong et al., 1999). Därför ansågs dessa stromala celler vara en ny stromal delmängd och betecknades marginella retikulära celler (MRCs; Katakai et al., 2008). Observera att en betydande mängd CXCL13 uttrycks konstitutivt i MRC i vilande små folliklar även om FDC uttrycker odetekterbara nivåer av CXCL13 (Figur 1b). Det är väl etablerat att den yttre kanten av PALS i mjälten, särskilt den som ligger över folliklarna, gränsar till ett MAdCAM-1+ stromalskikt. Cellerna som utgör slemhinnan i källarmembranet under marginal sinus (MS) uttrycker också CXCL13 och RANKL, vilket indikerar att dessa celler är en typ av MRC (Katakai et al., 2008). I Malt bildar retikulära celler som liknar MRCs ett nätverk i subepithelial dome (SED)-regionen strax under källarmembranet i det follikelassocierade epitelet (FAE; Katakai et al., 2008; Knoop et al., 2009). Sammantaget anses MRC vara en stromal delmängd som är gemensam för SLOs men skiljer sig från FDC och FRC.
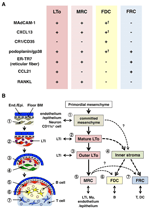
figur 2. Förhållandet mellan MRCs och andra stromala cellundergrupper i SLOs. (A) mönster av marköruttryck i stromala cellundergrupper. Expressionsnivåer av MAdCAM-1, CXCL13 och podoplanin/gp38 i FDC är ofta svaga eller odetekterbara genom immunhistokemi (GHz). (B) schematisk av en generaliserad modell för SLO-utveckling med platserna för stromalcellsundergrupper (vänster) och en förmodad släktforskning av stromalcellsundergrupper (höger). Siffror som anger cellelement i den vänstra ritningen representerar stromala cellundergrupper som visas i det högra schemat. BM, källarmembran; slutet./ Epi., endotel-eller epitelskikt.
MRCs och Antigeninmatningsvägen i SLOs
sekundära lymfoida organ kännetecknas av speciella strukturer som filtrat och transporterar antigener i lymfocytfacken (Figur 1a). LNs är kopplade till lymfkärl för att undersöka lymfburna antigener. Eftersom de afferenta lymfatikerna är öppna för SCS, är sinus lymfatiska endotel och golvkällarmembran som den främre ytan av LN-filtret. Mjälten filtrerar blod, i vilka grenar av den centrala artären är öppna för MS och marginalzonen (MZ), där immunceller undersöker blodinnehållet. I dessa specialiserade sinusstrukturer är gränsbarriärerna det lymfatiska endotelet i SCS i LN och blodendotelet i mjälten MS, som båda stöds av MRC-retikulum. Intressant nog distribueras CD169 + metallofila makrofager selektivt nära sinusfodret över folliklarna, av vilka några sätter sig över endotelbarriären och förmedlar partikelformiga antigener från sinuslumen i lymfocytfacket (Szakal et al., 1983; Taylor et al., 2005; Carrasco och Batista, 2007; Phan et al., 2009). DCs som bär antigener från vävnaderna via lymfkärlen anländer till SCS och flyttar därefter in i paracortex över golvet i den interfollikulära kanalen (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). I Malt fungerar FAE som barriären där en specialiserad epitelcell som kallas M-celler överför bakterier eller partiklar från tarmlumen till underliggande DC eller makrofager (Kraehenbuhl och Neutra, 2000). Därför stöder MRC den främre antigentransportapparaten i varje SLO. Den grundläggande utformningen av SLOs är att folliklarna huvudsakligen är anordnade mot platsen för antigeninträde och åtföljs av T-zoner. Således, från en stromal synvinkel, verkar hela vävnadsarkitekturen vara organiserad mot MRC-skiktet.
Även om MRC: s immunologiska funktioner förblir svårfångade, visades det tidigare att ledningsnätet konstruerat av MRC i den yttre follikeln transporterar små lösliga antigener till follikulära B-celler och FDC: er (Baj Kambodnoff och Germain, 2009; Roozendaal et al., 2009). De flesta CD169 + – makrofager är placerade vid den kortikala sidan av SCS-golvet och sticker ut en förlängning i sinuslumen för att fånga partiklar (Phan et al., 2009). Således kan MRCs vara involverade i lokaliseringen, morfologin och funktionen hos dessa makrofager. M-cellutveckling i PPs kräver RANKL-RANK-signalering, som sannolikt styrs av ett RANKL-Uttryckande MRC-nätverk strax under FAE (Knoop et al., 2009). Inhiberar LT-vägen, som avskaffar MRC-signaturer i mjältvit massa, stör MS-strukturen (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Dessutom innebär förhöjt ICAM-1, VCAM-1 och CXCL13-uttryck att MRC är involverade i den dynamiska interstitiella migrationen av follikulära B-celler som en funktionell ställning. CD169 + makrofager har visat sig direkt leverera partikelformiga antigener till antigenspecifika B-celler i detta område (Carrasco och Batista, 2007; Phan et al., 2009), vilket tyder på att MRC-nätverksmedierad kontroll av B-cellmigrering kan påverka denna process. Eftersom MRC också finns i IFC-regionen reglerar de eventuellt transmigrationen av DCs från SCS mot T-zonen.
MRCs och Organizer Stromalceller i SLO-utveckling
sekundära lymfoida organ utvecklas från anlagen, som är aggregat av mesenkymala och hematopoietiska celler associerade med kärl eller epitel, vid en definierad plats och period i fostret eller spädbarnet (Mebius, 2003). En kritisk händelse i utvecklingen av SLO anlagen är ackumuleringen av CD45 + CD4 + CD3-hematopoietiska celler, som också är kända som lymfoid vävnadsinducerare (LTi) celler som interagerar med mesenkymala stromala celler som kallas lymfoid vävnadsorganisatör (LTo) celler (Mebius et al., 1997). En TNF-familj cytokin, lymphotoxin (LT)-2CG, som uttrycks av LTI-celler, sänder signaler till LTO-celler via LT-2CG-receptorn. LTo-celler inducerar därefter uttrycket av vidhäftningsmolekyler, inklusive ICAM-1, VCAM-1 och MAdCAM-1 och kemokiner CXCL13, CCL19 och Ccl21 (Honda et al., 2001; Cupedo et al., 2004A, B. I synnerhet är CXCL13 särskilt viktigt för att locka LTi-celler till anlagen via dess receptor CXCR5 (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Det antas att en positiv återkopplingsslinga, dvs. nyinvandrande LTi-celler som producerar LT aktiverar ytterligare LTo-stromala celler, vilket främjar organisationen av anlagen. När lymfocyter började ackumuleras efter födseln expanderar vävnaden och facken som stöds av olika stromalcellsundergrupper induceras (Cupedo et al., 2004b, Baj och Germain 2009).
marginella retikulära celler och LTo-celler uttrycker ett mycket liknande mönster av olika markörer (figur 2a), vilket tyder på att det finns något samband mellan dessa två stromala celler. LTo-celler verkar vara mer koncentrerade i den marginella regionen av LN anlagen intill lymfatisk sinus hos den presumtiva SCS (Finke et al., 2002; Cupedo et al., 2004A; Eberl et al., 2004; Katakai et al., 2008). Detta LTo-cellskikt verkar expandera utåt med tillväxten av anlagen, som i slutändan verkar bli MRC-skiktet (Katakai et al., 2008). På samma sätt, när lymfocyter ackumuleras runt den centrala artären i den postnatala mjälten, expanderar LTo-celler som uttrycker MAdCAM-1 och RANKL med skiktet och blir MRC i den vita massan. Dessa fynd tyder starkt på att MRC är en direkt ättling till LTo stroma, som bevarar egenskaperna hos LTo-celler på specialiserade platser inom SLOs. Även RAG-bristfälliga möss uppvisar ett subkapsulärt MRC-skikt i atrofiska LNs och krympta periarteriella MRC-mantlar i mjälten, vilket indikerar att MRC-utveckling sker oberoende av B-och T-celler och programmeras före deras kolonisering (Katakai et al., 2008). Eftersom SLOs effektivt tar prov antigener för att utlösa immunsvar, måste de antigenuppsamlingsstrukturer som konstrueras under utveckling bibehållas därefter. Följaktligen är det rimligt att dessa vävnadsstrukturer upprätthålls av arrangörsliknande stromala celler under vuxen ålder.
förhållandet mellan MRCs och andra stromala delmängder
Figur 2B visar den möjliga släktforskningen för stromala delmängder i SLOs. I embryot är det primordiala mesenkymet som ligger i närheten av vaskulaturen eller epitelet åtagit sig att bilda anlagekärnan och lockar LTi-celler. Nervceller eller andra mindre karakteriserade celler är också involverade i den initiala processen (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). Ackumuleringen av LTi-celler underlättar mognad av mesenkymala celler i LTo-celler, vilket i slutändan underlättar konstruktionen av den grundläggande arkitekturen. Typiskt tenderar LTo-celler att koncentrera sig vid anlages periferi och expandera utåt med vävnadstillväxt, medan stromala celler som uppvisar svaga eller inga LTo-signaturer ökar omvänt i den inre delen av anlaget. Postnatal kolonisering av B-och T-celler leder till fack med induktion av konventionella stromala delmängder.
om detta schema är korrekt följer det att alla stromala delmängder i vuxna SLOs ursprungligen härrör från LTo-celler. Således har MRC som bevarar egenskaperna hos LTo-celler förmågan att differentiera till FDC eller FRC? MRC: er delar många signaturer med andra delmängder (figur 2A), vilket tyder på att detta är möjligt. En spekulation är att MRCs fungerar som stromala stamceller som kontinuerligt levererar alla stromala delmängder under vuxen ålder. Även om den här tanken är spännande, kommer den att kräva försiktig övervägande och ytterligare validering i framtiden. Mesenkymala celler är i allmänhet mycket flexibla i naturen beroende på omgivningen, och därmed kan specifika egenskaper lätt ändras. Utökad odling av stromala celler isolerade från LNs resulterar i förlorat uttryck för många gener, särskilt homeostatiska kemokiner (Katakai et al., 2004A; Tomei et al., 2009). Detta tyder på att in vivo fenotyper av stromala cellundergrupper upprätthålls optimalt av vävnadsförhållandena, vilka är reversibla och inte på grund av terminal differentiering. Dessutom inducerar inflammatoriska stimuli den robusta proliferationen av stromala celler och den dramatiska ombyggnaden av SLOs (Katakai et al., 2004A; Chyou et al., 2011). Därför, även om MRC kan omvandlas till andra delmängder, konventionella stromala delmängder kan också självförnyas och vara utbytbara i vuxna SLOs.
ombyggnad av SLOs och tertiära lymfoida strukturer
under immunsvar ombyggs stromala strukturer inom SLOs dramatiskt (Gretz et al., 1997; Katakai et al., 2004a). Vissa infektioner orsakar en allvarlig störning av vävnadsstrukturer inom LNs och mjältvit massa inom några dagar, vilket återställs när patogenerna utrotas (Mueller et al., 2007a, b; Scandella et al., 2008; St John och Abraham, 2009). Denna restaureringsprocess rekapitulerar sannolikt en självorganiserande process via en återkopplingsreaktion som liknar SLO-utveckling. Viktigt är att LTi-liknande celler också finns i vuxna vävnader och reglerar infektionsassocierad ombyggnad av SLOs (Kim et al., 2003; Scandella et al., 2008). Även om MRCs roll i sådana processer är okänd, har de möjligen en organisationsroll i samarbete med LTi-liknande celler och bestämmer den yttre ramen för SLOs under rekonstruktion.
vid kronisk inflammation associerad med olika organpatologier leder ett stort antal infiltrerande lymfocyter ofta till organisationer som liknar SLOs, kända som tertiära lymfoida vävnader (Tlts; Drayton et al., 2006). B-och T-celler är segregerade och motsvarande nätverk av stromala cellundergrupper induceras. Det skulle vara intressant att avgöra om MRC är närvarande i dessa ektopiska lymfoida strukturer; emellertid observeras MRC-liknande celler och relaterade vävnadsstrukturer inte i TLT som utvecklades under autoimmun gastrit hos mus (Katakai et al., 2006, 2008). Det bör betonas att TLT i grunden inte är programmerade lymfoida organisationer och naturligtvis inte associerar med de antigentransporterande strukturerna. Därför är MRC sannolikt frånvarande i TLT. Även om stromala celler som fenotypiskt liknar MRC kan induceras i vissa lesioner, skulle de inte identifieras som MRC om de inte är nära associerade med den specifika endotel-eller epitelstrukturen och bildar en skiktad retikulum vid de yttre folliklarna.
slutsats
marginella retikulära celler är en unik stromalcellsdelmängd som är gemensam för SLOs. MRC skiljer sig tydligt från konventionella delmängder som induceras eller mognar genom interaktioner med lymfocyter efter födseln och härrör direkt från LTo-stromala celler i anlagen och oberoende av lymfocyter. Nätverket av MRCs är nära associerat med den antigentransporterande apparaten i SLOs och tros direkt eller indirekt kontrollera antigenleverans till lymfocytfack samt lokalisering och migration av immunceller. MRC spelar sannolikt viktiga roller för att upprätthålla SLO-strukturer som det yttre ramverket och kan omvandlas till andra stromala delmängder vid steady state eller under vävnadsremodellering. Det kommer att vara viktigt att kollektivt överväga alla stromala delmängder, vävnadsstrukturer och immunologiska mikromiljöer för att fullständigt förstå SLO-systemet.
intressekonflikt uttalande
författaren förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
erkännanden
detta arbete stöddes delvis av bidrag till ung forskare och för vetenskaplig forskning om innovativa områden från Japans ministerium för utbildning, kultur, sport, vetenskap och teknik.
Baj Kubinoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. och Germain, rn (2006). Stromala cellnätverk reglerar lymfocytinträde, migration och territorialitet i lymfkörtlar. Immunitet 25, 989-1001.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Baj Portugaloff, M., och Germain, R. N. (2009). B-cell follikelutveckling ombygger ledningssystemet och möjliggör löslig antigenavgivning till follikulära dendritiska celler. Blod 114, 4989-4997.
Pubmed Abstract | Pubmed fulltext/CrossRef fulltext
Balogh, P., Baltubbizs, M., Cztubbimbmp T., Weih, D. S., Arnold, HH och Weih, F. (2007). Distinkta roller för lymfotoxin-beta-signalering och homeodomain-transkriptionsfaktorn Nkx2.3 i ontogeni av endotelfack i mjälte. Cellvävnad Res. 328, 473-486.
Pubmed Abstract | Pubmed fulltext/CrossRef fulltext
b Actubniczech, C., Vit, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., och Caama Actubo, JH (2010). Ontogeni av stromala organisatorceller under lymfkörtelutveckling. J. Immunol. 184, 4521–4530.
Pubmed Abstract / Pubmed fulltext
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., B Oguilter, J., M Oguink, A. och f Oguirster, R. (2011). Afferenta lymfderiverade T-celler och DC använder olika kemokinreceptor CCR7-beroende vägar för inträde i lymfkörteln och intranodal migration. Nat. Immunol. 12, 879–887.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Carrasco, yr och Batista, fd (2007). B-celler förvärvar partikelformigt antigen i ett makrofagrikt område vid gränsen mellan follikeln och lymfkörtelns subkapsulära sinus. Immunitet 27, 160-171.
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. och Lu, T. T. (2011). Koordinerad reglering av lymfkörtel vaskulär-stromal tillväxt först av CD11c + – celler och sedan av T-och B-celler. J. Immunol. 187, 5558–5567.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Cupedo, T., Vondenhoff, MF, Heeregrave, Ej, de Weerd, ae, Jansen, W., Jackson, dg, Kraal, G. och Mebius, Re (2004A). Presumptiva lymfkörtelorganisatörer representeras differentiellt vid utveckling av mesenteriska och perifera noder. J. Immunol. 173, 2968–2975.
Pubmed Abstract / Pubmed fulltext
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., De Waal-Malefyt, R., Kraal, G., Cyster, J. G. och Mebius, R. E. (2004b). Initiering av cellulär organisation i lymfkörtlar regleras av icke-B-cell-härledda signaler och är inte beroende av CXC-kemokinligand 13. J. Immunol. 173, 4889–4896.
Pubmed Abstrakt / Pubmed fulltext
Cyster, J. G. (1999). Kemokiner och cellmigration i sekundära lymfoida organ. Vetenskap 286, 2098-2102.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Cyster, jg, Ansel, km, Reif, K., Ekland, Eh, Hyman, PL, Tang, HL, Luther, sa och Ngo, VN (2000). Follikulära stromala celler och lymfocyt homing till folliklar. Immunol. Upp. 176: 181-193.
Pubmed Abstract | Pubmed fulltext | CrossRef fulltext
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, JJ och Schuh, J. (1999). Rang är viktigt för utveckling av osteoklaster och lymfkörtlar. Gener Dev. 13, 2412–2424.
Pubmed Abstrakt / Pubmed fulltext | CrossRef fulltext
Drayton, dl, Liao, S., Mounzer, Rh och Ruddle, Nh (2006). Lymfoidorganutveckling: från ontogeni till neogenes. Nat. Immunol. 7, 344–353.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Eberl, G., Marmon, S., Sunshine, MJ, Rennert, Pd, Choi, Y. och Littman, Dr (2004). En viktig funktion för kärnreceptorn RORy(t) vid generering av fosterlymfoidvävnadsinducerande celler. Nat. Immunol. 5, 64–73.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M. och Kraehenbuhl, J. (2002). CD4 + CD3-celler inducerar Peyers patchutveckling: roll av 2xcr1 aktivering av cxcr5. Immunitet 17, 363-373.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, ms, Collier, ar, Boyd, rl och Turley, sj (2010). Lymfkörtelfibroblastiska retikulära celler presenterar direkt perifer vävnadsantigen under steady-state och inflammatoriska tillstånd. J. Exp. Med. 207, 689–697.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Gretz, je, Anderson, Ao och Shaw, S. (1997). Sladdar, kanaler, korridorer och ledningar: kritiska arkitektoniska element som underlättar cellinteraktioner i lymfkörtelbarken. Immunol. Rev. 156, 11-24.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Gretz, je, Norbury, CC, Anderson, Ao, Proudfoot, AE och Shaw, S. (2000). Lymfburna kemokiner och andra molekyler med låg molekylvikt når höga endotelvenuler via specialiserade ledningar medan en funktionell barriär begränsar tillgången till lymfocytmiljöerna i lymfkörtelcortex. J. Exp. Med. 192, 1425–1440.
PubMed Abstrakt | Pubmed fulltext/CrossRef fulltext
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T. och Nishikawa, S.-I. (2001). Molekylär grund för hematopoietisk/mesenkymal interaktion under initiering av Peyers patchorganogenes. J. Exp. Med. 193, 621–630.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, Mr, Heinen, E., Fu, Yx, Miele, G. och Aguzzi, A. (2005). Lymfotoxin-receptorberoende gener i lymfkörtel och follikulära dendritiska celltranskriptomer. J. Immunol. 174, 5526–5536.
Pubmed Abstrakt / Pubmed fulltext
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., och Shaw, S. (2001). Spatial och molekylär organisation av lymfkörtel T-cell cortex: en labyrintisk hålighet avgränsad av ett epitelliknande monolager av fibroblastiska retikulära celler förankrade i källarmembranliknande extracellulär matris. Int. Immunol. 13, 1243–1253.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Katakai, T., Hara, T., Sugai, M., Gonda, H. och Shimizu, A. (2004A). Lymfkörtelfibroblastiska retikulära celler konstruerar stromal retikulum via kontakt med lymfocyter. J. Exp. Med. 200, 783–795.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Katakai, T., Hara, T., Lee, JH, Gonda, H., Sugai, M. och Shimizu, A. (2004b). En ny retikulär stromstruktur i lymfkörtelcortex: en immunplattform för interaktioner mellan dendritiska celler, T-celler och B-celler. Int. Immunol. 16, 1133–1142.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S. och Shimizu, A. (2006). Spontan storskalig lymfoid neogenes och balanserad autoimmunitet kontra tolerans i magen hos H+/K+-ATPas-reaktiv TCR transgen mus. J. Immunol. 177, 7858–7867.
Pubmed Abstract / Pubmed fulltext
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T. och Shimizu, A. (2008). Arrangörsliknande retikulärt stromalcellskikt som är vanligt för vuxna sekundära lymfoida organ. J. Immunol. 181, 6189–6200.
Pubmed Abstract/Pubmed fulltext
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-domare, A., Raykundalia, C., Walker, L. S., Goodall, MD och Lane, PJ (2003). CD4 + CD3-tillbehörsceller costimulerar primerade CD4 T-celler genom OX40 och CD30 på platser där T-celler samarbetar med B-celler. Immunitet 18, 643-654.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., och Williams, I. R. (2009). RANKL är nödvändigt och tillräckligt för att initiera utveckling av antigenprovtagning M-celler i tarmepitelet. J. Immunol. 183, 5738–5747.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. och Miyasaka, M. (1996). Mjältmarginalzonen är frånvarande i alymphoplastiska Aly-mutanta möss. EUR. J. Immunol. 26, 669–675.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, aj, Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, Cr, Lacey, dl, Mak, TW, Boyle, WJ och Penninger, JM (1999). OPGL är en nyckelregulator för osteoklastogenes, lymfocytutveckling och lymfkörtelorganogenes. Natur 397, 315-323.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Kraehenbuhl, jp och Neutra, Mr (2000). Epithelial M-celler: differentiering och funktion. Annu. Cell Dev. Biol. 16, 301–332.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Link, A., Vogt, TK, Favre, S., Britschgi, Mr, Acha-Orbea, H., Hinz, B., Cyster, jg och Luther, S. A. (2007). Fibroblastiska retikulära celler i lymfkörtlar reglerar homeostasen hos naiva T-celler. Nat. Immunol. 8, 1255–1265.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, se, Elpek, kg, Tayalia, P., Collier, A. R. och Turley, S. J. (2011). Reglerad frisättning av kväveoxid genom icke-hematopoietisk stroma styr expansionen av den aktiverade T-cellpoolen i lymfkörtlar. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Luther, sa, Tang, HL, Hyman, PL, Farr, AG och Cyster, jg (2000). Coexpression av kemokinerna ELC och SLC av T-zon stromalceller och deletion av ELC-genen i PLT/plt-musen. Proc. Natl. Acad. Sci. USA 97, 12694-12699.
PubMed Abstrakt | Pubmed fulltext | CrossRef fulltext
Luther, S. A., Ansel, K. M., och Cyster, J. G. (2003). Överlappande Roller av CXCL13, interleukin 7 receptor securitoch CCR7 ligander i lymfkörtelutveckling. J. Exp. Med. 197, 1191–1198.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Mackay, C. R. (2001). Kemokiner: immunologins höga påverkansfaktorer. Nat. Immunol. 2, 95–101.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B. Det finns många olika typer av sjukdomar som kan uppstå. (2012). Transkriptionsprofilering av stroma från inflammerade och vilande lymfkörtlar definierar immunologiska kännetecken. Nat. Immunol. 13, 499–510.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Mebius, R. E., Rennert, P. och Weissman, Il (1997). Att utveckla lymfkörtlar samlar CD4 + CD3-lt 2+ celler som kan skilja sig från APC, NK-celler och follikulära celler men inte T-eller B-celler. Immunitet 7, 493-504.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Mebius, R. E. (2003). Organogenes av lymfoida vävnader. Nat. Immunol. 3, 292–303.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Mueller, sn, Hosiawa-Meagher, ka, Konieczny, BT, Sullivan, BM, Bachmann, MF, Locksley, RM, Ahmed, R. och Matloubian, M. (2007a). Reglering av homeostatisk kemokinuttryck och cellhandel under immunsvar. Vetenskap 317, 670-674.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Mueller, sn, Matloubian, M., Clemens, DM, Sharpe, Ah, Freeman, gj, Gangappa, S., Larsen, CP och Ahmed, R. (2007b). Viral inriktning av fibroblastiska retikulära celler bidrar till immunsuppression och uthållighet under kronisk infektion. Proc. Natl. Acad. Sci. USA 104, 15430-15435.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Mueller, sn och Germain, rn (2009). Stromalcell bidrar till immunsystemets homeostas och funktionalitet. Nat. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
m Obbller, G., H U. U., och Lipp, M. (2003). Effekten av CCR7 och CXCR5 på lymfoidorganutveckling och systemisk immunitet. Immunol. Rev. 195, 117-135.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Nolte, M. A., Beli Tubbin, J. A., Schadee-Eestermans, I., Jansen, W., Unger, WW, van Rooijen, N., Kraal, G. och Mebius, R. E. (2003). Ett ledningssystem distribuerar kemokiner och små blodburna molekyler genom den miltvita massan. J. Exp. Med. 198, 505–512.
Pubmed Abstract | Pubmed fulltext/CrossRef fulltext
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., och f Jacobrster, R. (2003). Samarbetsmekanismer för CXCR5 och CCR7 vid utveckling och organisation av sekundära lymfoida organ. J. Exp. Med. 197, 1199–1204.
Pubmed Abstract / Pubmed fulltext | CrossRef fulltext
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, Bj, Zweerink, H., Rot, A. och von Andrian, Uh (2001). Inflammatorisk kemokintransport och presentation i HEV: en fjärrkontrollmekanism för monocytrekrytering till lymfkörtlar i inflammerade vävnader. J. Exp. Med. 194, 1361–1373.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Phan, TG, grön, Ja, grå, ee, Xu, Y. och Cyster, jg (2009). Immunkomplexrelä av subkapsulära sinusmakrofager och icke-kognata B-celler Driver antikroppsaffinitetsmognad. Nat. Immunol. 10, 786–793.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Roozendaal, R., Mempel, T. R., Kanna, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H. och Carroll, M. C. (2009). Ledningar förmedlar transport av antigen med låg molekylvikt till lymfkörtelfolliklar. Immunitet 30, 264-276.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Roozendaal, R. och Mebius, R. E. (2011). Stromal cell-immuncell interaktioner. Annu. Immunol. 29, 23–43.
Pubmed Abstrakt | Pubmed fulltext/CrossRef fulltext
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T. och Ludewig, B. (2008). Återställande av lymfoidorganintegritet genom interaktion mellan lymfoida vävnadsinducerande celler med stroma i t-cellzonen. Nat. Immunol. 9, 667–675.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, MB och Sorokin, L. (2005). Ledningssystemet transporterar lösliga antigener från den afferenta lymfen till bosatta dendritiska celler i t-cellområdet i lymfkörteln. Immunitet 22, 19-29.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Steinman, RM, Pack, M. och Inaba, K. (1997). Dendritiska celler i t-cellområdena i lymfoida organ. Immunol. Rev. 156, 25-37.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
St John, A. L. Och Abraham, S. N. (2009). Salmonella stör lymfkörtelarkitekturen genom TLR4-medierad undertryckning av homeostatiska kemokiner. Nat. Med. 15, 1259–1265.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, WW och Fagarasan, S. (2010). Avkänningen av miljöstimuli av follikulära dendritiska celler främjar immunoglobulin en generation i tarmen. Immunitet 33, 71-83.
Pubmed Abstrakt / Pubmed fulltext / CrossRef fulltext
Szabo, Mc, Butcher, EC och McEvoy, lm (1997). Specialisering av mukosala follikulära dendritiska celler avslöjade av mukosal adressincelladhesionsmolekyl – 1 display. J. Immunol. 158, 5584–5588.
Pubmed Abstract / Pubmed fulltext
Szakal, A. K., Holmes, K. L. och Tew, J. G. (1983). Transport av immunkomplex från subkapsulär sinus till lymfkörtelfolliklar på ytan av nonfagocytiska celler, inklusive celler med dendritisk morfologi. J. Immunol. 131, 1714–1727.
Pubmed Abstrakt/Pubmed fulltext
Taylor, pr, Martinez-Pomares, L., Stacey, M., Lin, HH, Brown, GD och Gordon, S. (2005). Makrofagreceptorer och immunigenkänning. Annu. Immunol. 23, 901–944.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, GF och Szakal, A. K. (1997). Follikulära dendritiska celler och presentation av antigen-och costimulatoriska signaler till B-celler. Immunol. Rev. 156, 39-52.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Tomei, AA, Siegert, S., Britschgi, Mr, Luther, S. A. och Swartz, ma (2009). Vätskeflöde reglerar stromalcellsorganisation och CCL21-uttryck i en vävnadsteknisk lymfkörtelmikromiljö. J. Immunol. 183, 4273–4283.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., H Aubbilpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, WW, Randall, T. D., De Jonge, WJ och Mebius, R. E. (2009). Chemokine CXCL13 är viktigt för lymfkörtelinitiering och induceras av retinsyra och neuronal stimulering. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Veiga-Fernandes, H., Coles, Mc, Foster, ke, Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V. och Kioussis, D. (2007). Tyrosinkinasreceptor RET är en nyckelregulator för Peyers patchorganogenes. Natur 446, 547-551.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M. och Kollias, G. (2006). FDC-specifika funktioner för p55TNFR och IKK2 vid utveckling av FDC-nätverk och antikroppssvar. Immunitet 24, 65-77.
Pubmed Abstract / Pubmed fulltext / CrossRef fulltext
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, rd och Chaplin, dd (2009). Lymphotoxin Lta1 Maca2 kontrollerar postnatal och vuxen mjälte marginal sinus vaskulär struktur och funktion. Immunitet 30, 408-420.
PubMed Abstrakt / Pubmed fulltext / CrossRef fulltext