Hranic, v Imunologii
- Úvod
- T a B Buněčné Prostory a Dva Konvenční Stromální Buňky Podskupin
- Nově Zjištěná Stromální Podmnožina, Mezní retikulocyty
- MRCs a Antigen Záznam Trasy ve SLOs
- MRCs a Organizátor Stromální Buňky v SLO Rozvoj
- vztah mezi MRC a jinými stromálními Podmnožinami
- remodelace SLOs a terciárních lymfoidních struktur
- závěr
- Prohlášení o střetu zájmů
- Poděkování
Úvod
Sekundární lymfatické orgány/tkáně (SLOs) jsou nezbytné pro efektivní indukci adaptivní imunitní odpovědi. Několik typů SLOs, včetně lymfatických uzlin (LNs), slezina a sliznice spojené lymfatické tkáně (Malt) jako peyerových plátů (PPs), jsou strategicky umístěny v různých místech v těle. SLOs jsou propracovaný filtr, který vzorkuje antigeny a je vybaven vysoce citlivými imunitními senzory. Za účelem sběru a filtrace cizích antigenů obsahují SLOs specializované tkáňové struktury, které jsou spojeny s endotelem nebo epitelem. Imunitní buňky, jako jsou lymfocyty, dendritické buňky (DCs) a makrofágy, se hromadí na vysokou hustotu a tvoří kompartmenty. Pozoruhodným rysem společným pro všechny SLOs je segregovaná lokalizace B buněk a T buněk. Architektura SLOs je podporováno několik typů non-hematopoetických stromální buňky mesenchymálního původu, které budují sítě a definovat prostředí (Mueller a Germain, 2009; Roozendaal a Mebius, 2011). Stromální sítě poskytují nejen funkční oporu, ale také prostor pro aktivity imunitních buněk, stejně jako fyzický rámec pro tkáň. Rostoucí důkazy navíc naznačují, že stromální buňky také hrají rozhodující roli ve funkci imunitních buněk a homeostáze (Link et al ., 2007; Fletcher a kol., 2010; Suzuki a kol., 2010; Lukacs-Kornek et al., 2011). SLOs jsou naprogramovány tak, aby rozvíjet od anlagen, které se vyskytují na určitých místech a během omezeného období v plodu a kojence. Kromě toho je známo, že stromální buňky jsou důležité pro vývoj a údržbu SLO (Mebius, 2003). Zde se zaměřuji na nedávno identifikovanou stromální podmnožinu, marginální retikulární buňky (MRC) a shrnuji jejich charakteristiky. Diskutuji také o vztahu mezi MRC a tkáňovou strukturou, dalšími stromálními podmnožinami a imunologickými funkcemi.
T a B Buněčné Prostory a Dva Konvenční Stromální Buňky Podskupin
, Jak je popsáno výše, B buňky a T buňky lokalizovat do různých regionů v rámci SLOs. B buňky se hromadí tvoří folikuly (B zóna) ve vnější kůře pod kapsle v LNs nebo ve vnějším periarteriolar lymfatické pochvy (KAMARÁDI) ve slezině. Shluk velkých folikulů je jádro tkáně PPs. Během imunitní odpovědi aktivované B buňky ve folikulech tvoří zárodečná centra, kde se diferencují na producenty protilátek s vysokou afinitou (Cyster et al ., 2000). Naproti tomu T buňky se lokalizují do samostatné oblasti (T zóna) sousedící s folikuly, tj. DCs se také hromadí v zóně T, aby představovaly antigen a primární T buňky (Steinman et al ., 1997).
existují dva různé typy mezenchymálních stromálních podmnožin v zónách B A T (obrázek 1A). Folikulární dendritické buňky (Fdc) tvoří hustou síť v centru folikulů a získaly značnou pozornost, protože jejich význam v produkci protilátek B buňkami (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki a kol., 2010). FDCs express CR1 / CD35, CD23 a občas MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Naopak, propracovanou síť fibroblastický retikulární buňky (FRCs) se skládá z lešení na T-zónu, která vyrábí podoplanin/gp38 a různé extracelulární matrix (ECM) komponenty (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai a kol., 2004a, b). Migrace a lokalizace imunitních buněk jsou obecně regulovány řadou chemokinů(Mackay, 2001). Klidové lymfocyty a zralé DC jsou vysoce citlivé na „homeostatické chemokiny“ (Cyster, 1999; Müller et al 2003). V souladu s tím, existuje jasné korelace mezi chemokines produkován stromální buňky, podskupiny a lokalizace imunitních buněk exprimujících příslušné receptory; CXCL13 produkován Fdc je návnada z B buněk exprimujících CXCR5, zatímco CCL19 a CCL21 z T-zóny FRCs přilákat T buňky a zralé DCs prostřednictvím společné receptoru CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Kromě toho se předpokládá, že lymfocyty, které robustně migrují v tkáňovém parenchymu ke skenování antigenů, používají jako oporu stromální sítě (Bajénoff et al 2006). Pro aktivaci a přežití imunitních buněk je také zapotřebí řada faktorů produkovaných stromálními podmnožinami (Cyster et al ., 2000; Huber a kol., 2005; Link et al., 2007; Suzuki a kol., 2010; Lukacs-Kornek et al., 2011; Malhotra a kol., 2012). Proto je struktura a funkce stromální sítě v každém kompartmentu pravděpodobně optimalizována pro aktivitu podmnožin imunitních buněk.
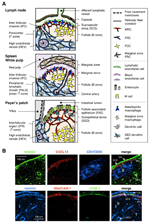
obrázek 1. Podskupiny stromálních buněk a tkáňové struktury SLOs. (A) schematické znázornění tkáňových struktur v myších SLOs, s důrazem na stromální buňky a zařízení pro transport antigenu. Stromální prvky, včetně mezenchymální, endoteliální a epiteliální buňky, stejně jako myeloidní buňky, jako jsou makrofágy a dendritické buňky (uvedené v pravém panelu), jsou vypracovány pro důraz. (B) horní: tkáňový rámec konstruovaný třemi různými typy stromálních buněk ve vnější kortikální oblasti LN. Fluorescenční imunostaining myší sekce LN. V horní mikrofotografie, tam je malé klidové folikuly (B) bez zárodečných center, který je podporován Pokládána vyjádření CR1/CD35 ale nedetekovatelné hladiny CXCL13. Místo toho tvoří MRC síť laminin+CXCL13+ retikulární síť na vnějším okraji folikulu pod kapslí (CA) a SCS. Sítě postavené FRCs paracortex (T) je lamininu+CXCL13-CR1/CD35-. Dolní: vrstva MAdCAM-1+ MRC je úzce spojena s lymfatickou endoteliální vrstvou LYVE-1+ v SCS. Všimněte si, že vrstva MRC je rozšířena na oblast IFC.
stromální síť v zóně T Je složena z FRC a svazku ECM známého jako retikulární vlákno, které tvoří „potrubí“, které usnadňuje průchod nízkomolekulárních látek (Gretz et al ., 1997, 2000; Nolte et al., 2003). Toto vedení transportuje různé faktory a rozpustné antigeny hluboko do tkáně, zatímco částice a velké molekuly jsou převážně vyloučeny z kompartmentů lymfocytů. Opravdu, lymfatické-nese chemokines z periferní tkáně jsou rychle transportovány do vysoké endoteliální žilka přes potrubí k ovládání mobilizace cirkulujících buněk do LNs (Palframan et al., 2001). Kromě toho některé rezidentní DC přímo kontaktují potrubí a zachycují lymfatické antigeny (Sixt et al ., 2005).
Nově Zjištěná Stromální Podmnožina, Mezní retikulocyty
vnější okraj V kůře, pod kapsle, je obklopen subkapsulární sinus (SCS; Obrázek 1A). Luminální povrch SCS je pokryt lymfatickými endoteliálními buňkami a jejich kortikální strana je podpořena bazální membránou, nazývanou „podlaha“ (Szakal et al ., 1983). Zejména v rámci IFRs se retikulární vlákna rozprostírají z podlahy do paracortexu (Gretz et al., 1997). Důležité je, že tenká vrstva retikulární struktury je také pozorována v nejvzdálenější oblasti folikulů. FRC-jako stromální buňky folikulární retikula express CXCL13 a MAdCAM-1, ale ne CCL21, což naznačuje, že tyto buňky jsou odlišné od T-zóně FRCs, zatímco FDC marker CR1/CD35 byl nepozorovaně nebo jen slabě vyjádřený v těchto buňkách (Katakai et al., 2008; obrázky 1B a 2A). FDC nevytvářejí retikulární vlákna, a proto retikulární marker ER-TR7 prakticky chybí ve středu folikulů (Katakai et al., 2004a, b). Kromě toho, retikulární buňky v subkapsulární oblasti konkrétně vyjádřit RANKL/TRANCE, což je TNF rodiny cytokinů, který je nezbytný pro LN rozvoj (Dougall et al., 1999; Kong a kol., 1999). Proto byly tyto stromální buňky považovány za novou stromální podmnožinu a byly označeny jako marginální retikulární buňky (MRC; Katakai et al., 2008). Z vědomí, značné množství CXCL13 je konstitutivně exprimovaných v MRCs v klidové malé folikuly, i když Pokládána express nedetekovatelné hladiny CXCL13 (Obrázek 1B). Je dobře známo, že vnější okraj kamarádů ve slezině, zejména ten, který leží nad folikuly, je ohraničen stromální vrstvou MAdCAM-1+. Buňky, které tvoří výstelku bazální membrány pod marginální sinus (MS), také vyjádřit CXCL13 a RANKL, což naznačuje, že tyto buňky jsou typem MRCs (Katakai et al., 2008). V Sladů, retikulární buňky podobné MRCs tvoří síť, v subepiteliální dome (SED) oblast těsně pod bazální membránou folikulu-spojené epitelem (FAE; Katakai et al., 2008; Knoop et al., 2009). Dohromady, MRC jsou považovány za stromální podmnožinu společnou pro SLOs, ale odlišnou od FDC a FRC.
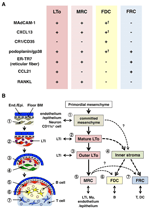
obrázek 2. Vztah mezi MRC a dalšími podskupinami stromálních buněk v SLOs. (A) vzor markerové exprese v podmnožinách stromálních buněk. Vyjádření úrovně MAdCAM-1, CXCL13, a podoplanin/gp38 v Fdc jsou často slabé nebo nedetekovatelné pomocí imunohistochemie (†). (B) schéma zobecněného modelu vývoje SLO s umístěním podmnožin stromálních buněk (vlevo) a domnělou genealogií podmnožin stromálních buněk (vpravo). Čísla označující buněčné prvky v levém výkresu představují podmnožiny stromálních buněk zobrazené v pravém schématu. BM, bazální membrána; konec./ Epi.,endoteliální nebo epiteliální vrstva.
MRCs a Antigen Záznam Trasy ve SLOs
Sekundární lymfatické orgány se vyznačují zvláštní konstrukcí, které filtrátu a doprava antigenů do lymfocytů prostory (Obrázek 1A). Ln jsou spojeny s lymfatickými cévami pro průzkum lymfatických antigenů. Protože aferentní lymfatika je otevřená SCS, sinusový lymfatický endotel a podlahová bazální membrána jsou, jak to bylo, přední povrch Ln filtru. Slezina filtruje krev, ve které větve centrální arterie otevřete MS a marginální zóny (MZ), kde imunitní buňky průzkum krve obsah. V těchto specializovaných sinus struktury, hranice, bariéry jsou lymfatického endotelu v SCS z LN a krev endotelu v MS sleziny, z nichž oba jsou podporovány MRC retikula. Zajímavé je, CD169+ metallophilic makrofágy jsou selektivně rozděleny v blízkosti sinus obložení nad folikuly, z nichž některé se usadit přes endoteliální bariéry a zprostředkovat částic antigenů z dutiny lumen do lymfocytů prostoru (Szakal et al., 1983; Taylor a kol., 2005; Carrasco a Batista, 2007; Phan a kol., 2009). DCs, které nesou antigeny z tkání přes lymfatické cévy dorazí na SCS a následně se přesunout do paracortex po podlaze z interfolikulární kanál (IFC; Steinman et al., 1997; Katakai a kol., 2004b; Braun a kol., 2011). U sladů funguje FAE jako bariéra, ve které specializovaná epiteliální buňka zvaná M buňky přenáší bakterie nebo částice ze střevního lumenu na základní DCs nebo makrofágy(Kraehenbuhl a Neutra, 2000). Proto MRC podporují zařízení pro transport antigenu v první linii v každém SLO. Základní konstrukce SLOs je, že folikuly jsou primárně uspořádány směrem místě vstupu antigenu a jsou doprovázeny T zóny. Ze stromálního hlediska se tedy zdá, že celá tkáňová architektura je uspořádána směrem k vrstvě MRC.
i když imunologické funkce MRCs zůstat nepolapitelný, to bylo dříve prokázáno, že vedení sítě postavené MRCs ve vnějším folikulu transporty malé rozpustné antigeny na folikulární B buňky a Fdc (Bajénoff a Germain, 2009; Roozendaal et al., 2009). Většina CD169+ makrofágy jsou umístěny na kortikální straně SCS podlahy a vyčnívají rozšíření do dutiny lumen zachytit částice (Phan et al., 2009). MRC se tak mohou podílet na lokalizaci, morfologii a funkci těchto makrofágů. Vývoj M buněk v PPs vyžaduje signalizaci RANKL-RANK, která je pravděpodobně řízena sítí MRC exprimující RANKL těsně pod FAE (Knoop et al ., 2009). Inhibice dráhy LT, která ruší podpisy MRC ve slezinné bílé buničině, narušuje strukturu MS (Koike et al ., 1996; Balogh a kol., 2007; Katakai a kol., 2008; Zindl a spol., 2009). Navíc zvýšená exprese ICAM-1, VCAM-1 a CXCL13 znamená, že MRC se podílejí na dynamické intersticiální migraci folikulárních B buněk jako funkčního lešení. CD169+ makrofágy bylo prokázáno, že přímo doručit částic antigenů do antigen-specifické B buňky v této oblasti (Carrasco a Batista, 2007; Phan et al., 2009), což naznačuje, že kontrola migrace B buněk zprostředkovaná sítí MRC může ovlivnit tento proces. Vzhledem k tomu, že MRC jsou také přítomny v oblasti IFC, pravděpodobně regulují transmigraci DCs z SCS do zóny T.
MRCs a Organizátor Stromální Buňky v SLO Rozvoj
Sekundární lymfatické orgány se vyvíjejí z anlagen, která jsou agregáty mezenchymálních a krvetvorných buněk spojené s cév nebo epitelu, na vymezeném místě a v období plodu nebo dítěte (Mebius, 2003). Zásadní událost ve vývoji SLO anlagen je hromadění průkazu cd45+CD4+CD3 – krvetvorné buňky, které jsou také známé jako lymfoidní tkáně induktor (LTi) buněk, které interagují s mezenchymální stromální buňky volal lymfatické tkáně organizátor (LTo) buněk (Mebius et al., 1997). Cytokin rodiny TNF, lymfotoxin (LT) – α1β2, který je exprimován buňkami LTi, přenáší signály do buněk LTo prostřednictvím receptoru LT-β. LTo buňky následně indukují expresi adhezních molekul, včetně ICAM-1, VCAM-1, MAdCAM-1, a chemokines CXCL13, CCL19 a CCL21 (Honda et al., 2001; Cupedo et al., 2004a; Bénézech et al 2010). CXCL13 je zvláště důležitý při přitahování LTI buněk k anlagenu prostřednictvím jeho receptoru CXCR5 (Finke et al ., 2002; Luther et al., 2003; Ohl a kol., 2003). Předpokládá se, že pozitivní zpětnovazební smyčka, tj. nově emigraci LTi buňky, které produkují LT dále aktivovat LTo stromální buňky, podpora organizace anlagen. Jak se lymfocyty začaly hromadit po narození, tkáň se rozšiřuje a kompartmenty podporované různými podmnožinami stromálních buněk jsou indukovány (Cupedo et al ., 2004b; Bajénoff and Germain 2009).
marginální retikulární buňky a LTO buňky exprimují velmi podobný vzorec různých markerů (obrázek 2A), což naznačuje, že mezi těmito dvěma stromálními buňkami existuje určitý vztah. LTo buňky se zdají být více soustředěny v marginální oblasti V anlagen přilehlé lymfatické sinus podezřelé SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl a kol., 2004; Katakai a kol., 2008). Zdá se, že tato vrstva LTO buněk se rozšiřuje směrem ven s růstem anlagenu, který se nakonec zdá být vrstvou MRC (Katakai et al., 2008). Stejně tak, jako lymfocyty se hromadí kolem centrální tepny v postnatálním sleziny, LTo buněk exprimujících MAdCAM-1 a RANKL rozšířit s vrstvou a stát MRCs v bílé dužiny. Tato zjištění silně naznačují, že MRCs jsou přímým potomkem LTo stroma, které zachovávají vlastnosti LTo buněk na specializované stránky, ve SLOs. I RAG-deficientní myši vykazují subkapsulární MRC vrstvy v atrofické LNs a scvrklé periarterial MRC pochev ve slezině, což naznačuje, že MRC vývoje dochází nezávisle na B a T buňky a je naprogramován před jejich kolonizace (Katakai et al., 2008). Od SLOs efektivně vzorku antigeny vyvolat imunitní reakce, antigen-sbírání struktur, které jsou konstruovány během vývoje musí být udržován poté. Proto je rozumné, že tyto tkáně struktury jsou udržovány organizátor-jako stromální buňky i v dospělosti.
vztah mezi MRC a jinými stromálními Podmnožinami
obrázek 2B ukazuje možnou genealogii stromálních podmnožin v SLOs. V embryu je prvotní mezenchym, který je v těsné blízkosti vaskulatury nebo epitelu, odhodlán tvořit jádro anlage a přitahuje buňky LTi. Nervové buňky nebo jiné méně charakterizované buňky jsou také zapojeny do počátečního procesu(Veiga-Fernandes et al ., 2007; van de Pavert et al., 2009). Akumulace LTI buněk usnadňuje zrání mezenchymálních buněk do LTO buněk, což nakonec usnadňuje konstrukci základní architektury. Typicky, LTo buňky mají tendenci soustředit se na okraji anlage a expandovat ven s tkáně růst, zatímco stromální buňky vykazující slabé nebo žádné LTo podpisy naopak zvýšení vnitřní část anlage. Postnatální kolonizace B A T buněk vede k kompartmentům s indukcí konvenčních stromálních podmnožin.
Pokud je toto schéma správné, z toho vyplývá, že všechny stromální podmnožiny v dospělých SLOs jsou původně odvozeny z LTO buněk. Mají tedy MRC, které zachovávají vlastnosti buněk LTo, schopnost diferencovat se na FDC nebo FRC? MRC sdílejí mnoho podpisů s jinými podmnožinami (obrázek 2A), což naznačuje, že je to možné. Jedna spekulace je, že MRCs funkce jako stromální kmenové buňky, které nepřetržitě dodávat všechny stromální podskupin v dospělosti. I když je tato myšlenka zajímavá, bude v budoucnu vyžadovat opatrné zvážení a další ověření. Mezenchymální buňky mají obecně velmi flexibilní povahu v závislosti na okolním prostředí, a tak lze snadno změnit specifické rysy. Rozšířená kultivace stromálních buněk izolovaných z LNs vede ke ztrátě exprese mnoha genů, zejména homeostatických chemokinů (Katakai et al ., 2004a; Tomei a kol., 2009). To naznačuje, že fenotypy podmnožin stromálních buněk in vivo jsou optimálně udržovány tkáňovými okolnostmi, které jsou reverzibilní a nejsou způsobeny terminální diferenciací. Kromě toho zánětlivé podněty indukují robustní proliferaci stromálních buněk a dramatickou remodelaci SLOs (Katakai et al ., 2004a; Chyou et al., 2011). Proto, i když MRCs by mohla být převedena do jiných podskupin, konvenční stromální podskupin může také self-obnovit a být zaměnitelné u dospělých SLOs.
remodelace SLOs a terciárních lymfoidních struktur
během imunitní odpovědi jsou stromální struktury uvnitř SLOs dramaticky remodelovány (Gretz et al ., 1997; Katakai a kol., 2004a). Některé infekce způsobit vážné narušení tkáně struktur v rámci LNs a sleziny bílá pulpa během několika dní, což je obnoven jako patogeny jsou vymýceny (Mueller et al., 2007a, b; Scandella et al., 2008; St John and Abraham, 2009). Tento proces obnovy pravděpodobně rekapituluje samoorganizující se proces prostřednictvím zpětné reakce podobné vývoji SLO. Důležité je, že buňky podobné LTi jsou také přítomny v dospělých tkáních a regulují remodelaci SLOs související s infekcí (Kim et al ., 2003; Scandella et al., 2008). Ačkoli role MRC v takových procesech není známa, pravděpodobně mají organizační roli ve spolupráci s buňkami podobnými LTi a určují vnější rámec SLOs během rekonstrukce.
V chronický zánět spojený s různých orgánových patologií, velké množství infiltrující lymfocyty často vedou k organizacím, které jsou podobné SLOs, známý jako terciární lymfoidních tkání (Kozy; Drayton et al., 2006). B A T buňky jsou odděleny a jsou indukovány odpovídající sítě podmnožin stromálních buněk. Bylo by zajímavé zjistit, zda MRCs jsou přítomny v těchto ektopické lymfatické struktury; nicméně, MRC, jako buňky a související tkáně struktury nejsou pozorovány u Kozy, která se vyvinula během myši autoimunitní gastritida (Katakai et al., 2006, 2008). Je třeba zdůraznit, že TLT nejsou zásadně naprogramovány lymfoidní organizace a přirozeně se nespojují se strukturami transportujícími antigen. Proto MRC pravděpodobně chybí v TLT. I když stromální buňky, které jsou fenotypově podobné MRCs může být vyvolán v některých lézí, že by neměl být identifikován jako MRCs, pokud mají úzce spojit s konkrétní endotelové nebo epitelové struktury a tvoří vrstvené retikula na vnější folikuly.
závěr
marginální retikulární buňky jsou jedinečnou podmnožinou stromálních buněk společnou pro SLOs. MRCs jsou zřetelně odlišné od běžných podskupin, které jsou vyvolané nebo maturated prostřednictvím interakcí s lymfocyty po narození, a jsou přímo odvozeny z LTo stromální buňky v anlagen a nezávislé lymfocytů. Síť MRCs je úzce spojena s antigenem-přepravu aparátu SLOs a předpokládá se, že přímo nebo nepřímo kontrolu antigenu dodání lymfocytů oddíly, stejně jako lokalizace a migraci imunitních buněk. MRC pravděpodobně hrají klíčovou roli při udržování struktur SLO jako vnějšího rámce a mohou být převedeny na jiné stromální podmnožiny v ustáleném stavu nebo během remodelace tkáně. Bude důležité společně zvážit všechny stromální podmnožiny, tkáňové struktury a imunologické mikroprostředí, aby bylo možné komplexně porozumět systému SLO.
Prohlášení o střetu zájmů
autor prohlašuje, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
Tato práce byla podporována z části Grant-v-Pomoc pro Mladé Vědce a pro Vědecký Výzkum v Inovativních Oblastech od Ministerstva Školství, Kultury, Sportu, Vědy a Technologie Japonska.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. a Germain, R. N. (2006). Stromální buněčné sítě regulují vstup lymfocytů, migraci a teritorialitu v lymfatických uzlinách. Imunita 25, 989-1001.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Bajénoff, M., and Germain, R. N. (2009). Vývoj folikulů B-buněk remodeluje potrubní systém a umožňuje dodávání rozpustného antigenu do folikulárních dendritických buněk. Krev 114, 4989-4997.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, h. H., a Weih, F. (2007). Odlišné role lymfotoxin-β signalizace a homeodomain transkripční faktor Nkx2.3 v ontogenezi endoteliální přihrádky ve slezině. Cell Tissue Res.328, 473-486.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Bénézech, C., White, a., Mader, e., Serre, k., Parnell, s., Pfeffer, k., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Ontogeneze stromálních organizátorových buněk během vývoje lymfatických uzlin. J. Immunol. 184, 4521–4530.
Pubmed Abstraktní | Pubmed Úplné Znění
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., a Förster, R. (2011). Aferentní lymfatické T buňky a DC používají různé cesty závislé na chemokinovém receptoru ccr7 pro vstup do lymfatických uzlin a intranodální migraci. Adresa. Immunol. 12, 879–887.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Carrasco, y. R., and Batista, F. D. (2007). B buňky získávají částic antigenu v makrofágů-bohaté oblasti na hranici mezi folikulu a subkapsulární sinus lymfatických uzlin. Imunita 27, 160-171.
Pubmed Abstrakt | Pubmed Plný Text / CrossRef Plný Text
Chyou, s., Benahmed, F., Chen, J., Kumar, V., Tian, s., Lipp, M., and Lu, T. T. (2011). Koordinovaná regulace vaskulárně-stromálního růstu lymfatických uzlin nejprve buňkami CD11c+ a poté T A B buňkami. J. Immunol. 187, 5558–5567.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., kala, a. E., Jansen, W., Jackson, D. G., Kraal, G., a Mebius, R. E. (2004a). Předpokládané organizátory lymfatických uzlin jsou odlišně zastoupeny ve vývoji mezenterických a periferních uzlin. J. Immunol. 173, 2968–2975.
Pubmed Abstraktní | Pubmed Úplné Znění
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., a Mebius, R. E. (2004b). Iniciace buněčné organizace v lymfatických uzlinách je regulována signály odvozenými od B buněk a není závislá na chemokinovém ligandu CXC 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract / Pubmed Plný Text
Cyster, J. G. (1999). Chemokiny a migrace buněk v sekundárních lymfoidních orgánech. Věda 286, 2098-2102.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H. Hyman, P. L., Tang, H. L., Luther, S. a., a Nevládních organizací, V. N. (2000). Folikulární stromální buňky a lymfocyty navádějí do folikulů. Immunol. Rev. 176: 181-193.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J.J., and Schuh, J. (1999). Hodnost je nezbytná pro vývoj osteoklastů a lymfatických uzlin. Geny Dev. 13, 2412–2424.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Drayton, D. L., Liao, S., Mounzer, R. H., a Ruddle, N. H. (2006). Vývoj lymfoidních orgánů: od ontogeneze po neogenezi. Adresa. Immunol. 7, 344–353.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Eberl, G., Marmon, S., Sunshine, M. J. Rennert, P. D., Choi, Y., a Littman, D. R. (2004). Základní funkce pro jaderný receptor RORy (t) při generování buněk induktorů lymfatické tkáně plodu. Adresa. Immunol. 5, 64–73.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, h., Mattis, a., Lipp, M., and Kraehenbuhl, J. (2002). CD4 + CD3-buňky indukují Peyerův vývoj náplasti: úloha aktivace α4β1 integrinu CXCR5. Imunita 17, 363-373.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fletcher, a. L., Lukacs-Kornek, v., Reynoso, E. D., Pinner, s. e., Bellemare-Pelletier, a., Curry, MS, Collier, a. R., Boyd, R. L., and Turley, S. J. (2010). Fibroblastické retikulární buňky lymfatických uzlin přímo představují antigen periferní tkáně v ustáleném stavu a zánětlivých stavech. J.Exp. Med. 207, 689–697.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Gretz, J.E., Anderson, a. O., and Shaw, s. (1997). Kordy, kanály, chodby a potrubí: kritické architektonické prvky usnadňující buněčné interakce v kůře lymfatických uzlin. Immunol. Rev. 156, 11-24.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Gretz, J. E., Norbury, C. C., Anderson, a. O., Proudfoot, a. E., Shaw, S. (2000). Lymfatických-nese chemokines a jiné nízkomolekulární molekuly dosáhnout vysoké endotelu venul prostřednictvím specializované obvody, zatímco funkční bariéra omezuje přístup k lymfocytů mikroprostředí v lymfatických uzlin kůry. J.Exp. Med. 192, 1425–1440.
Pubmed Abstrakt | Pubmed Plný Text | CrossRef Plný Text
Honda, k., Nakano, h., Yoshida, h., Nishikawa, s., Rennert, P., Ikuta, k., Tamechika, m.,Yamaguchi, k., Fukumoto, T., Chiba, T., and Nishikawa, s. – i. (2001). Molekulární základ pro hematopoetickou / mezenchymální interakci během zahájení Peyerovy organogeneze náplasti. J.Exp. Med. 193, 621–630.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., a Aguzzi, A. (2005). Geny závislé na lymfotoxinu-β receptoru v transkriptomech lymfatických uzlin a folikulárních dendritických buněk. J. Immunol. 174, 5526–5536.
Pubmed Abstraktní | Pubmed Úplné Znění
Kaldjian, E. P., Gretz, J. E., Anderson, a. O., Shi, Y., a. Shaw, S. (2001). Prostorové a molekulární organizace lymfatických uzlin T buněk kůry: labyrintu dutiny ohraničené na epitel-jako monovrstva z fibroblastický retikulární buňky ukotveny k bazální membráně-jako extracelulární matrix. Int. Immunol. 13, 1243–1253.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Katakai, T., Hara, T., Sugai, m., Gonda, H., and Shimizu, a. (2004a). Fibroblastické retikulární buňky lymfatických uzlin vytvářejí stromální retikulum prostřednictvím kontaktu s lymfocyty. J.Exp. Med. 200, 783–795.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Katakai, T., Hara, T., Lee, J. H., Gonda, h., Sugai, M., and Shimizu, a. (2004b). Nová retikulární stromální struktura v kůře lymfatických uzlin: imuno-platforma pro interakce mezi dendritickými buňkami, T buňkami a B buňkami. Int. Immunol. 16, 1133–1142.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Katakai, T., Nomura, T., Gonda, h., Sugai, m., Agata, y., Nishio, a., Masuda, T., Sakaguchi, s., and Shimizu, a. (2006). Spontánní rozsáhlá lymfoidní neogeneze a vyvážená autoimunita versus tolerance v žaludku transgenní myši H+/K + -ATPáza-reaktivní TCR. J. Immunol. 177, 7858–7867.
Pubmed Abstrakt/Pubmed Plný Text
Katakai, T., Suto, h., Sugai, m., Gonda, h., Togawa, a., Suematsu, s., Ebisuno, y., Katagiri, k., Kinashi, T., and Shimizu, a. (2008). Organizátor-jako retikulární stromální buněčná vrstva společná pro dospělé sekundární lymfoidní orgány. J. Immunol. 181, 6189–6200.
Pubmed Abstraktní | Pubmed Úplné Znění
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Soudce, A., Raykundalia, C., Walker, L. S., Goodall, M. D. a Lane, P. J. (2003). CD4+ CD3 – příslušenství buněk costimulate nátěrem CD4 T buněk prostřednictvím OX40 a CD30 v místech, kde T-buňky spolupracují s B-buňky. Imunita 18, 643-654.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Knoop, K. a., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita H, Kiyono, H., a Williams, I. R. (2009). RANKL je nezbytný a dostatečný k zahájení vývoje M buněk vzorkovacích antigenů ve střevním epitelu. J. Immunol. 183, 5738–5747.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, h., Hataba, y., Hataba, y., Watanabe, T., Miyawaki, s., and Miyasaka, m. (1996). Splenická marginální zóna chybí u alymfoplastických aly mutantních myší. Euro. J. Immunol. 26, 669–675.
Pubmed Abstrakt | Pubmed Plný Text | CrossRef Plný Text
Kong, Y. Y., Yoshida, h., Sarosi, i., Tan, H. L., Timms, E., Capparelli C, Morony, S., Oliveira-dos-Santos, a. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, J. W., a Penninger, J. M. (1999). OPGL je klíčovým regulátorem osteoklastogeneze, vývoje lymfocytů a organogeneze lymfatických uzlin. Příroda 397, 315-323.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Epitelové m buňky: diferenciace a funkce. Annu. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Odkaz, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., a Luthera, S. a. (2007). Fibroblastické retikulární buňky v lymfatických uzlinách regulují homeostázu naivních T buněk. Adresa. Immunol. 8, 1255–1265.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, s. a. R., a Turley, S. J. (2011). Regulované uvolňování oxidu dusnatého nehematopoetickým stromem řídí expanzi aktivovaného bazénu T buněk v lymfatických uzlinách. Adresa. Immunol. 12, 1096–1104.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Luther, S. a., Tang, H. L. Hyman, P. L. Farr, a. G., a Cyster, J. G. (2000). Koexprese chemokinů ELC a SLC stromálními buňkami T zóny a delece genu ELC u myší plt/plt. Proc. Natle. Acad. Věda. U. S. A. 97, 12694-12699.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Luther, s. a., Ansel, K. M., a Cyster, J.G. (2003). Překrývající se role CXCL13, interleukin 7 receptor α, a ccr7 ligandy ve vývoji lymfatických uzlin. J.Exp. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, C.R. (2001). Chemokiny: vysoké impaktní faktory imunologie. Adresa. Immunol. 2, 95–101.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Malhotra, D., Fletcher, A. L., Astaritu, J, Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B.,Carroll, M. C., Mooney, D. J., Turley, S. J. a konsorcium projektu imunologického genomu. (2012). Transkripční profilování stromatu ze zanícených a klidových lymfatických uzlin definuje imunologické znaky. Adresa. Immunol. 13, 499–510.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Mebius, R. E., Rennert, P., a Weissman, I. L. (1997). Vyvíjející se lymfatické uzliny shromažďují buňky CD4+ CD3-LTß+ , které se mohou diferencovat na APC, NK buňky a folikulární buňky, ale ne T nebo B buňky. Imunita 7, 493-504.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mebius, R.E. (2003). Organogeneze lymfoidních tkání. Adresa. Rev. Immunol. 3, 292–303.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Mueller, S. N., Hosiawa-Meagher, K. a., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., a Matloubian, M. (2007a). Regulace homeostatické exprese chemokinu a obchodování s buňkami během imunitní odpovědi. Věda 317, 670-674.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., a Ahmed, R. (2007b). Virové cílení fibroblastických retikulárních buněk přispívá k imunosupresi a perzistenci během chronické infekce. Proc. Natle. Acad. Věda. USA 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Mueller, S. N., and Germain, R. N. (2009). Stromální buňka přispívá k homeostáze a funkčnosti imunitního systému. Adresa. Rev. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Müller, G., Höpken, U. E., and Lipp, m. (2003). Vliv CCR7 a CXCR5 na vývoj lymfatických orgánů a systémovou imunitu. Immunol. Rev. 195, 117-135.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Nolte, M. a., Beliën, J. a., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., a Mebius, R. E. (2003). Potrubní systém distribuuje chemokiny a malé molekuly přenášené krví přes splenickou bílou buničinu. J.Exp. Med. 198, 505–512.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., a Förster, R. (2003). Spolupracující mechanismy CXCR5 a CCR7 při vývoji a organizaci sekundárních lymfoidních orgánů. J.Exp. Med. 197, 1199–1204.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., a von Andrian, U. H. (2001). Zánětlivý transport a prezentace chemokinů v HEV: mechanismus dálkového ovládání pro nábor monocytů do lymfatických uzlin v zanícených tkáních. J.Exp. Med. 194, 1361–1373.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Phan, T. G., Zelená, J. a., Gray, E. E., Xu, Y., a Cyster, J. G. (2009). Relé imunitního komplexu subkapsulárními sinusovými makrofágy a nerozpoznanými B buňkami řídí maturaci afinity protilátek. Adresa. Immunol. 10, 786–793.
Pubmed Abstrakt | Pubmed Plný Text / CrossRef Plný Text
Roozendaal, R., Mempel, T. R.,Džbán, L. a., Gonzalez, s. F., Verschoor, a., Mebius, R. E., von Andrian, U. H., and Carroll, M. C. (2009). Kanály zprostředkovávají transport nízkomolekulárního antigenu do folikulů lymfatických uzlin. Imunita 30, 264-276.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Roozendaal, R., and Mebius, R. E. (2011). Interakce stromálních buněk a imunitních buněk. Annu. Rev. Immunol. 29, 23–43.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Scandella, E., Bolinger, B., Lattmann, E., Miller, a. S., Favre, S., Littman, D. R., Finke, D., Luther, s. a., Junt, T., and Ludewig, B. (2008). Obnova integrity lymfoidních orgánů interakcí buněk induktorů lymfoidní tkáně se stromem zóny T buněk. Adresa. Immunol. 9, 667–675.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., a Sorokin, L. (2005). Potrubní systém transportuje rozpustné antigeny z aferentní lymfy do rezidentních dendritických buněk v oblasti T buněk lymfatické uzliny. Imunita 22, 19-29.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Steinman, R.M., Pack, M., and Inaba, k. (1997). Dendritické buňky v oblastech T-buněk lymfoidních orgánů. Immunol. Rev. 156, 25-37.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
St John, A. L., and Abraham, s. n. (2009). Salmonella narušuje architekturu lymfatických uzlin potlačením homeostatických chemokinů zprostředkovaným TLR4. Adresa. Med. 15, 1259–1265.
Pubmed Abstrakt | Pubmed Plný Text/CrossRef Plný Text
Suzuki, k., Maruya, m., Kawamoto, s., Sitnik, k., Kitamura, h., Agace, W. W., and Fagarasan, s. (2010). Snímání environmentálních podnětů folikulárními dendritickými buňkami podporuje generaci imunoglobulinu ve střevě. Imunita 33, 71-83.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Szabo, M. C., Řezník, E. C., a McEvoy, L. M. (1997). Specializace slizničních folikulárních dendritických buněk odhalených zobrazením adheze molekuly mukózní adresyn-buňka-1. J. Immunol. 158, 5584–5588.
Pubmed Abstract / Pubmed Plný Text
Szakal, a. k., Holmes, K. L., and Tew, J. G. (1983). Transport imunitních komplexů ze subkapsulárního sinusu do folikulů lymfatických uzlin na povrchu nefagocytárních buněk, včetně buněk s dendritickou morfologií. J. Immunol. 131, 1714–1727.
Pubmed Abstraktní | Pubmed Úplné Znění
Taylor, P. R., Martinez-Sady, L., Stacey, M., Lin, h. H., Brown, G. D., a Gordon, S. (2005). Makrofágové receptory a imunitní rozpoznávání. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Tew, J. G., Wu, J., Qin, D., Kormidlo, S., Burton, G. F., a Szakal, A. K. (1997). Folikulární dendritické buňky a prezentace antigenních a kostimulačních signálů B buňkám. Immunol. Rev. 156, 39-52.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Tomei, a. a., Siegert, S., Britschgi, M. R., Luther, S. a., a Swartz, M. a. (2009). Tok tekutin reguluje organizaci stromálních buněk a expresi CCL21 v tkáňovém mikroprostředí lymfatických uzlin. J. Immunol. 183, 4273–4283.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
van de Pavert, S. a., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M. Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J., a Mebius, R. E. (2009). Chemokin CXCL13 je nezbytný pro iniciaci lymfatických uzlin a je indukován stimulací kyseliny retinové a neuronů. Adresa. Immunol. 10, 1193–1199.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., a Kioussis, D. (2007). Tyrosinkinázový receptor RET je klíčovým regulátorem Peyerovy organogeneze náplasti. Nature 446, 547-551.
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., a Kollias, G. (2006). FDC-specifické funkce p55TNFR a IKK2 ve vývoji FDC sítí a protilátkové odpovědi. Imunita 24, 65-77.
Pubmed Abstrakt | Pubmed Plný Text | CrossRef Plný Text
Zindl, C. L., Kim, T. H., Zeng, m., Archambault, a. s., Grayson, M. H., Choi, k., Schreiber, R. D., and Chaplin, D. D. (2009). Lymfotoxin LTa1ß2 řídí postnatální a dospělou slezinu marginální sinusovou vaskulární strukturu a funkci. Imunita 30, 408-420.
Pubmed Abstrakt | Pubmed Plný Text / CrossRef Plný Text