Frontiers in Immunology
- introduktion
- T-og B-Cellerum og to konventionelle Stromalcelleundersæt
- en nyligt identificeret Stromal delmængde, marginale retikulære celler
- MRC ‘ er og Antigenindgangsvejen i SLOs
- MRC ‘ er og Arrangørstromalceller i SLO-udvikling
- forholdet mellem MRC ‘er og andre stromale undergrupper
- Remodeling af Slo ‘er og tertiære lymfoide strukturer
- konklusion
- interessekonflikt Erklæring
- anerkendelser
introduktion
sekundære lymfoide organer/væv (Slo ‘ er) er afgørende for effektiv induktion af adaptive immunresponser. Flere typer Slo ‘ er, herunder lymfeknuder (LNs), milt og slimhindeassocierede lymfoide væv (MALTs) såsom Peyers patches (PPs), er strategisk placeret på forskellige steder i kroppen. Slo ‘ er er et detaljeret filter, der prøver antigener og er udstyret med meget følsomme immunsensorer. For at indsamle og filtratere fremmede antigener indeholder Slo ‘ er specialiserede vævsstrukturer, der er forbundet med endotelet eller epitelet. Immunceller såsom lymfocytter, dendritiske celler (DCs) og makrofager akkumuleres til høje tætheder og danner rum. Et bemærkelsesværdigt træk, der er fælles for alle Slo ‘ er, er den adskilte lokalisering af B-celler og T-celler. Slos ‘ arkitektur understøttes af flere typer ikke-hæmatopoietiske stromaceller af mesenkymal oprindelse, som konstruerer netværk og definerer rum (Mueller og Germain, 2009; Roosendaal og Mebius, 2011). Stromale netværk giver ikke kun et funktionelt fodfæste, men også et rum til immuncelleaktiviteter samt en fysisk ramme for vævet. Desuden indikerer voksende beviser, at stromaceller også spiller kritiske roller i immuncellefunktion og homeostase (Link et al., 2007; Fletcher et al., 2010; Susuki et al., 2010; Lukacs-Kornek et al., 2011). Slo ‘ er er programmeret til at udvikle sig fra anlagen, der forekommer på bestemte steder og i begrænsede perioder hos fosteret og spædbarnet. Derudover er stromalceller kendt for at være vigtige for SLO-udvikling og vedligeholdelse (Mebius, 2003). Her fokuserer jeg på en nyligt identificeret stromal delmængde, marginale retikulære celler (MRC ‘ er) og opsummerer deres egenskaber. Jeg diskuterer også forholdet mellem MRC ‘ er og vævsstruktur, andre stromale undergrupper og immunologiske funktioner.
T-og B-Cellerum og to konventionelle Stromalcelleundersæt
som beskrevet ovenfor lokaliseres B-celler og T-celler til forskellige regioner inden for Slo ‘ er. B-celler akkumuleres for at danne follikler (B-område) i den ydre hjernebark under kapslen i LNS eller i den ydre periarteriolære lymfoide kappe (PALS) i milten. En klynge af store follikler er kernevævet i PPs. Under immunresponser danner aktiverede B-celler i folliklerne germinale centre, hvor de differentierer sig til antistofproducenter med høj affinitet (Cyster et al., 2000). I modsætning hertil lokaliseres T-celler til et separat område (T-område) ved siden af folliklerne, dvs.parakorteksen i LNs, indre PALS i milten eller interfollikulær region (IFR) i PPs. DCs akkumuleres også i T-området for at præsentere antigen og prime T-celler (Steinman et al., 1997).
der er to forskellige typer mesenkymale stromale undergrupper i B-og T-områderne (figur 1a). Follikulære dendritiske celler (FDC ‘ er) danner et tæt netværk i midten af folliklerne og har fået betydelig opmærksomhed på grund af deres betydning i antistofproduktion af B-celler., 1997; Cyster et al., 2000; Victoratos et al., 2006; Susuki et al., 2010). FDC ‘ er udtrykker CR1 / CD35, CD23 og lejlighedsvis MAdCAM – 1., 1997; Cyster et al., 2000). I modsætning hertil omfatter et omfattende netværk af fibroblastiske retikulære celler (FRC ‘ er) stilladset i T-området, der producerer podoplanin/gp38 og forskellige ekstracellulære matricer (ECM) komponenter (Gretse et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Generelt reguleres immuncellemigration og lokalisering af en række kemokiner (Mackay, 2001). Hvilende lymfocytter og modne DC ‘ er er meget lydhøre over for “homeostatiske kemokiner” (Cyster, 1999; m Lartller et al 2003). I overensstemmelse med dette er der klare korrelationer mellem kemokiner produceret af stromalcelleundersæt og lokalisering af immunceller, der udtrykker de tilsvarende receptorer; CKSCL13 produceret af FDCs er et tiltrækkende middel af B-celler, der udtrykker CKSCR5, mens CCL19 og CCL21 fra T-område FRCS tiltrækker T-celler og modne DC ‘ er gennem den fælles receptor CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Desuden menes lymfocytter, der migrerer robust i vævsparenchymen for at scanne antigener, at bruge stromale netværk som fodfæste (Baj Larsnoff et al 2006). En række faktorer produceret af stromale undergrupper er også nødvendige for aktivering og overlevelse af immunceller (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Susuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Derfor er strukturen og funktionen af stromalnetværket i hvert rum sandsynligvis optimeret til aktiviteten af immuncelleundersæt.
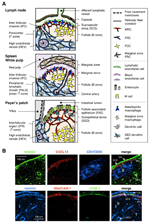
figur 1. Stromale celleundergrupper og vævsstrukturer af Slo ‘ er. (A) skematisk repræsentation af vævsstrukturer i museslo ‘ er med vægt på stromaceller og det antigentransporterende apparat. Stromale elementer, herunder mesenkymale, endotel-og epitelceller såvel som myeloide celler såsom makrofager og dendritiske celler (angivet i højre panel), tegnes til vægt. (B) øvre: vævsrammen Konstrueret af tre forskellige typer stromaceller i den ydre kortikale region af LN. Fluorescerende immunfarvning af en mus Ln sektion. I den øvre mikrograf er der en lille hvilende follikel (B) uden et germinalt center, som understøttes af FDC ‘ er, der udtrykker CR1/CD35, men ikke detekterbare niveauer af CKSCL13. I stedet danner MRC ‘ er et laminin+CKSCL13+ retikulært netværk i den ydre kant af folliklen under kapslen (CA) og SCS. Netværket Konstrueret af FRCs i parakorteksen (T) er laminin+CKSCL13-CR1/CD35-. Lavere: MAdCAM-1+ MRC-lag er tæt forbundet med LYVE-1 + lymfatisk endotellag i SCS. Bemærk, at MRC-lag udvides til IFC-området.
stromalnetværket i T-området er sammensat af FRC ‘ er og et ECM-bundt kendt som en retikulær fiber, som danner en “ledning”, der letter passagen af stoffer med lav molekylvægt (Gretse et al., 1997, 2000; Nolte et al., 2003). Denne ledning transporterer forskellige faktorer og opløselige antigener dybt inde i vævet, mens partikler og store molekyler overvejende udelukkes fra lymfocytrummet. Faktisk transporteres lymfebårne kemokiner fra perifere væv hurtigt til den høje endotelvenule gennem ledningen for at kontrollere mobiliseringen af cirkulerende celler i LNs (Palframan et al., 2001). Derudover kontakter nogle bosiddende DC ‘ er direkte ledningen og fanger lymfebårne antigener (altid et al., 2005).
en nyligt identificeret Stromal delmængde, marginale retikulære celler
den ydre kant af Ln-barken, lige under kapslen, er omgivet af den subkapsulære sinus (SCS; figur 1a). Den luminale overflade af SCS er dækket af lymfatiske endotelceller, og deres kortikale side understøttes af kældermembranen, kaldet “gulvet”., 1983). Især inden for IFRs, retikulære fibre spredt ud fra gulvet ind i parakorteksen., 1997). Det er vigtigt, at der også observeres et tyndt lag retikulær struktur i det yderste område af folliklerne. FRC – lignende stromaceller i follikulært retikulum udtrykker CKSCL13 og MAdCAM-1, men ikke Ccl21, hvilket indikerer, at disse celler adskiller sig fra T-område FRC ‘ er, mens FDC-markøren CR1/CD35 var uopdaget eller kun svagt udtrykt i disse celler (Katakai et al., 2008; figur 1b og 2a). FDC ‘ er genererer ikke retikulære fibre, og følgelig er den retikulære markør er-TR7 næsten fraværende i midten af folliklerne (Katakai et al., 2004a, b). Derudover udtrykker retikulære celler i den subkapsulære region specifikt RANKL / TRANCE, som er et TNF-familiecytokin, der er essentielt for Ln-udvikling (Dougall et al., 1999; Kong et al., 1999). Derfor blev disse stromaceller antaget at være en ny stromal delmængde og blev betegnet marginale retikulære celler (MRC ‘ er; Katakai et al., 2008). Bemærk, at en betydelig mængde CKSCL13 udtrykkes konstitutivt i MRC ‘er i hvilende små follikler, selvom FDC’ er udtrykker ikke-detekterbare niveauer af CKSCL13 (figur 1b). Det er veletableret, at den ydre kant af PALS i milten, især den, der ligger over folliklerne, er omgivet af et MAdCAM-1+ stromallag. Cellerne, der udgør foringen af kældermembranen under den marginale sinus (MS), udtrykker også CKSCL13 og RANKL, hvilket indikerer, at disse celler er en type MRC ‘ er (Katakai et al., 2008). I Malt danner retikulære celler svarende til MRC ‘ er et netværk i subepitelial dome (SED)-regionen lige under kældermembranen i det follikelassocierede epitel (FAE; Katakai et al., 2008; Knoop et al., 2009). Samlet set menes MRC ‘er at være en stromal delmængde, der er fælles for Slo’ er, men adskiller sig fra FDC ‘er og FRC’ er.
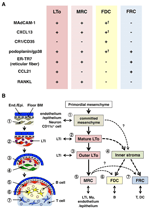
figur 2. Forholdet mellem MRC ‘er og andre stromalcelleundersæt i slo’ er. (A) mønster af markørekspression i stromacelleundersæt. Ekspressionsniveauer af MAdCAM-1, CKSCL13 og podoplanin/gp38 i FDC ‘ er er ofte svage eller ikke detekterbare ved immunhistokemi (Kurt). (B) skematisk af en generaliseret model for SLO-udvikling med placeringen af stromalcelleundersæt (venstre) og en formodet slægtsforskning af stromalcelleundersæt (højre). Tal, der angiver celleelementer i venstre tegning, repræsenterer stromalcelleundersæt vist i højre skema. BM, kældermembran; ende./ Epi., endotel-eller epitellag.
MRC ‘ er og Antigenindgangsvejen i SLOs
sekundære lymfoide organer er kendetegnet ved særlige strukturer, der filtrerer og transporterer antigener ind i lymfocytrummet (figur 1a). LNs er forbundet med lymfekar for at undersøge lymfebårne antigener. Fordi de afferente lymfatiske stoffer er åbne for SCS, er sinus lymfatisk endotel og gulvkældermembran som den forreste overflade af LN-filteret. Milten filtrerer blod, hvor grene af den centrale arterie åbner for MS og marginalområdet (MSA), hvor immunceller undersøger blodindholdet. I disse specialiserede sinusstrukturer er grænsebarriererne det lymfatiske endotel i SCS af LN og blodendotelet i MS af milten, som begge understøttes af MRC-retikulumet. Interessant nok fordeles CD169+ metallofile makrofager selektivt nær sinusforingen over folliklerne, hvoraf nogle sætter sig over endotelbarrieren og overfører partikelformede antigener fra sinuslumen ind i lymfocytrummet., 1983; Taylor et al., 2005; Carrasco og Batista, 2007; Phan et al., 2009). DCs, der bærer antigener fra vævene via lymfekarrene, ankommer til SCS og bevæger sig derefter ind i parakortekset over gulvet i den interfollikulære kanal (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). I Malt fungerer FAE som den barriere, hvor en specialiseret epitelcelle kaldet M-celler overfører bakterier eller partikler fra tarmens lumen til underliggende DC ‘ er eller makrofager (Kraehebuhl og Neutra, 2000). Derfor understøtter MRC ‘ er det frontlinjeantigentransporterende apparat i hver SLO. Det grundlæggende design af SLOs er, at folliklerne primært er arrangeret mod stedet for antigenindtastning og ledsages af T-områder. Fra et stromalt synspunkt ser det således ud til, at hele vævsarkitekturen er organiseret mod MRC-laget.
selvom de immunologiske funktioner af MRC ‘er forbliver undvigende, blev det tidligere vist, at ledningsnetværket Konstrueret af MRC’ er i den ydre follikel transporterer små opløselige antigener til follikulære B-celler og FDC ‘ er (Baj Pursnoff og Germain, 2009; Roosendaal et al., 2009). De fleste CD169+ makrofager er placeret på den kortikale side af SCS-gulvet og stikker en forlængelse ud i sinuslumen for at fange partikler (Phan et al., 2009). Således kan MRC ‘ er være involveret i lokalisering, morfologi og funktion af disse makrofager. M-celleudvikling i PPs kræver RANKL – rank signalering, som sandsynligvis styres af et RANKL-udtrykkende MRC-netværk lige under FAE (Knoop et al., 2009). Inhibering af LT-vejen, som afskaffer MRC-signaturer i den milthvide pulp, forstyrrer MS-strukturen (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Et al., 2009). Desuden indebærer forhøjet ICAM-1, vcam-1 og CKSCL13-ekspression, at MRC ‘ er er involveret i den dynamiske interstitielle migration af follikulære B-celler som et funktionelt stillads. CD169 + makrofager har vist sig at levere direkte partikelformige antigener til antigenspecifikke B-celler i dette område (Carrasco og Batista, 2007; Phan et al., 2009), hvilket antyder, at MRC-netværksmedieret kontrol af B-cellemigration kan påvirke denne proces. Da MRC ‘er også er til stede i IFC-regionen, regulerer de muligvis transmigrationen af DC’ er fra SCS mod T-området.
MRC ‘ er og Arrangørstromalceller i SLO-udvikling
sekundære lymfoide organer udvikler sig fra anlagen, som er aggregater af mesenkymale og hæmatopoietiske celler forbundet med kar eller epitel, på et defineret sted og periode hos fosteret eller spædbarnet (Mebius, 2003). En kritisk begivenhed i udviklingen af SLO anlagen er akkumuleringen af CD45+CD4+CD3 – hæmatopoietiske celler, som også er kendt som lymfoide vævsinducerende (LTi) celler, der interagerer med mesenkymale stromaceller kaldet lymfoide vævsarrangør (LTo) celler (Mebius et al., 1997). Et TNF-familiecytokin, lymfotoksin (LT)-lus1 lus2, der udtrykkes af LTI-celler, transmitterer signaler til LTO-celler via LT-lusreceptoren. LTo-celler inducerer efterfølgende ekspressionen af adhæsionsmolekyler, herunder ICAM-1, VCAM-1 og MAdCAM-1, og kemokiner CKSCL13, CCL19 og CCL21 (Honda et al., 2001; Cupedo et al., 2004a; B. Især er CKSCL13 særlig vigtig for at tiltrække LTI-celler til anlagen via dets receptor CKSCR5 (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Det antages, at en positiv feedback loop, dvs. nyligt immigrerende LTI-celler, der producerer LT, aktiverer LTo-stromaceller yderligere, hvilket fremmer organisationen af anlagen. Da lymfocytter begyndte at ophobes efter fødslen, udvides vævet, og de rum, der understøttes af forskellige stromalcelleundersæt, induceres (Cupedo et al., 2004b; Baj Krisnoff og Germain 2009).marginale retikulære celler og LTO-celler udtrykker et meget lignende mønster af forskellige markører (figur 2a), hvilket antyder, at der er en vis sammenhæng mellem disse to stromaceller. LTo-celler synes at være mere koncentreret i den marginale region af LN anlagen ved siden af lymfatisk sinus af den formodede SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Dette LTO-cellelag ser ud til at ekspandere udad med væksten af anlagen, som i sidste ende ser ud til at blive MRC-laget (Katakai et al., 2008). Ligeledes, når lymfocytter akkumuleres omkring den centrale arterie i den postnatale milt, udvides LTo-celler, der udtrykker MAdCAM-1 og RANKL, med laget og bliver MRC ‘ er i den hvide papirmasse. Disse fund tyder stærkt på, at MRC ‘er er en direkte efterkommer af LTo stroma, som bevarer egenskaberne ved LTo-celler på specialiserede steder inden for Slo’ er. Selv RAG-mangelfulde mus udviser et subkapsulært MRC-lag i atrofiske LNs og krympede periarterielle MRC-hylster i milten, hvilket indikerer, at MRC-udvikling forekommer uafhængigt af B-og T-celler og er programmeret før deres kolonisering (Katakai et al., 2008). Da Slo ‘ er effektivt prøver antigener for at udløse immunresponser, skal de antigenopsamlende strukturer, der er konstrueret under udvikling, opretholdes derefter. Derfor er det rimeligt, at disse vævsstrukturer opretholdes af arrangørlignende stromaceller i hele voksenalderen.
forholdet mellem MRC ‘er og andre stromale undergrupper
figur 2b viser den mulige slægtsforskning for stromale undergrupper i slo’ er. I embryoet er det primordiale mesenchym, der er tæt på vaskulaturen eller epitelet, forpligtet til at danne anlage-kernen og tiltrækker LTi-celler. Nerveceller eller andre mindre karakteriserede celler er også involveret i den indledende proces (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). Akkumuleringen af LTI-celler Letter modningen af mesenkymale celler i LTo-celler, hvilket i sidste ende letter konstruktionen af den grundlæggende arkitektur. Typisk har LTO-celler en tendens til at koncentrere sig ved periferien af Anlagen og ekspandere udad med vævsvækst, mens stromaceller udviser svage eller ingen LTo-signaturer omvendt øges i den indre del af Anlagen. Postnatal kolonisering af B-og T-celler fører til rum med induktion af konventionelle stromale undergrupper.
Hvis dette skema er korrekt, følger det, at alle stromale undergrupper i voksne Slo ‘ er oprindeligt stammer fra LTO-celler. Har MRC ‘er, der bevarer egenskaberne ved LTo-celler, således evnen til at differentiere til FDC’ er eller FRC ‘ er? MRC ‘ er deler mange signaturer med andre undergrupper (figur 2a), hvilket tyder på, at dette er muligt. En spekulation er, at MRC ‘ er fungerer som stromale stamceller, der kontinuerligt leverer alle stromale undergrupper gennem voksenalderen. Selvom denne ide er spændende, vil den kræve forsigtig overvejelse og yderligere validering i fremtiden. Mesenkymceller er generelt meget fleksible i naturen afhængigt af det omgivende miljø, og dermed kan specifikke træk let ændres. Udvidet dyrkning af stromaceller isoleret fra LNs resulterer i tabt ekspression for mange gener, især homeostatiske kemokiner (Katakai et al., 2004a; Tomei et al., 2009). Dette antyder, at in vivo-fænotyperne af stromalcelleundergrupper opretholdes optimalt af vævsomstændighederne, som er reversible og ikke på grund af terminal differentiering. Derudover inducerer inflammatoriske stimuli den robuste proliferation af stromaceller og den dramatiske ombygning af SLOs (Katakai et al., 2004a; Chyou et al., 2011). Derfor, selvom MRC ‘er kunne konverteres til andre undergrupper, kan konventionelle stromale undergrupper også selvfornyes og være udskiftelige i voksne Slo’ er.
Remodeling af Slo ‘er og tertiære lymfoide strukturer
under immunresponser er stromale strukturer inden for Slo’ er dramatisk ombygget., 1997; Katakai et al., 2004a). Nogle infektioner forårsager en alvorlig forstyrrelse af vævsstrukturer i LNs og milthvidmasse inden for få dage, som gendannes, når patogenerne udryddes (Mueller et al., 2007a, b; Scandella et al., 2008; Johannes og Abraham, 2009). Denne restaureringsproces rekapitulerer sandsynligvis en selvorganiserende proces via en feedbackreaktion svarende til SLO-udvikling. Det er vigtigt, at LTi – lignende celler også er til stede i voksne væv og regulerer infektionsassocieret ombygning af Slo ‘ er (Kim et al., 2003; Scandella et al., 2008). Selvom MRC ‘ernes rolle i sådanne processer er ukendt, har de muligvis en organisationsrolle i samarbejde med LTi-lignende celler og bestemmer den ydre ramme af Slo’ er under rekonstruktion.
Ved kronisk betændelse forbundet med forskellige organpatologier fører et stort antal infiltrerende lymfocytter ofte til organisationer, der ligner Slo ‘ er, kendt som tertiære lymfoide væv (Tlts; Drayton et al., 2006). B-og T-celler er adskilt, og tilsvarende netværk af stromalcelleundersæt induceres. Det ville være interessant at afgøre, om MRC ‘er er til stede i disse ektopiske lymfoide strukturer; imidlertid observeres MRC-lignende celler og relaterede vævsstrukturer ikke i TLT’ er, der udviklede sig under musens autoimmune gastritis (Katakai et al., 2006, 2008). Det skal understreges, at TLT ‘ er grundlæggende ikke er programmerede lymfoide organisationer og naturligvis ikke forbinder med de antigentransporterende strukturer. Derfor er MRC ‘er sandsynligvis fraværende i TLT’ er. Selvom stromaceller, der er fænotypisk ligner MRC ‘er, kan induceres i nogle læsioner, ville de ikke blive identificeret som MRC’ er, medmindre de er tæt forbundet med den specifikke endotel-eller epitelstruktur og danner et lagdelt retikulum ved de ydre follikler.
konklusion
marginale retikulære celler er en unik stromalcelleundersæt, der er fælles for Slo ‘ er. MRC ‘ er er klart forskellige fra konventionelle undergrupper, der induceres eller modnes gennem interaktioner med lymfocytter efter fødslen, og er direkte afledt af LTo-stromaceller i anlagen og uafhængig af lymfocytter. Netværket af MRC ‘er er tæt forbundet med det antigentransporterende apparat i slo’ er og menes direkte eller indirekte at kontrollere antigenafgivelse til lymfocytrum såvel som lokalisering og migration af immunceller. MRC ‘ er spiller sandsynligvis centrale roller i opretholdelse af SLO-strukturer som den ydre ramme og kan konverteres til andre stromale undergrupper ved steady state eller under vævsomdannelse. Det vil være vigtigt at kollektivt overveje alle stromale undergrupper, vævsstrukturer og immunologiske mikromiljøer for at forstå SLO-systemet grundigt.
interessekonflikt Erklæring
forfatteren erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
dette arbejde blev delvist støttet af Grant-in-Aid til ung videnskabsmand og til videnskabelig forskning på Innovative områder fra Japans ministerium for Uddannelse, Kultur, Sport, Videnskab og teknologi.
Baj Larsnoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. Og Germain, R. N. (2006). Stromalcellenetværk regulerer lymfocytindtræden, migration og territorialitet i lymfeknuder. Immunitet 25, 989-1001.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Baj Larsnoff, M., Og Germain, R. N. (2009). B-celle follikeludvikling ombygger ledningssystemet og tillader opløselig antigenafgivelse til follikulære dendritiske celler. Blod 114, 4989-4997.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Balogh, P., Bal P., M., K. P. P., T., V., D. S., Arnold, H. H. og V., F. (2007). Forskellige roller lymfotoksin-beta signalering og homeodomain transkriptionsfaktor Nkh2.3 i ontogeni af endotel rum i milten. Cellevæv Res. 328, 473-486.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
b P. L., C., Hvid, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., varer, C. F., Anderson, G., og Caama Larvo, J. H. (2010). Ontogeni af stromale arrangørceller under lymfeknudeudvikling. J. Immunol. 184, 4521–4530.
Pubmed Abstract/Pubmed Fuld tekst
Braun, A., ord, T., Moschovakis, G. L., Halle, S., Hoffmann, K., B. L., J., M. L., A. og F. L. (2011). Afferente lymfeafledte T-celler og DC ‘ er bruger forskellige kemokinreceptor CCR7-afhængige ruter til indrejse i lymfeknude og intranodal migration. Nat. Immunol. 12, 879–887.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Carrasco, Y. R. og Batista, F. D. (2007). B-celler erhverver partikelformet antigen i et makrofagrige område ved grænsen mellem follikel og lymfeknudeens subkapsulære sinus. Immunitet 27, 160-171.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. og Lu, T. T. (2011). Koordineret regulering af lymfeknude vaskulær-stromal vækst først af CD11c + celler og derefter af T-og B-celler. J. Immunol. 187, 5558–5567.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Vard, A. E., Jansen, Jackson, D. G., Kraal, G. og Mebius, R. E. (2004a). Formodede lymfeknudearrangører er differentielt repræsenteret ved udvikling af mesenteriske og perifere knuder. J. Immunol. 173, 2968–2975.
Pubmed Abstract/Pubmed Fuld tekst
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, Greuter, M. J., De Malefyt, R., Kraal, G., Cyster, J. G. og Mebius, R. E. (2004b). Initiering af cellulær organisation i lymfeknuder reguleres af ikke-b-celleafledte signaler og er ikke afhængig af kemokinligand 13. J. Immunol. 173, 4889–4896.
Pubmed abstrakt/Pubmed Fuld tekst
Cyster, J. G. (1999). Kemokiner og cellemigration i sekundære lymfoide organer. Videnskab 286, 2098-2102.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A. og Ngo, V. N. (2000). Follikulære stromaceller og lymfocyt homing til follikler. Immunol. Åb 176: 181-193.
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst
Dougall, C. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., M. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J. og Schuh, J. (1999). Rang er afgørende for osteoklast og lymfeknude udvikling. Gener Dev. 13, 2412–2424.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Drayton, D. L., Liao, S., Mounter, R. H. og Ruddle, N. H. (2006). Lymfoid organudvikling: fra ontogeni til neogenese. Nat. Immunol. 7, 344–353.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y. og Littman, D. R. (2004). En væsentlig funktion for den nukleare receptor RORy(t) i dannelsen af føtale lymfoide vævsinducerceller. Nat. Immunol. 5, 64–73.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M. Og Kraehebuhl, J. (2002). CD4 + CD3-celler inducerer Peyers patchudvikling: rolle for aktivering af L. 4.1-integrin ved hjælp af C. C. 5. Immunitet 17, 363-373.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, ms, Collier, A. R., Boyd, R. L. og Turley, S. J. (2010). Lymfeknude fibroblastiske retikulære celler præsenterer direkte perifert vævsantigen under steady-state og inflammatoriske tilstande. J. Eksp. Middelhavs. 207, 689–697.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Grett, J. E., Anderson, A. O., S. (1997). Ledninger, kanaler, korridorer og ledninger: kritiske arkitektoniske elementer, der letter celleinteraktioner i lymfeknudebarken. Immunol. Åb 156, 11-24.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Grett, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E. og Shav, S. (2000). Lymfebårne kemokiner og andre molekyler med lav molekylvægt når høje endotelvenuler via specialiserede ledninger, mens en funktionel barriere begrænser adgangen til lymfocytmikromiljøet i lymfeknudebarken. J. Eksp. Middelhavs. 192, 1425–1440.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Honda, K., Nakano, H., Yoshida, H., Nishikova, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., S.-I. (2001). Molekylært grundlag for hæmatopoietisk/mesenkymal interaktion under initiering af Peyers plasterorganogenese. J. Eksp. Middelhavs. 193, 621–630.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Huber, C., Thielen, C., Seeger, H., Montrasio, F., Vilson, M. R., Heinen, E., Fu, Y. J., Miele, G. og Agusi, A. (2005). Lymfotoksin-lutreceptorafhængige gener i lymfeknude-og follikulære dendritiske celletranskriptomer. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Fuld tekst
Kaldjian, E. P., Gretse, J. E., Anderson, A. O., Shi, Y. og Shav, S. (2001). Rumlig og molekylær organisering af lymfeknude T-cellebark: et labyrintisk hulrum afgrænset af et epitellignende monolag af fibroblastiske retikulære celler forankret til kældermembranlignende ekstracellulær matrice. Int. Immunol. 13, 1243–1253.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Katakai, T., Hara, T., Sugai, M., Gonda, H. og Shimisu, A. (2004a). Lymfeknude fibroblastiske retikulære celler konstruerer det stromale retikulum via kontakt med lymfocytter. J. Eksp. Middelhavs. 200, 783–795.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M. Og Shimisu, A. (2004b). En ny retikulær stromal struktur i lymfeknudebarken: en immunplatform for interaktioner mellem dendritiske celler, T-celler og B-celler. Int. Immunol. 16, 1133–1142.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Katakai, T., Nomura, T., Gonda, H., Sugai, M.(2006). Spontan storstilet lymfoid neogenese og afbalanceret autoimmunitet versus tolerance i maven af H+ / K + – ATPase-reaktiv TCR transgen mus. J. Immunol. 177, 7858–7867.
Pubmed abstrakt/Pubmed Fuld tekst
Katakai, T., Suto, H., Sugai, M., Gonda, H., Toga, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T. og Shimisu, A. (2008). Arrangørlignende retikulært stromalcellelag, der er fælles for voksne sekundære lymfoide organer. J. Immunol. 181, 6189–6200.
Pubmed abstrakt/Pubmed Fuld tekst
Kim, M. Y., Gaspal, F. M., McConnell, F. M., Gulbranson-dommer, A., Raykundalia, C., rollator, L. S., Goodall, M. D. og Lane, P. J. (2003). CD4 + CD3-tilbehørsceller costimulerer primede CD4 T-celler gennem OKS40 og CD30 på steder, hvor T-celler samarbejder med B-celler. Immunitet 18, 643-654.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H. og Vilhelm, I. R. (2009). RANKL er nødvendig og tilstrækkelig til at initiere udvikling af antigen-prøveudtagning M-celler i tarmepitelet. J. Immunol. 183, 5738–5747.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Koike, R., Nishimura, T., Yasumisu, R., Tanaka, H., Hataba, Y., Hataba, Y., Vandabe, T., Miyasaka, S. og Miyasaka, M. (1996). Miltens marginalområde er fraværende i alymphoplastiske Aly mutante mus. EUR. J. Immunol. 26, 669–675.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L. I 1999 blev der foretaget en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, om der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse af, hvorvidt der var tale om en undersøgelse. AFGL er en vigtig regulator for osteoklastogenese, lymfocytudvikling og lymfeknudeorganogenese. Natur 397, 315-323.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Kraehebuhl, J. P. og Neutra, M. R. (2000). Epiteliale m-celler: differentiering og funktion. Annu. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., hint, B., Cyster, J. G. og Luther, S. A. (2007). Fibroblastiske retikulære celler i lymfeknuder regulerer homeostasen af naive T-celler. Nat. Immunol. 8, 1255–1265.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R. og Turley, S. J. (2011). Reguleret frigivelse af salpetersyre ved ikke-hæmatopoietisk stroma styrer udvidelsen af den aktiverede T-cellepulje i lymfeknuder. Nat. Immunol. 12, 1096–1104.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G. og Cyster, J. G. (2000). Coekspression af kemokinerne ELC og SLC af T-stromaceller og deletion af ELC-genet i PLT/plt-musen. Proc. Natl. Acad. Sci. USA 97, 12694-12699.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Luther, S. A., Ansel, K. M., og Cyster, J. G. (2003). Overlappende roller af CKSCL13, interleukin 7-receptor-og CCR7-ligander i lymfeknudeudvikling. J. Eksp. Middelhavs. 197, 1191–1198.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Mackay, C. R. (2001). Kemokiner: immunologiens høje påvirkningsfaktorer. Nat. Immunol. 2, 95–101.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B. Carroll, M. C., Mooney, D. J., Turley, S. J. og Immunological Genome Project Consortium. (2012). Transkriptionel profilering af stroma fra betændte og hvilende lymfeknuder definerer immunologiske kendetegn. Nat. Immunol. 13, 499–510.
Pubmed abstrakt / Pubmed Fuld tekst/CrossRef Fuld tekst
Mebius, R. E., Rennert, P., I. L. (1997). Udvikling af lymfeknuder samler CD4 + CD3-lt LARP + celler, der kan differentiere til APC, NK-celler og follikulære celler, men ikke T-eller B-celler. Immunitet 7, 493-504.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Mebius, R. E. (2003). Organogenese af lymfoide væv. Nat. Rev. Immunol. 3, 292–303.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Mueller, S. N., K. A., Koniecny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R. og Matloubian, M. (2007a). Regulering af homeostatisk kemokinekspression og cellehandel under immunresponser. Videnskab 317, 670-674.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P. og Ahmed, R. (2007b). Viral målretning af fibroblastiske retikulære celler bidrager til immunsuppression og persistens under kronisk infektion. Proc. Natl. Acad. Sci. U. S. A. 104, 15430-15435.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Mueller, S. N. Og Germain, R. N. (2009). Stromal celle bidrager til homeostase og funktionalitet af immunsystemet. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
m Pritller, G., H Pripken, U. E. og Lipp, M. (2003). Virkningen af CCR7 og CKSCR5 på udvikling af lymfoide organer og systemisk immunitet. Immunol. Åb 195, 117-135.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Nolte, M. A., Beli Kurt, J. A., Schadee-Estermans, I., Jansen, Unger, U. V., van Rooijen, N., Kraal, G. og Mebius, R. E. (2003). Et ledningssystem distribuerer kemokiner og små blodbårne molekyler gennem den milt hvide papirmasse. J. Eksp. Middelhavs. 198, 505–512.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Ohl, L., Henning, G., Krautvald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., og F Prster, R. (2003). Samarbejdsmekanismer for CKSCR5 og CCR7 i udvikling og organisering af sekundære lymfoide organer. J. Eksp. Middelhavs. 197, 1199–1204.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Palframan, R. T., Jung, S., Cheng, G., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., H., Rot, A. Og von Andrian, U. H. (2001). Inflammatorisk kemokintransport og præsentation i HEV: en fjernbetjeningsmekanisme til monocytrekruttering til lymfeknuder i betændt væv. J. Eksp. Middelhavs. 194, 1361–1373.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Phan, T. G., grøn, J. A., grå, E. E., Hu, Y. og Cyster, J. G. (2009). Immunkompleks relæ ved subkapsulære sinusmakrofager og ikke-genkendte B-celler driver modning af antistofaffinitet. Nat. Immunol. 10, 786–793.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Roosendaal, R., Mempel, T. R. Verschoor, A., Mebius, R. E., von Andrian, U. H. og Carroll, M. C. (2009). Ledninger medierer transport af antigen med lav molekylvægt til lymfeknudefollikler. Immunitet 30, 264-276.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Roosendaal, R., Og Mebius, R. E. (2011). Stromal celle-immuncelleinteraktioner. Annu. Rev. Immunol. 29, 23–43.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T. og Ludvig, B. (2008). Restaurering af lymfoid organintegritet gennem interaktion mellem lymfoide vævsinducerceller med stroma i T-celleområdet. Nat. Immunol. 9, 667–675.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
altid, M., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Luts, M. B. Og Sorokin, L. (2005). Ledningssystemet transporterer opløselige antigener fra den afferente lymfe til residente dendritiske celler i lymfeknudens t-celleområde. Immunitet 22, 19-29.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Steinman, R. M., Pack, M. Og Inaba, K. (1997). Dendritiske celler i T-celleområderne i lymfoide organer. Immunol. Åb 156, 25-37.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
St John, A. L. Og Abraham, S. N. (2009). Salmonella forstyrrer lymfeknude arkitektur ved TLR4-medieret undertrykkelse af homeostatiske kemokiner. Nat. Middelhavs. 15, 1259–1265.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Susuki, K., Maruya, M., Sitnik, K., Kitamura, H., Agace, H. V. og Fagarasan, S. (2010). Sensing af miljømæssige stimuli af follikulære dendritiske celler fremmer immunglobulin en generation i tarmen. Immunitet 33, 71-83.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Sabo, M. C., Butcher, E. C. og McEvoy, L. M. (1997). Specialisering af slimhindefollikulære dendritiske celler afsløret ved slimhindeadressin – celleadhæsionsmolekyle-1 display. J. Immunol. 158, 5584–5588.
Pubmed Abstract/Pubmed Fuld tekst
PubMed Abstract / Pubmed Fuld tekst
(1983). Transport af immunkomplekser fra den subkapsulære sinus til lymfeknudefollikler på overfladen af nonphagocytiske celler, herunder celler med dendritisk morfologi. J. Immunol. 131, 1714–1727.
Pubmed abstrakt/Pubmed Fuld tekst
Taylor, P. R., Martinus-Pomares, L., Stacey, M., Lin, H. H., brun, G. D. og Gordon, S. (2005). Makrofagreceptorer og immungenkendelse. Annu. Rev. Immunol. 23, 901–944.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
PubMed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
PubMed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
(1997). Follikulære dendritiske celler og præsentation af antigen og costimulerende signaler til B-celler. Immunol. Åb 156, 39-52.
Pubmed Abstract / Pubmed Fuld tekst / CrossRef Fuld tekst
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A. og M. A. (2009). Væskestrøm regulerer stromalcelleorganisation og ccl21-ekspression i et vævskonstrueret lymfeknude-mikromiljø. J. Immunol. 183, 4273–4283.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F. K. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, Randall, T. D., De Jonge, J. J. og Mebius, R. E. (2009). Chemokin CKSCL13 er afgørende for lymfeknude initiering og induceres af retinsyre og neuronal stimulering. Nat. Immunol. 10, 1193–1199.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Natarajan, D., Barlav, A., Pachnis, V. og Kioussis, D. (2007). Tyrosinkinasereceptor RET er en nøgleregulator for Peyers patchorganogenese. Natur 446, 547-551.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Victoratos, P., Lagnel, J., Tsima, S., Alimjanov, M. B., Rajevsky, K., Pasparakis, M. Og Kollias, G. (2006). FDC-specifikke funktioner af p55TNFR og IKK2 i udviklingen af FDC-netværk og antistofresponser. Immunitet 24, 65-77.
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
PubMed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
PubMed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
, Schreiber, R. D. og Chaplin, D. D. (2009). Lymfotoksin Lta1 LR2 kontrollerer postnatal og voksen milt marginal sinus vaskulær struktur og funktion. Immunitet 30, 408-420.
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst