Kardiomyopati hos patienter med Marfan syndrom og marfanoid habitus
Ekaterina Luneva MD,PhD*, Eduard Malev MD,PhD1,2, Aleksandra Korshunova MD1,2, Svetlana Reeva MD,PhD1,2, Eugeniy Timofeev MD, PhD1,2 og Eduard Semtsovsky Prof, MD, PhD1,2 1 Afdeling for bindevævsforstyrrelse, Aleksandra nordvest Federal Medical Research Center, Sankt Petersborg, Rusland
2 Afdeling for bindevævsforstyrrelse, MD af propaedeutik af interne sygdomme, State Pediatric Medical University, Sankt Petersborg,Rusland
*korrespondance:Ekaterina LUNEVA,MD,PhD,Almasov nordvestlige føderale medicinske forskningscenter, 2 Akkuratova str., Sankt Petersborg,197341,Rusland,Tel: +7-8127023749, Faks: +7-8127023744, E-Mail:
Modtaget dato: 29.December 2016 / accepteret dato: 17. Marts 2017 / offentliggjort dato: 20. marts 2017
Citat: Lunev E, Malev E, Korshunova a, et al. Kardiomyopati hos patienter med Marfan syndrom og marfanoid habitus. Curr Res Cardiol 2017; 4 (1): 138-42.
denne open-access-artikel distribueres under betingelserne i Creative Commons Attribution Non-Commercial License (CC BY-NC) (http://creativecommons.org/licenses/by-nc/4.0/), som tillader genbrug, distribution og reproduktion af artiklen, forudsat at det originale værk er korrekt citeret, og genbrug er begrænset til ikke-kommercielle formål. Til kommerciel genbrug, kontakt
abstrakt
mål: udtrykket “Marfan kardiomyopati” bruges til at indikere ændringer i venstre ventrikulær funktion i fravær af signifikant valvulær patologi i Marfan syndrom. Det er stadig ukendt, om der er ændringer i hjertefunktionen hos patienter med lignende bindevævsabnormalitet, såsom marfanoid habitus.
metoder: i undersøgelsen blev inkluderet 98 personer – 8 patienter med Marfan syndrom, 24 med marfanoid habitus og 66 raske forsøgspersoner. Ekkokardiografi blev udført til alle patienter. Speckle tracking ekkokardiografi blev brugt til at vurdere de venstre ventrikulære deformationsindekser. Koncentrationerne af den transformerende vækstfaktor-L. 1 og-L. 2 i serum blev bestemt ved immunosorbentassay.
resultater: systolisk venstre ventrikelfunktion var signifikant lavere i Marfan-syndromgruppen; såvel global langsgående forværring af venstre ventrikulær stamme blev påvist i MS-gruppe sammenlignet med kontrolgruppe. Hos marfanoid habitus-forsøgspersoner fandt vi signifikant fald i den perifere belastning i interventrikulær septum og ringere væg. transformerende vækstfaktor-karr1 og-karr2 serumniveauer blev forhøjet hos patienter med Marfan syndrom. Forhøjelse af transformerende vækstfaktor-kurt1 var statistisk ubetydelig i modsætning til transformerende vækstfaktor-kurt2 i marfanoid habitus-gruppen. Der er også fundet Negative korrelationer mellem serumniveauet for transformerende vækstfaktor-kurt2 og systolisk radial stamme i marfanoid habitus-gruppen.
konklusion: Forværring af regional myokardisk deformation kan være det første tegn på forringelse af venstre ventrikulær systolisk funktion og eksistensen af primær kardiomyopati hos asymptomatiske marfanoid habitus-patienter, hvilket kan påvirke deres langsigtede prognose og kan være forårsaget af øget transformerende vækstfaktor-kurssignalering.
nøgleord
Marfan syndrom; Marfanoid habitus; kardiomyopati; Leftventrikulær systolisk funktion; myokardisk deformation; transformerende vækstfaktor-kar
MS er en af de mest almindelige arvelige lidelser i bindevæv.I området for MS-komplikationer er aortaaneurisme, mitralvalve prolapses og myocardial dysfunktion (1). MS manifestationer forårsagedeved mutationer af fibrillin-1,en strukturel komponent af ekstracellulær Matrice, og også krænkelse af reguleringen af transformerende vækstfaktor-kur. En række undersøgelser (2,3) viste, at overdreven aktivering af TGF-kurs signalvej er hovedårsagen til nedsat LV-funktion og aortapatologi hos MS. Forværring af systolisk og diastolisk funktion ogUdvidelse af LV dimensioner blev fundet hos patienter med MS uansetfraværet af hæmodynamisk overbelastning på grund af mitral eller aorta regurgitationi tilstedeværelse af mitralventil prolaps eller aorta dilatation. Udtrykket “Marfancardiomyopati” bruges til at indikere ændringer i venstre ventrikulær funktion ifraværet af signifikant valvulær patologi i MS (4,5). På trods af atkardiomyopati i MS er godt undersøgt det er stadig ukendt, om der er ændringeri hjertefunktionen hos patienter med lignende bindevæv abnormitetsåsom marfanoid habitus. marfanoid habitus omfatter arachnodactyly, langhænder og fødder, øget hudstrækning, fælles hypermobilitet og ændringer i pektusens fysiologi (tabel 1).
| målbare skelettegn | andre funktioner i marfanoid habitus |
|---|---|
| arm span til højdeforhold > 1.03 | skoliose af > 5 grader |
| Håndlængde til højdeforhold > 11% | Pectus deformiteter (gravatum eller carinatum) |
| fodlængde til højdeforhold > 15% | kæbedeformiteter med overfyldning af tænder |
| overkropssegment til underkropssegmentforhold < 0.89 | høj buet gane |
| lange fødder (ofte med hammertæer), der fladder og udtaler på vægtbærende |
tabel 1: marfanoid habitus kriterier
marfanoid funktioner er til stede i flere arvelige lidelser i forbindelsevæv, efterligner nogle af ændringerne af Marfan syndrom, men ikkeledsaget af luksus af linsen og aneurisme af aorta. Ufuldstændige formeraf marfanoid habitus er almindelige og sandsynligvis godartede; deres tilstedeværelse bør dog udløse en vurdering af et andet træk ved arveligtlidelser i bindevæv (6).
i dette papir vurderede vi de morfologiske og funktionelle egenskaberaf LV hos patienter med MS og marfanoid habitus.
materialer og metoder
i undersøgelsen blev inkluderet 98 personer, 8 af dem var patienter med MS, 24patienter med marfanoid habitus og 66 raske forsøgspersoner.
patienter med MS var under regelmæssig opfølgning på Federal Center.Diagnosen MS blev stillet under anvendelse af Gent-kriterier (7). Mutationer offibrillin – 1 screenede ikke for denne undersøgelse. Patienterne havde ikke signifikant (mereend mild) mitral eller aorta regurgitation. Personer med marfanoid habitus blev screenet ud af patienter med ikke-bekræftet MS og har ingen tegn påaortisk aneurisme og linsesubluksation. Tabel 1 repræsenterer marfanoid habituscriteria ifølge Grahame R, et al. (6). Kontrolgruppen bestod afsunde studerende på Pediatric Medical University.
ekkokardiografi blev udført hos alle patienter af en erfarnekkokardiograf ved hjælp af et Vivid 7 ultralydsystem (GE Healthcare),udstyret med en harmonisk 3,5 HS phased-array transducer og inkluderetvurdering af hjertekamre dimensioner og systolisk funktion af Lvmålt af Simpson biplan regel. Standard 2-dimensionelle transthoracicekokardiografiske optagelser blev brugt til at vurdere venstre ventrikulær som LV enddiastolicdiameter, at vurdere højre ventrikel som højre ventrikel end-diastolicdiameter, til venstre atria brugte vi venstre artia diameter i henhold til currentguideline (8). Derudover brugte vi speckle tracking ekkokardiografiat vurdere venstre ventrikulære deformationsindekser (stamme og belastningshastighed) (9). Den langsgående stamme opnås fra apikale 4 -, 3-og 2-kammerbilleder. Radiale og perifere stammer blev opnået fra LV shortaksisbilleder på niveauet af mitralventilen, papillære muskler og spids.Billedanalyse blev udført offline på en EchoPAC ‘ 08 arbejdsstation(GE Healthcare). LV blev opdelt i 18 segmenter. Strain rate blev bestemt som den maksimale negative værdi i udkastningsfasen.Peak systolisk stamme blev defineret som størrelsen af stammen ved aorticventilens lukning. Den maksimale langsgående tidlige diastoliske påfyldningsstamme varogså målt.
Vi vurderer biologisk aktive transformerende vækstfaktor-proteinkoncentrationer af proteinkoncentrationer fra EDTA-blodprøver ved hjælp af standardprocedurer immunosorbentassays ved hjælp af det humane Platinum ELISAtest-system (Bender medsystemarfan syndrome Diagnostics GmbH, Vienna,Østrig). Variationerne mellem analyser og intra analyser var henholdsvis 8% og 6%. Følsomheden var 5 pg / ml.
statistisk analyse
alle data præsenteres som gennemsnitlig standardafvigelse. Betydningen afforskelle mellem kvantitative træk blev bestemt ved hjælp af studerendes t-test,mellem små prøver og kvalitative egenskaber bestemt ved hjælp af ikke-parametriske metoder: Fishers nøjagtige test eller chi-firkantet test (p<0.05). Forholdet mellem par af kontinuerlige variabler blev udtrykt vedpearson korrelation. Effektstørrelser for deformationsindekser blev måltaf Cohens d ved hjælp af midler og standardafvigelser. Statistisk signifikansblev sat til p <0.05. Alle statistiske analyser blev udført ved hjælp af Statistica 10soft (StatSoft, Inc.).
resultater
karakteristika for patienter inkluderet i undersøgelsen er vist i tabel 2.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| Sex, female/male | 0/8 | Jan-23 | 42/24 | (1-2) р=0.55 |
| (1-3) р=0.0006 | ||||
| (2-3) р=0.00001 | ||||
| Age, years | 28 ± 9.2 | 22 ± 3.4 | 20 ± 1.8 | (1-2) 0.01 |
| (1-3) 0.0001 | ||||
| (2-3) 0.0005 | ||||
| højde, m | 186 ± 12 | 181 ± 9.1 | 170 ± 8.4 | (1-2) 0, 22 |
| (1-3) 0, 00001 | ||||
| (2-3) 0, 00001 | ||||
| Vægt, kg | 71 ± 26 | 62 ± 9.7 | 61 ± 9.5 | (1-2) 0, 16 |
| (1-3) 0, 03 | ||||
| (2-3) 0.66 | ||||
| Marfan syndrom kriterier | ||||
| Aortadiameter ved bihulerne af Valsalva over å-score 2 eller aorta roddissektion, n ( % ) | 5 (63%) | 0 (0%) | 0 (0%) | (1-2) 0, 008 |
| (1-3) 0, 008 | ||||
| (2-3) 1, 0 | ||||
| Ectopia lentis, n ( % ) | 3 (38%) | 0 (0%) | 0 (0%) | (1-2) 0, 065 |
| (1-3) 0, 065 | ||||
| (2-3) 1.0 | ||||
| Scoring af systemiske træk ved Marfan syndromet | ||||
| håndled og tommelfinger tegn, n ( % ) | 4 (50%) | 8 (33%) | 0 (0%) | (1-2) 0.41 |
| (1-3) 0.025 | ||||
| (2-3) 0.002 | ||||
| håndled eller tommelfinger tegn, n ( % ) | 7 (88%) | 16 (67%) | 0 (0%) | (1-2) 0, 38 |
| (1-3) 0, 002 | ||||
| (2-3) <0.00001 | ||||
| Pectus carinatum deformity, n (%) | 7 (88%) | 3 (13%) | 0 (0%) | (1-2) 0.18 |
| (1-3) 0.0003 | ||||
| (2-3) <0.00001 | ||||
| Pectus excavatum or chest asymmetry, n (%) | 4 (50%) | 16 (67%) | 0 (0%) | (1-2) 0.41 |
| (1-3) 0.025 | ||||
| (2-3) <0.00001 | ||||
| Hindfoot deformity or plain pes planus, n (%) | 5 (63%) | 18 (75%) | 7 (11%) | (1-2) 0.5296 |
| (1-3) 0.0166 | ||||
| (2-3) <0.00001 | ||||
| Pneumothorax, n (%) | 0(0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 0.27 | ||||
| Dural ectasia, n ( % ) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Protrusio acetabuli, n ( % ) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1. 0 | ||||
| (2-3) 1.0 | ||||
| reduceret US / LS og øget arm / højde og ingen svær skoliose, n ( % ) * | 2 (25%) | 0 (0%) | 0 (0%) | (1-2) 0, 15 |
| (1-3) 0, 15 | ||||
| (2-3) 1, 0 | ||||
| skoliose eller thoracolumbar kyphosis, n ( % ) | 7 (88%) | 23 (96%) | 20 (30%) | (1-2) 0, 54 |
| (1-3) 0, 016 | ||||
| (2-3) <0.00001 | ||||
| Reduced elbow extension, n (%) | 1(13%) | 0 (0%) | 0 (0%) | (1-2) 1,0 |
| (1-3) 1,0 | ||||
| (2-3) 1.0 | ||||
| Facial features (3/5)**, n (%) | 6 (75%) | 1 (4%) | 0 (0%) | (1-2) 0.15 |
| (1-3) 0.0018 | ||||
| (2-3) 1.0 | ||||
| Skin striae, n (%) | 0 (0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Myopia > 3 diopters, n (%) | 4 (50%) | 10 (42%) | 8 (12%) | (1-2) 0.69 |
| (1-3) 0.066 | ||||
| (2-3) 0.011 | ||||
| Mitral vaLVe prolapse (all types), n (%) | 2 (25%) | 8 (33%) | 0 (0%) | (1-2) 0.65 |
| (1-3) 0.15 | ||||
| (2-3) 0.002 | ||||
| Systemic features score, points | 8,1 ± 1,2 | 5,4 ± 1,6 | 2,1 ± 0,5 | (1-2) 0.0002 |
| (1-3) <0.00001 | ||||
| (2-3) <0.00001 | ||||
| marfanoid habitus kriterier*** | ||||
| Skeletal tegn på marfanoid habitus | 5 (63%) | 19 (79%) | 5 (8%) | (1-2) 0.41 |
| (1-3) n/a | ||||
| (2-3) <0.00001 | ||||
| Kæbedeformiteter med overbelægning af tænder | 5 (63%) | 14 (58%) | 16 (24%) | (1-2) 0, 84 |
| (1-3) 0, 07 | ||||
| (2-3) 0.005 | ||||
| høj buet gane | 7 (88%) | 12 (50%) | 8 (12%) | (1-2) 0, 028 |
| (1-3) 0, 0004 | ||||
tabel 2: karakteristika for patienter inkluderet i undersøgelsen
i grupper med MS og marfanoid habitus var mænd dominerende.Patienter med MS var ældre end dem med marfanoid habitus ogindivider fra kontrolgruppen. Patienter med MS var højere endandre. Systemiske træk blev signifikant ofte fundet hos patienter medms, der sammenligner med marfanoid habitus. Systemiske egenskaber score tilladtskelne MS patient fra marfanoid habitus patienter. På den anden side blev der fundet kriterier for marfanoid habitus hos både MS-og marfanoidhabitus-patienter, men tillod separat marfanoid habitus fra sundindivider. Tilstedeværelsen af skelettegn i fravær af andre Ghentkriterier tillader således at verificere marfanoid habitus med høj følsomhed (79%)og specificitet (91%).
resultaterne af morfologisk og funktionel evaluering af hjertet varopsummeret i tabel 3.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| End-diastolic LV diameter, mm | 50.5 ± 4.6 | 46.7 ± 4.54 | 44.1 ± 4.94 | (1-2) 0.012 |
| (1-3) 0.0003 | ||||
| (2-3) 0.027 | ||||
| End-systolic LV diameter, mm | 34.8 ± 3.8 | 29.5 ± 4.9 | 28.4 ± 3.9 | (1-2) 0.005 |
| (1-3) 0.0014 | ||||
| (2-3) 0.33 | ||||
| End-diastolic LV volume, mm | 114.3 ± 12.6 | 98.7 ± 19.2 | 89.3 ± 19.2 | (1-2) 0.019 |
| (1-3) 0.0002 | ||||
| (2-3) 0.046 | ||||
| End-systolic LV volume, mm | 55.2 ± 14.0 | 33.9 ± 12.6 | 33.9 ± 8.9 | (1-2) 0.0028 |
| (1-3) 0.0026 | ||||
| (2-3) 1.0 | ||||
| Ejection fraction, % | 52.8 ± 8.9 | 66.4 ± 7.5 | 67 ± 5.3 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 0.48 | ||||
| Left ventricular mass index, g/m2 | 111.8 ± 31.5 | 78.5 ± 18.9 | 83.7 ± 15.9 | (1-2) 0.027 |
| (1-3) 0.033 | ||||
| (2-3) 0.23 | ||||
| E/A ratio | 1.50 de 0.47 | 1.53 ± 0.42 | 1.69 ± 0.4 | (1-2) 0,87 |
| (1-3) 0,10 | ||||
| (2-3) 0,48 | ||||
| slutdiastolisk diameter af højre ventrikel, lp | 31 ± 7.2 | 23 ± 4.26 | 24 ± 3.13 | (1-2) 0.0006 |
| (1-3) 0.00001 | ||||
| (2-3) 0.23 | ||||
| Diameter af venstre atrium, list | 37 ± 4.97 | 30 ± 3.98 | 30 til 2.99 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 1.0 | ||||
| Aortic diameter at the sinuses of Valsalva, mm | 43.1 ± 15.1 | 30.3 ± 4.5 | 24.0 ± 4.5 | (1-2) 0.0007 |
| (1-3) 0.00001 | ||||
| (2-3) 0.00001 | ||||
| Z-score | 6.86 ± 5.83 | 1.56 ± 0.93 | 1.59 ± 0.17 | (1-2) 0.039 |
| (1-3) 0.038 | ||||
| (2-3) 0.88 | ||||
| Mitral regurgitation grade, none/mild (%) | 0/8 (0/100%) | 6/18 (25/75%) | 24/42 (36/64%) | (1-2) 0.29 |
| (1-3) 0.047 | ||||
| (2-3) 0.44 |
Table 3: Ekkokardiografiske data i studiegrupper
der var ingen statistisk signifikant forskel i størrelse på højre ventrikel og venstre atrium hos unge patienter i kontrolgruppen, der sammenlignede med marfanoidhabitus-patienter, men forventeligt er disse dimensioner statistisk forskellige hos patienter i MS-gruppen. Imidlertid blev venstre ventrikulær forstørrelse fundet ikke kun hos patienter med MS, men også hos marfanoid habitus patienter sammenligningmed kontrolgruppe men det skal bemærkes, at dimensionerne af Lvvar normale i alle grupper af observation.
som forventet var systolisk LV-funktion signifikant lavere i MS-gruppen, men der var ingen statistisk signifikante forskelle i venstre ventrikulær Efmellem patienter med marfanoid habitus og kontrolgruppe. Der blev også påvist forværring af den globale langsgående venstre ventrikulære stamme i MS-gruppen (stamme: -15,7 liter 0,9% vs. -19,6 liter 3,4%, p=0,002; stammehastighed: -0,94 liter 0,09 s-1 vs. -1,22 liter 0,8 s-1, p=0,00001). På samme tid blev der ikke fundet ændringer i globallongitudinal, periferisk eller radial stamme/stammehastighed hos patienter med marfanoid habitus (Tabel 4).
| Walls | Strain / Strain rate | Marfanoid habitus (n=24) | Control group (n=66) | р (Student’s t-test) | |
| Anteroseptal | L | Strain, % | –17.8 ± 4.1 | –18.7 ± 3.4 | 0.34 |
| Strain rate, s-1 | –1.09 ± 0.21 | –1.13 ± 0.2 | 0.42 | ||
| C | Strain, % | –22.9 ± 6.48 | –26.6 ± 4.5 | 0.014 (Cohen’s d = 0.66) | |
| Strain rate, s-1 | –1.64 ± 0.51 | –1.68 ± 0.39 | 0.72 | ||
| R | Strain, % | 41.5 ± 16.6 | 40.7 ± 16.4 | 0.84 | |
| Strain rate, s-1 | 1.79 ± 0.62 | 1.60 ± 0.44 | 0.17 | ||
| Anterior | L | Strain, % | –20.0 ± 4.46 | –19.9 ± 3.3 | 0.92 |
| Strain rate, s-1 | –1.35 ± 0.46 | –1.23 ± 0.26 | 0.24 | ||
| C | Strain, % | –17.2 ± 6.15 | –19.4 ± 4.4 | 0.12 | |
| Strain rate, s-1 | –1.43 ± 0.43 | –1.48 ± 0.39 | 0.61 | ||
| R | Strain, % | 42.6 ± 15.9 | 42.6 ± 17.2 | 1 | |
| Strain rate, s-1 | 1.71 ± 0.60 | 1.66 ± 0.51 | 0.72 | ||
| Anterolateral | L | Strain, % | –18.6 ± 4.52 | –17.3 ± 4.2 | 0.23 |
| Strain rate, s-1 | –1.39 ± 0.35 | –1.24 ± 0.31 | 0.07 | ||
| C | Strain, % | –14.8 ± 5.79 | –15.0 ± 5.1 | 0.88 | |
| Strain rate, s-1 | –1.21 ± 0.43 | –1.28 ± 0.41 | 0.49 | ||
| R | Strain, % | 40.9 ± 14.6 | 43.3 ± 16.7 | 0.51 | |
| Strain rate, s-1 | 1.62 ± 0.63 | 1.63 ± 0.52 | 0.94 | ||
| Inferolateral | L | Strain, % | –19.5 ± 3.8 | –18.4 ± 4.1 | 0.24 |
| Strain rate, s-1 | –1.40 ± 0.32 | –1.28 ± 0.3 | 0.12 | ||
| C | Strain, % | –14.8 ± 6.43 | –16.3 ± 4.8 | 0.31 | |
| Strain rate, s-1 | –1.13 ± 0.46 | –1.21 ± 0.39 | 0.45 | ||
| R | Strain, % | 39.2 ± 14.0 | 42.3 ± 15.3 | 0.37 | |
| Strain rate, s-1 | 1.61 ± 0.53 | 1.64 ± 0.53 | 0.81 | ||
| Inferior | L | Strain, % | –20.6 ± 3.96 | –19.9 ± 3.5 | 0.45 |
| Strain rate, s-1 | –1.27 ± 0.24 | –1.22 ± 0.2 | 0.36 | ||
| C | Strain, % | –16.5 ± 5.73 | –19.8 ± 4.9 | 0.017 (Cohen’s d = 0.62) | |
| Strain rate, s-1 | –1.23 ± 0.38 | –1.28 ± 0.38 | 0.58 | ||
| R | Strain, % | 38.9 ± 11.0 | 41.5 ± 14.3 | 0.36 | |
| Strain rate, s-1 | 1.58 ± 0.47 | 1.57 ± 0.48 | 0.93 | ||
| Inferoseptal | L | Strain, % | –20.5 ± 4.24 | –20.7 ± 3.1 | 0.83 |
| Strain rate, s-1 | –1.20 ± 0.22 | –1.19 ± 0.19 | 0.85 | ||
| C | Strain, % | –22.0 ± 4.42 | –24.4 ± 4.5 | 0.028 (Cohen’s d = 0.53) | |
| Strain rate, s-1 | –1.42 ± 0.43 | –1.49 ± 0.43 | 0.49 | ||
| R | Strain, % | 38.7 ± 11.2 | 40.7 ± 14.6 | 0.49 | |
| Strain rate, s-1 | 1.65 ± 0.53 | 1.56 ± 0.44 | 0.46 | ||
| Global | L | Strain, % | –19.6 ± 3.49 | –19.6 ± 3.4 | 1 |
| Strain rate, s-1 | –1.25 ± 0.23 | –1.22 ± 0.18 | 0.57 | ||
| C | Strain, % | –18.7 ± 4.26 | –20.5 ± 3.7 | 0.08 | |
| Strain rate, s-1 | –1.35 ± 0.36 | –1.39 ± 0.29 | 0.63 | ||
| R | Strain, % | 41.3 ± 11.4 | 41.3 ± 10.9 | 1 | |
| Strain rate, s-1 | 1.67 ± 0.50 | 1.61 ± 0.37 | 0.59 | ||
Table 4: Global og lokal stamme-og belastningshastighed i marfanoid habitus og kontrolgrupper
for at afsløre subtile ændringer i LV-kontraktilitet hos marfanoid habitus-patienter speckle tracking-analysen blev brugt til at vurdere regional stamme af LV-væggene(Tabel 4). Vi fandt signifikant fald i den perifere (ellers tolangitudinal eller radial) stamme i interventricular septum og inferior vægin marfanoid habitus forsøgspersoner (Figur 1) sammenlignet med kontrolgruppe medmellemeffektstørrelser målt ved Cohens d (0,53 – 0,66). I andre LV væggeder blev ikke fundet nogen signifikant forskel. Diastolisk funktion blev bevaret i allestudiegrupper.

Figur 1: Lav omkredsen stamme i ringere væg (pil) i marfanoid habitus patienter
TGF-β1 og TGF-β2 serum niveauer er forhøjede hos patienter med marfanoidhabitus (14.2 ± 27.6 og 2,1 ± 1.7 ng/ml, henholdsvis), og på trods toconsiderable standardafvigelse vi fandt signifikant forskel med MS (44.6 ± 47.3 ng/ml, p=0.03 og 2,7 ± 1.7 ng/ml, p=0.39, henholdsvis), andcontrol (8.4 ± 3.5 ng/ml, p=0,09 og 1,2 liter 0,7 ng/ml, p=henholdsvis 0,0006)grupper (figur 2).
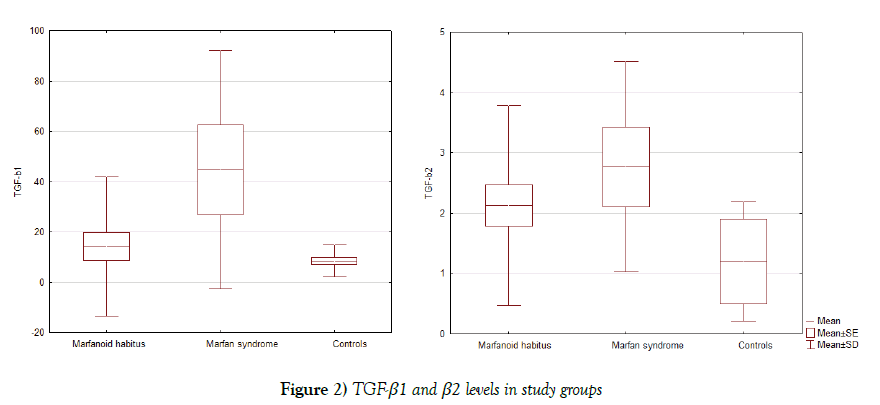
figur 2: TGF-kristi1 og kristi2 niveauer i studiegrupper
et højt TGF-kristi1 serumniveau (14,75 ng/ml) blev detekteret i halvdelen afgruppe og TGF-kur2 (> 2,0 ng/ml) hos Majoritetspatienter (75%) af MS-gruppen.I marfanoid habitus-gruppen fandt vi et højt TGF-kurt1-serumniveau hos 4 (17%)patienter og TGF-kurt2 hos 9 (38%) patienter, der er mere end i kontrol group.In kontrolgruppe der var ingen personer med forhøjede niveauer af TGF-kr1og kun 2 personer med højt TGF-kr2 niveau.
Derudover har vi identificeret de negative korrelationer mellem serumniveauet af transformerende vækstfaktor-lut2 og systolisk radial stamme (r=0,53, p=0,012) i marfanoid habitus-gruppen. Der var ingen korrelation mellemgf-LARP niveau og aorta dimensioner hos patienter med MS og marfanoidhabitus; men der blev fundet korrelation mellem TGF-Kurt niveau og skeletfunktioneraf marfanoid habitus – TGF-kurt2 med fodlængde-til-højde-forhold (r=0,47,p=0,03), TGF-kurt1 med skoliose (r=0,72, p=0,0001). TGF-krish1 serumniveauogså svagt korreleret med slutdiastolisk volumen (r=0,42, p=0,04) og lvmyokardiel masse (r=0,44, p=0,036).
Diskussion
sænkning af LV global kontraktilitet hos patienter med MS er blevet beskrevettidligere i flere undersøgelser (4,5). I vores undersøgelse fandt vi også forringelse af LV global kontraktilitet og deformation i normale LV dimensioner indlagte patienter med MS. Hos patienter med marfanoid habitus LV systolisk funktionblev bevaret og kun fald i den perifere (ellers tillangsgående eller radiale) stamme i interventrikulær septum og ringere vægblev fundet.
marfanoid habitus er et vigtigt fælles træk i en rækkegenetisk arvelige lidelser i bindevævssyndromer og er ikke pathognomonic af MS (6). Nuværende Gent-og marfanoid habitus-kriterier (6,7) gør det muligt at skelne MS-patient fra marfanoid habitus-patienter ivores undersøgelse med høj følsomhed og specificitet. Den vigtigste konklusion i denne undersøgelse var, at den tidlige kontraktile skade, der blev set hos marfanoidhabituspatienter med normal global kontraktil funktion, er regionalt fordelt i LV-septum og ringere væg. Så vidt vi ved, er dette det første rapporterede fund af et sådant regionalt kontraktilt mønster demonstrerethos patienter med marfanoid habitus. Flere undersøgelser viste regionalkontraktil dysfunktion i andre arvelige lidelser i bindevæv som mitralventil prolaps (10,11). I nogle genetiske sygdomme, såsom Friedreichsataksi, Fabry sygdom eller Duchenne kardiomyopati, forekommer de første regionaldeformationsændringer også i det inferolaterale segment (12).
i øjeblikket er der data, der tyder på, at nedsat hjertefunktion IMS og lignende fænotypiske syndromer har en lignende karakter TGF-krosdysregulering (13). Mekanisme for hjerteaffektion i disse typer af sygdomme erden venstre ventrikulære væg remodeling på grund af en øget aktivering af TGF-krissignaleringsvej. Huntgeburt et al. (14) påvis, at TGF-Karr regulerer det hypertrofiske og kontraktile respons på den Karr-adrenerge stimulation i hjertet, hvilket fører til hjertehypertrofi og myocardial dysfunktion.Cirkulerende TGF-Kris har fået opmærksomhed, fordi det potentielt kan tjene som en biomarkør for af aorta remodeling progression hos patienter ikke kun med MS, men også i andre genetiske aorta syndromer (15,16). Udover markeretforhøjelse af TGF-Kris-niveau hos patienter med MS i vores undersøgelse for første ganghar vist den signifikante forhøjelse af transformerende vækstfaktor-karrus1og-karrus2 serumniveauer hos patienter med marfanoid habitus, der kan bidrage tilsubklinisk myokardieinddragelse – fald i regional venstre ventrikulærsystolisk funktion.
begrænsninger af undersøgelsen
vores undersøgelse har flere begrænsninger. En række deltagere i forskelligegrupper er ikke ens. På grund af en sjælden patologi som Marfan syndrom er det umuligtat opnå et lige antal deltagere i studie-og kontrolgruppe.Befolkningen er uovertruffen for alder og køn, fordi vi inkluderede deltagere i undersøgelsen fortløbende. Mutationer af fibrillin – 1 screenede ikketil denne undersøgelse.
konklusion
forringelse af regional kontraktilitet hos unge med arveligebindevævsforstyrrelser forekommer ikke kun hos personer med Marfansyndrom, men også hos personer med marfanoid habitus, som påståeligtkun skeletfunktioner uden kardiovaskulære manifestationer. Forværring afregional myokardisk deformation kan være det første tegn på forringelse af venstre ventrikulær systolisk funktion og eksistensen af primær kardiomyopatii asymptomatiske marfanoid habitus patienter, hvilket kan påvirke deres længstermprognose (17) og kan være forårsaget af øget TGF-kurssignalering. Det er klart, at med fremtidige fremskridt inden for eksomscanning og andre innovationeri molekylær genetik, vil det snart være muligt at afsløre det genetiske grundlag formarfanoid habitus (6).
interessekonflikt
ingen interessekonflikt blandt forfatterne.
- Pyerits RE. Marfan syndrom. Annu Rev Med 2000; 51: 481-10.
- Carta L, Pereira L, Arteaga-Solis E, et al. Fibrilliner 1 og 2 udfører delvist overlappende funktioner under udvikling af aorta. J Biol Chem 2006;281: 8016-23.Habashi JP, dommer DP, Holm TM, et al. Losartan, en AT1-antagonist, forhindrer aortaaneurisme i en musemodel af Marfan syndrom. Videnskab 2006; 312:117-21.
- Alpendurada F, Yong J, Kiotsekoglou A, et al. Bevis for Marfan kardiomyopati. Eur J Hjertesvigt 2010;12:1085-91.
- Hetser R, Siegel G, Delmo-Valter EM. Kardiomyopati i Marfan syndrom. Eur J Cardiothorac Surg 2016; 49: 561-67.
- Grahame R, Hakim AJ. Arachnodactyly-en nøgle til diagnosticering af arvelige lidelser i bindevæv. Nat Rev Rheumatol 2013; 9: 358-64.
- Loeys BL, Diet HD, Braverman AC, et al. Den reviderede Gent-nosologi for Marfan-syndromet. J Med Genet 2010; 47: 476-85.lang R, Badano L, Afilalo J, et al. Anbefalinger til kvantificering af hjertekammer ved ekkokardiografi hos voksne: en opdatering fra American Society of Echocardiography og European Association of Cardiovascular Imaging. Eur Hjerte J Cardiovasc Imaging 2015; 16: 233-71.
- Voigt JU, Pedrisetti G, Lysyansky P, et al. Definitioner for en fælles standard for 2D speckle tracking ekkokardiografi: konsensusdokument fra Eacvi/ASE/Industry Task Force for at standardisere deformationsbilleddannelse. Eur Hjerte J Cardiovasc Imaging 2015; 16: 1-11.
- Malev E, Reeva S, Vasina L, et al. Kardiomyopati hos unge voksne med klassisk mitralventil prolaps. Cardiol Unge 2014; 24: 694-01.Maniar HS, Brady BD, Lee U, et al. Tidlig venstre ventrikulær regional kontraktil svækkelse ved kronisk mitral regurgitation forekommer i et konsistent, heterogent mønster. J Thorac Cardiovasc Surg 2014; 148: 1694-9.
- Bijnens BH, Cikes M, Claus P, et al. Hastighed og deformation billeddannelse til vurdering af myocardial dysfunktion. Eur J Ekkokardiogr 2009; 10: 216-26.
- Cook JR, Carta L, Galatioto J, et al. Kardiovaskulære manifestationer i Marfan syndrom og beslægtede sygdomme; flere gener forårsager lignende fænotyper. Clin Genet 2015; 87: 11-20.
- Huntgeburth M, Tiemann K, Shahverdyan R et al. Transformerende vækstfaktor b1 regulerer modsat det hypertrofiske og kontraktile respons på b-adrenerg stimulering i hjertet. PLoS ONE 2011; 6:e26628.Matt P, Schoenhoff F, Habashi J, et al. GenTAC Consortium. Cirkulerende transformerende vækstfaktor-beta i Marfan syndrom. Cirkulation 2009; 120:526-32.
- Hillebrand M, Millot N, Sheikhsadeh S, et al. Total serumtransformerende vækstfaktor-kurt1 er forhøjet i hele spektret af genetiske aorta syndromer. Clin Cardiol 2014; 37:672-9. Svensson LG, Blackstone EH, Feng J, et al. Kan MS-og Marfanoidpatienter skelnes ved langvarig opfølgning? Ann Thorac Surg 2007; 83: 1067-74.