Miocardiopatía en pacientes con síndrome de Marfan y hábito marfanoide
Ekaterina Luneva MD,PhD*, Eduard Malev MD,PhD1,2, Alexandra Korshunova MD1,2, Svetlana Reeva MD,PhD1,2, Eugeniy Timofeev MD, PhD1,2 y Eduard Zemtsovsky Prof, MD, PhD1,2 1 Departamento de trastorno del tejido conectivo, Centro Federal de Investigación Médica Almazov Noroeste, San Petersburgo, Rusia
2 Departamento de propedéutica de enfermedades internas, Universidad Estatal de Medicina Pediátrica, San Petersburgo, Rusia
*Correspondencia:Ekaterina Luneva,MD,PhD,Almazov North-West Federal Medical Research Centre,2 Akkuratova str., San Petersburgo, 197341, Rusia, Tel: +7-8127023749, Fax: +7-8127023744, Correo electrónico:
Fecha de recepción: 29 de diciembre de 2016 / Fecha de aceptación: 17 de marzo de 2017 / Fecha de publicación: 20 de marzo de 2017
Citación: Lunev E, Malev E, Korshunova A, et al. Miocardiopatía en pacientes con síndrome de Marfan y hábito marfanoide. Curr Res Cardiol 2017; 4 (1): 138-42.
Este artículo de acceso abierto se distribuye bajo los términos de la Licencia Creative Commons Attribution Non-Commercial License (CC BY-NC) (http://creativecommons.org/licenses/by-nc/4.0/), que permite la reutilización, distribución y reproducción del artículo, siempre que la obra original se cite correctamente y la reutilización esté restringida a fines no comerciales. Para la reutilización comercial, contacto
Resumen
OBJETIVOS: El término «miocardiopatía de Marfan» se utiliza para indicar cambios en la función ventricular izquierda en ausencia de patología valvular significativa en el síndrome de Marfan. Todavía se desconoce si hay cambios en la función cardíaca en pacientes con anomalías similares del tejido conjuntivo, como el hábito marfanoide.
MÉTODOS: En el estudio se incluyeron 98 personas, 8 pacientes con síndrome de Marfan, 24 con hábito marfanoide y 66 sujetos sanos. Se realizó ecocardiografía a todos los pacientes. Se utilizó ecocardiografía de seguimiento de manchas para evaluar los índices de deformación del ventrículo izquierdo. Las concentraciones del factor de crecimiento transformador-β1 y-β2 en suero se determinaron mediante el ensayo de inmunoabsorción enzimática.
RESULTADOS: La función ventricular izquierda sistólica fue significativamente menor en el grupo con síndrome de Marfan; también se detectó empeoramiento de la tensión ventricular izquierda longitudinal global en el grupo con EM en comparación con el grupo control. En sujetos con hábito marfanoide, encontramos una disminución significativa de la tensión circunferencial en el tabique interventricular y la pared inferior. los niveles séricos del factor de crecimiento transformador-β1 y-β2 fueron elevados en pacientes con síndrome de Marfan. La elevación del factor de crecimiento transformador-β1 fue estadísticamente no significativa, a diferencia del factor de crecimiento transformador-β2 en el grupo del hábito marfanoide. También se han encontrado correlaciones negativas entre el nivel sérico del factor de crecimiento transformador-β2 y la cepa radial sistólica en el grupo del hábito marfanoide.
CONCLUSIÓN: El empeoramiento de la deformación miocárdica regional puede ser el primer signo de deterioro de la función sistólica del ventrículo izquierdo y la existencia de miocardiopatía primaria en pacientes con hábito marfanoide asintomático, lo que podría afectar su pronóstico a largo plazo y puede ser causado por el aumento de la señalización del factor de crecimiento transformador-β.
Palabras clave
Síndrome de Marfan; hábito marfanoide; Miocardiopatía; Función sistólica ventricular izquierda; Deformación miocárdica; Factor de crecimiento transformador-β
El SM es uno de los trastornos hereditarios más comunes del tejido conectivo.En el rango de complicaciones de la EM se encuentran el aneurisma aórtico, los prolapsos de la válvula mitral y la disfunción miocárdica (1). Manifestaciones de MS causadas por mutaciones de fibrilina-1,un componente estructural de la matriz extracelular, y también violación de la regulación del factor de crecimiento transformador-β. Un número de estudios (2,3) mostraron que la activación excesiva de la vía de señalización TGF-β es la principal razón del deterioro de la función del VI y de la patología aortológica en la EM. El deterioro de la función sistólica y diastólica y la ampliación de las dimensiones del VI se encontraron en pacientes con SM sin considerar la ausencia de sobrecarga hemodinámica por regurgitación mitral o aórtica en presencia de prolapso de la válvula mitral o dilatación aórtica. El término «Marfancardiomiopatía» se utiliza para indicar cambios en la función ventricular izquierda en ausencia de patología valvular significativa en la EM (4,5). A pesar de que la cardiomiopatía en la EM está bien estudiada, todavía se desconoce si hay cambios en la función cardíaca en pacientes con anomalías similares del tejido conectivo, como el hábito marfanoide. el hábito marfanoide incluye aracnodactilia, manos largas y pies, aumento del estiramiento de la piel, hipermovilidad articular y cambios en la fisiología del pectus (Tabla 1).
| Medibles esquelético signos | Otras características del hábito marfanoide |
|---|---|
| Brazo de distancia a relación de altura > 1.03 | Escoliosis de> 5 grados |
| Relación entre la longitud de la mano y la altura> 11% | Deformidades del pectus (excavatum o carinatum) |
| Relación entre la longitud del pie y la altura> 15% | Deformidades mandibulares con sobrepoblación de dientes |
| Relación segmento superior a segmento inferior del cuerpo< 0.89 | Paladar de arco alto |
| Pies largos (a menudo con dedos de martillo) que se aplanan y pronan en el soporte de peso |
Tabla 1: Criterios de hábito marfanoide
Las características marfanoides están presentes en varios trastornos hereditarios del tejido conectivo, imitando algunos de los cambios del síndrome de Marfan, pero no acompañados de luxación del cristalino y aneurisma de la aorta. Las formas incompletas del hábito marfanoide son comunes y es probable que sean benignas; sin embargo, su presencia debería dar lugar a una evaluación de otra característica de trastornos hereditarios del tejido conjuntivo (6).
En este trabajo se evaluaron las características morfológicas y funcionales del VI en pacientes con SM y hábito marfanoide.
Materiales y métodos
En el estudio se incluyeron 98 personas, 8 de ellas pacientes con EM, 24 pacientes con hábito marfanoide y 66 sujetos sanos.
Los pacientes con EM fueron sometidos a seguimiento regular en el Centro Federal Almazov.El diagnóstico de EM se realizó aplicando los criterios de Gante (7). Las mutaciones de la offibrilina – 1 no se evaluaron para este estudio. Los pacientes no presentaron insuficiencia mitral o aórtica significativa (más que leve). Los sujetos con hábito marfanoide fueron seleccionados de los pacientes con EM no confirmada y no presentaban signos de aneurisma aórtico ni subluxación del cristalino. La Tabla 1 representa los criterios de hábito marfanoide de acuerdo con Grahame R, et al. (6). El grupo de control consistió en estudiantes saludables de la Universidad de Medicina Pediátrica.
La ecocardiografía se realizó en todos los pacientes por un ecocardiógrafo experimentado que utilizó un sistema de ultrasonido Vivid 7 (GE Healthcare),equipado con un transductor de matriz en fase armónico de 3,5 Hz e incluyó una evaluación de las dimensiones de las cámaras cardíacas y la función sistólica del LVM, medida por la regla biplana de Simpson. Se utilizaron registros ecocardiográficos transtorácicos estándar de 2 dimensiones para evaluar el ventrículo izquierdo como diámetro endodiastólico del VI, para evaluar el ventrículo derecho como diámetro endodiastólico del ventrículo derecho, para las aurículas izquierdas se utilizó el diámetro artial izquierdo de acuerdo con la guía actual (8). Además, se utilizó la ecocardiografía de seguimiento de manchas para evaluar los índices de deformación del ventrículo izquierdo (deformación y velocidad de deformación) (9). La deformación longitudinal se obtiene de 4, 3 y 2 cámaras apicales. Se obtuvieron cepas radiales y circunferenciales de axisimágenes cortos del VI a nivel de la válvula mitral, los músculos papilares y el ápice.El análisis de imágenes se realizó sin conexión en una estación de trabajo EchoPAC ‘ 08 (GE Healthcare). El VI se dividió en 18 segmentos. La velocidad de deformación se determinó como el valor negativo máximo durante la fase de eyección.La deformación sistólica máxima se definió como la magnitud de la deformación en el cierre de la válvula aórtica. También se midió la tasa de deformación de llenado diastólico inicial longitudinal máxima.
Evaluamos concentraciones de proteínas del factor de crecimiento transformador β1 y β2 biológicamente activas a partir de muestras de sangre EDTA utilizando procedimientos estándar mediante ensayos inmunoabsorbentes ligados a enzimas utilizando el sistema ELISAtest de platino Humano (Bender MedSysteMarfan syndrome Diagnostics GmbH, Viena,Austria). Las variaciones interanálisis e intranálisis fueron del 8% y el 6%,respectivamente. La sensibilidad fue de 5 pg / ml.
Análisis Estadístico
Todos los datos se presentan como media ± desviación estándar. La significación de las diferencias entre rasgos cuantitativos se determinó mediante la prueba t de Student,entre muestras pequeñas y características cualitativas determinadas mediante los métodos no paramétricos: prueba exacta de Fisher o prueba de chi cuadrado (p<0,05). La relación entre pares de variables continuas se expresó por la correlación de puntos. El tamaño de los efectos para los índices de deformación se midió por la d de Cohen utilizando medias y desviaciones estándar. El significado estadístico se estableció en p< 0.05. Todos los análisis estadísticos se realizaron con el software Statistica 10 (StatSoft, Inc.).
Resultados
Las características de los pacientes incluidos en el estudio se muestran en la Tabla 2.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| Sex, female/male | 0/8 | Jan-23 | 42/24 | (1-2) р=0.55 |
| (1-3) р=0.0006 | ||||
| (2-3) р=0.00001 | ||||
| Age, years | 28 ± 9.2 | 22 ± 3.4 | 20 ± 1.8 | (1-2) 0.01 |
| (1-3) 0.0001 | ||||
| (2-3) 0.0005 | ||||
| Altura, m | 186 ± 12 | 181 ± 9.1 | 170 ± 8.4 | (1-2) 0.22 |
| (1-3) 0.00001 | ||||
| (2-3) 0.00001 | ||||
| de Peso, kg | 71 ± 26 | 62 ± 9.7 | 61 ± 9.5 | (1-2) 0.16 |
| (1-3) 0.03 | ||||
| (2-3) 0.66 | ||||
| el síndrome de Marfan criterios | ||||
| diámetro de la Aorta en los senos de Valsalva por encima de Z-score de 2 o de la raíz aórtica la disección, n (%) | 5 (63%) | 0 (0%) | 0 (0%) | (1-2) 0.008 |
| (1-3) 0.008 | ||||
| (2-3) 1.0 | ||||
| Ectopia lentis, n (%) | 3 (38%) | 0 (0%) | 0 (0%) | (1-2) 0.065 |
| (1-3) 0.065 | ||||
| (2-3) 1.0 | ||||
| Puntuación de rasgos sistémicos de el síndrome de Marfan | ||||
| Muñeca Y el pulgar en signo, n (%) | 4 (50%) | 8 (33%) | 0 (0%) | (1-2) 0.41 |
| (1-3) 0.025 | ||||
| (2-3) 0.002 | ||||
| la Muñeca O el dedo pulgar en signo, n (%) | 7 (88%) | 16 (67%) | 0 (0%) | (1-2) 0.38 |
| (1-3) 0.0002 | ||||
| (2-3) <0.00001 | ||||
| Pectus carinatum deformity, n (%) | 7 (88%) | 3 (13%) | 0 (0%) | (1-2) 0.18 |
| (1-3) 0.0003 | ||||
| (2-3) <0.00001 | ||||
| Pectus excavatum or chest asymmetry, n (%) | 4 (50%) | 16 (67%) | 0 (0%) | (1-2) 0.41 |
| (1-3) 0.025 | ||||
| (2-3) <0.00001 | ||||
| Hindfoot deformity or plain pes planus, n (%) | 5 (63%) | 18 (75%) | 7 (11%) | (1-2) 0.5296 |
| (1-3) 0.0166 | ||||
| (2-3) <0.00001 | ||||
| Pneumothorax, n (%) | 0(0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 0.27 | ||||
| la ectasia Dural, n (%) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Protrusio acetabuli, n (%) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Reducción de NOSOTROS/LS Y el aumento de brazo/de altura Y no escoliosis severa, n (%)* | 2 (25%) | 0 (0%) | 0 (0%) | (1-2) 0.15 |
| (1-3) 0.15 | ||||
| (2-3) 1.0 | ||||
| la Escoliosis o cifosis toracolumbar, n (%) | 7 (88%) | 23 (96%) | 20 (30%) | (1-2) 0.54 |
| (1-3) 0.0016 | ||||
| (2-3) <0.00001 | ||||
| Reduced elbow extension, n (%) | 1(13%) | 0 (0%) | 0 (0%) | (1-2) 1,0 |
| (1-3) 1,0 | ||||
| (2-3) 1.0 | ||||
| Facial features (3/5)**, n (%) | 6 (75%) | 1 (4%) | 0 (0%) | (1-2) 0.15 |
| (1-3) 0.0018 | ||||
| (2-3) 1.0 | ||||
| Skin striae, n (%) | 0 (0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Myopia > 3 diopters, n (%) | 4 (50%) | 10 (42%) | 8 (12%) | (1-2) 0.69 |
| (1-3) 0.066 | ||||
| (2-3) 0.011 | ||||
| Mitral vaLVe prolapse (all types), n (%) | 2 (25%) | 8 (33%) | 0 (0%) | (1-2) 0.65 |
| (1-3) 0.15 | ||||
| (2-3) 0.002 | ||||
| Systemic features score, points | 8,1 ± 1,2 | 5,4 ± 1,6 | 2,1 ± 0,5 | (1-2) 0.0002 |
| (1-3) <0.00001 | ||||
| (2-3) <0.00001 | ||||
| hábito Marfanoide criterios*** | ||||
| Esquelético signos de hábito marfanoide | 5 (63%) | 19 (79%) | 5 (8%) | (1-2) 0.41 |
| (1-3) n/a | ||||
| (2-3) <0.00001 | ||||
| deformidades de la Mandíbula con un apiñamiento de los dientes | 5 (63%) | 14 (58%) | 16 (24%) | (1-2) 0.84 |
| (1-3) 0.07 | ||||
| (2-3) 0.005 | ||||
| paladar Alto y arqueado | 7 (88%) | 12 (50%) | 8 (12%) | (1-2) 0.028 |
| (1-3) 0.0004 | ||||
Tabla 2: Características de los pacientes incluidos en el estudio
En los grupos con EM y el hábito marfanoide hombres fueron predominaba.Los pacientes con EM eran mayores que los que tenían hábito marfanoide y los individuos del grupo control. Los pacientes con EM eran más altos que otros. Las características sistémicas se encontraron con frecuencia significativa en pacientes con EM en comparación con el hábito marfanoide. La puntuación de características sistémicas permitió distinguir a los pacientes con EM de los pacientes con hábito marfanoide. En el otro lado, se encontraron criterios de hábito marfanoide en pacientes con EM y marfanoidabitus, pero permitieron separar el hábito marfanoide de los individuos sanos. Así, la presencia de signos esqueléticos en ausencia de otros criterios de Gante permite verificar el hábito marfanoide con alta sensibilidad (79%)y especificidad (91%).
Los resultados de la evaluación morfológica y funcional del corazón se resumieron en la Tabla 3.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| End-diastolic LV diameter, mm | 50.5 ± 4.6 | 46.7 ± 4.54 | 44.1 ± 4.94 | (1-2) 0.012 |
| (1-3) 0.0003 | ||||
| (2-3) 0.027 | ||||
| End-systolic LV diameter, mm | 34.8 ± 3.8 | 29.5 ± 4.9 | 28.4 ± 3.9 | (1-2) 0.005 |
| (1-3) 0.0014 | ||||
| (2-3) 0.33 | ||||
| End-diastolic LV volume, mm | 114.3 ± 12.6 | 98.7 ± 19.2 | 89.3 ± 19.2 | (1-2) 0.019 |
| (1-3) 0.0002 | ||||
| (2-3) 0.046 | ||||
| End-systolic LV volume, mm | 55.2 ± 14.0 | 33.9 ± 12.6 | 33.9 ± 8.9 | (1-2) 0.0028 |
| (1-3) 0.0026 | ||||
| (2-3) 1.0 | ||||
| Ejection fraction, % | 52.8 ± 8.9 | 66.4 ± 7.5 | 67 ± 5.3 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 0.48 | ||||
| Left ventricular mass index, g/m2 | 111.8 ± 31.5 | 78.5 ± 18.9 | 83.7 ± 15.9 | (1-2) 0.027 |
| (1-3) 0.033 | ||||
| (2-3) 0.23 | ||||
| E/A ratio | 1.50 ± 0.47 | 1.53 ± 0.42 | 1.69 ± 0.4 | (1-2) 0.87 |
| (1-3) 0.10 | ||||
| (2-3) 0.48 | ||||
| el diámetro diastólico Final del ventrículo derecho, мм | 31 ± 7.2 | 23 ± 4.26 | 24 ± 3.13 | (1-2) 0.0006 |
| (1-3) 0.00001 | ||||
| (2-3) 0.23 | ||||
| Diámetro de la aurícula izquierda, мм | 37 ± 4.97 | 30 ± 3.98 | 30 ± 2.99 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 1.0 | ||||
| Aortic diameter at the sinuses of Valsalva, mm | 43.1 ± 15.1 | 30.3 ± 4.5 | 24.0 ± 4.5 | (1-2) 0.0007 |
| (1-3) 0.00001 | ||||
| (2-3) 0.00001 | ||||
| Z-score | 6.86 ± 5.83 | 1.56 ± 0.93 | 1.59 ± 0.17 | (1-2) 0.039 |
| (1-3) 0.038 | ||||
| (2-3) 0.88 | ||||
| Mitral regurgitation grade, none/mild (%) | 0/8 (0/100%) | 6/18 (25/75%) | 24/42 (36/64%) | (1-2) 0.29 |
| (1-3) 0.047 | ||||
| (2-3) 0.44 |
Table 3: Datos ecocardiográficos en los grupos de estudio
No hubo diferencia estadísticamente significativa en el tamaño del ventrículo derecho y la aurícula izquierda en los pacientes jóvenes del grupo control en comparación con los pacientes con marfanoidhabitus, pero es de esperar que estas dimensiones difieran estadísticamente en los pacientes hospitalizados del grupo con EM. Sin embargo, el agrandamiento ventricular izquierdo se encontró no solo en pacientes con SM, sino también en pacientes con hábito marfanoide en comparación con el grupo control, pero cabe señalar que las dimensiones del LVP fueron normales en todos los grupos de observación.
Como era de esperar, la función sistólica del VI fue significativamente menor en el grupo con EM,pero no hubo diferencias estadísticamente significativas en la EF del ventrículo izquierdo entre los pacientes con hábito marfanoide y el grupo control. Como bien global longitudinal del ventrículo izquierdo cepa empeoramiento fue detectado en MS de grupo(cepa: -15.7 ± 0.9% vs -19.6 ± 3.4%, p=0,002; la velocidad de deformación: -0.94 ± 0.09 s-1 vs -1.22 ± 0.8 s-1, p=0.00001). Al mismo tiempo, no se encontraron cambios en la tasa de deformación/deformación globalongitudinal, circunferencial o radial en pacientes con habitus marfanoide (Tabla 4).
| Walls | Strain / Strain rate | Marfanoid habitus (n=24) | Control group (n=66) | р (Student’s t-test) | |
| Anteroseptal | L | Strain, % | –17.8 ± 4.1 | –18.7 ± 3.4 | 0.34 |
| Strain rate, s-1 | –1.09 ± 0.21 | –1.13 ± 0.2 | 0.42 | ||
| C | Strain, % | –22.9 ± 6.48 | –26.6 ± 4.5 | 0.014 (Cohen’s d = 0.66) | |
| Strain rate, s-1 | –1.64 ± 0.51 | –1.68 ± 0.39 | 0.72 | ||
| R | Strain, % | 41.5 ± 16.6 | 40.7 ± 16.4 | 0.84 | |
| Strain rate, s-1 | 1.79 ± 0.62 | 1.60 ± 0.44 | 0.17 | ||
| Anterior | L | Strain, % | –20.0 ± 4.46 | –19.9 ± 3.3 | 0.92 |
| Strain rate, s-1 | –1.35 ± 0.46 | –1.23 ± 0.26 | 0.24 | ||
| C | Strain, % | –17.2 ± 6.15 | –19.4 ± 4.4 | 0.12 | |
| Strain rate, s-1 | –1.43 ± 0.43 | –1.48 ± 0.39 | 0.61 | ||
| R | Strain, % | 42.6 ± 15.9 | 42.6 ± 17.2 | 1 | |
| Strain rate, s-1 | 1.71 ± 0.60 | 1.66 ± 0.51 | 0.72 | ||
| Anterolateral | L | Strain, % | –18.6 ± 4.52 | –17.3 ± 4.2 | 0.23 |
| Strain rate, s-1 | –1.39 ± 0.35 | –1.24 ± 0.31 | 0.07 | ||
| C | Strain, % | –14.8 ± 5.79 | –15.0 ± 5.1 | 0.88 | |
| Strain rate, s-1 | –1.21 ± 0.43 | –1.28 ± 0.41 | 0.49 | ||
| R | Strain, % | 40.9 ± 14.6 | 43.3 ± 16.7 | 0.51 | |
| Strain rate, s-1 | 1.62 ± 0.63 | 1.63 ± 0.52 | 0.94 | ||
| Inferolateral | L | Strain, % | –19.5 ± 3.8 | –18.4 ± 4.1 | 0.24 |
| Strain rate, s-1 | –1.40 ± 0.32 | –1.28 ± 0.3 | 0.12 | ||
| C | Strain, % | –14.8 ± 6.43 | –16.3 ± 4.8 | 0.31 | |
| Strain rate, s-1 | –1.13 ± 0.46 | –1.21 ± 0.39 | 0.45 | ||
| R | Strain, % | 39.2 ± 14.0 | 42.3 ± 15.3 | 0.37 | |
| Strain rate, s-1 | 1.61 ± 0.53 | 1.64 ± 0.53 | 0.81 | ||
| Inferior | L | Strain, % | –20.6 ± 3.96 | –19.9 ± 3.5 | 0.45 |
| Strain rate, s-1 | –1.27 ± 0.24 | –1.22 ± 0.2 | 0.36 | ||
| C | Strain, % | –16.5 ± 5.73 | –19.8 ± 4.9 | 0.017 (Cohen’s d = 0.62) | |
| Strain rate, s-1 | –1.23 ± 0.38 | –1.28 ± 0.38 | 0.58 | ||
| R | Strain, % | 38.9 ± 11.0 | 41.5 ± 14.3 | 0.36 | |
| Strain rate, s-1 | 1.58 ± 0.47 | 1.57 ± 0.48 | 0.93 | ||
| Inferoseptal | L | Strain, % | –20.5 ± 4.24 | –20.7 ± 3.1 | 0.83 |
| Strain rate, s-1 | –1.20 ± 0.22 | –1.19 ± 0.19 | 0.85 | ||
| C | Strain, % | –22.0 ± 4.42 | –24.4 ± 4.5 | 0.028 (Cohen’s d = 0.53) | |
| Strain rate, s-1 | –1.42 ± 0.43 | –1.49 ± 0.43 | 0.49 | ||
| R | Strain, % | 38.7 ± 11.2 | 40.7 ± 14.6 | 0.49 | |
| Strain rate, s-1 | 1.65 ± 0.53 | 1.56 ± 0.44 | 0.46 | ||
| Global | L | Strain, % | –19.6 ± 3.49 | –19.6 ± 3.4 | 1 |
| Strain rate, s-1 | –1.25 ± 0.23 | –1.22 ± 0.18 | 0.57 | ||
| C | Strain, % | –18.7 ± 4.26 | –20.5 ± 3.7 | 0.08 | |
| Strain rate, s-1 | –1.35 ± 0.36 | –1.39 ± 0.29 | 0.63 | ||
| R | Strain, % | 41.3 ± 11.4 | 41.3 ± 10.9 | 1 | |
| Strain rate, s-1 | 1.67 ± 0.50 | 1.61 ± 0.37 | 0.59 | ||
Table 4: Deformación global y local y tasa de deformación en los grupos de hábito marfanoide y control
Para revelar cambios sutiles en la contractilidad del VI en pacientes con hábito marfanoide, se utilizó el análisis de seguimiento de manchas para evaluar la deformación regional de las paredes del VI(Tabla 4). Se encontró una disminución significativa de la tensión circunferencial (de lo contrario, en el tabique interventricular o radial) en los sujetos del hábito marfanoide de pared inferior y tabique interventricular (Figura 1) en comparación con el grupo control, con tamaños de efecto medio medidos por la d de Cohen (0,53 – 0,66). En otras paredes del VI no se encontró diferencia significativa. La función diastólica se conservó en todos los grupos de estudio.

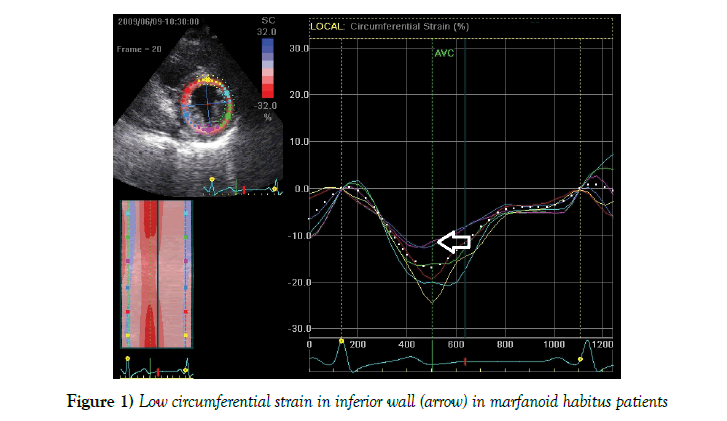 Figura 1: Tensión circunferencial baja en la pared inferior (flecha) en pacientes con hábito marfanoide
Figura 1: Tensión circunferencial baja en la pared inferior (flecha) en pacientes con hábito marfanoide Los niveles séricos de TGF-β1 y TGF-β2 fueron elevados en pacientes con marfanoidhabitus (14,2 ± 27,6 y 2,1 ± 1,7 ng/ml, respectivamente) y a pesar de la desviación estándar considerable, encontramos diferencias significativas con MS (44,6 ± 47,3 ng/ml, p=0,03 y 2,7 ± 1,7 ng / ml, p = 0,39, respectivamente) y control (8,4 ± 3.5 ng/ml, p=0,09 y 1,2 ± 0,7 ng / ml, p=0,0006, respectivamente) (Figura 2).

Figura 2: Niveles de TGF-β1 y β2 en los grupos de estudio
Un nivel sérico de TGF-β1 alto (> 14,75 ng/ml) se detectó en la mitad del grupo y TGF-β2 (> 2,0 ng/ml) en la mayoría de los pacientes (75%) del grupo de EM.En el grupo del hábito marfanoide, encontramos un nivel sérico de TGF-β1 alto en 4 (17%)pacientes y TGF-β2 en 9 (38%) pacientes que es más que control group.In grupo control no hubo individuos con niveles elevados de TGF-ß1 y solo 2 personas con niveles altos de TGF-β2.
Además, hemos identificado las correlaciones negativas entre el nivel serum del factor de crecimiento transformador-β2 y la deformación radial sistólica (r=0,53,p=0,012) en el grupo de habitus marfanoide. No hubo correlación entre el nivel de GF-β y las dimensiones aórticas en pacientes con EM y marfanohábitus; pero se encontró correlación entre el nivel de TGF-β y las características esqueléticas del hábito marfanoide – TGF-β2 con relación longitud-altura del pie (r=0.47,p=0.03), TGF-β1 con escoliosis (r=0.72, p=0.0001). El nivel sérico de TGF-β1 también se correlacionó débilmente con el volumen diastólico final (r=0,42, p=0,04) y la masa miocárdica ventricular izquierda (r=0,44, p=0,036).
Discusión
La reducción de la contractilidad global del VI en pacientes con EM se ha descrito previamente en varios estudios (4,5). En nuestro estudio también encontramos deterioro de la contractilidad global del VI y deformación en dimensiones normales del VI hospitalizados con EM. En pacientes con hábito marfanoide, la función sistólica del VI se conservó y solo se encontró una disminución de la tensión circunferencial (de lo contrario, en el tabique interventricular o radial) en el tabique interventricular y la pared inferior.
El hábito marfanoide es una característica común importante en una serie de trastornos genéticos heredables de síndromes del tejido conjuntivo y no patognomónicos de la EM (6). Los criterios actuales de Gante y del hábito marfanoide(6,7) permiten distinguir a los pacientes con EM de los pacientes con hábito marfanoide en nuestro estudio con alta sensibilidad y especificidad. El hallazgo más importante de la presente investigación fue que la lesión contráctil precoz observada en pacientes con marfanohábitus con función contráctil global normal se distribuye regionalmente en el tabique y la pared inferior del VI. Hasta donde sabemos, este es el primer hallazgo reportado de tal patrón contráctil regional demostrado en pacientes con hábito marfanoide. Varios estudios demostraron disfunción contractráctil regional en otros trastornos hereditarios del tejido conectivo, como el prolapso de la válvula mitral (10,11). En algunas enfermedades genéticas como la ataxia de Friedreich, la enfermedad de Fabry o la miocardiopatía de Duchenne, los primeros cambios en la formación regional también se producen en el segmento inferolateral (12).
Actualmente, hay datos que indican que el deterioro de la función cardíaca en la EM y síndromes fenotípicos similares tiene una regulación TGF-ß de carácter similar (13). El mecanismo de afección cardíaca en este tipo de enfermedades es el remodelado de la pared ventricular izquierda debido a una mayor activación de la vía de señalización TGF-ß. Huntgeburt et al. (14) demostrar que el TGF-β regula la respuesta hipertrófica y contráctil a la estimulación β-adrenérgica en el corazón, lo que conduce a hipertrofia cardíaca y disfunción miocárdica.El TGF-β circulante ha recibido atención porque potencialmente puede servir como biomarcador para la progresión del remodelado aórtico en pacientes no solo con EM, sino también en otros síndromes genéticos aórticos (15,16). Además de la marcada elevación del nivel de TGF-β en pacientes con EM, en nuestro estudio por primera vez se ha mostrado una elevación significativa de los niveles séricos del factor de crecimiento transformador ß1 y β2 en pacientes con hábito marfanoide, que puede contribuir a la afectación miocárdica subclínica-disminución de la función sistólica del ventrículo izquierdo regional.
Limitaciones del Estudio
Nuestro estudio tiene varias limitaciones. Un número de participantes en diferentesgrupos no iguales. Debido a una patología rara como el síndrome de Marfan, es imposible lograr un número igual de participantes en el estudio y en el grupo de control.Las poblaciones no tienen parangón por edad y género, ya que incluimos a los participantes en el estudio de forma consecutiva. Las mutaciones de fibrilina – 1 no se evaluaron para este estudio.
Conclusión
El deterioro de la contractilidad regional en jóvenes con trastornos hereditarios del tejido conectivo se produce no solo en individuos con síndrome de Marfan, sino también en sujetos con hábito marfanoide que supuestamente tienen características esqueléticas únicas sin manifestaciones cardiovasculares. El empeoramiento de la deformación miocárdica regional puede ser el primer signo de deterioro de la función sistólica del ventrículo izquierdo y la existencia de miocardiopatías primarias en pacientes con hábito marfanoide asintomático, lo que podría afectar a su prognosis a largo plazo (17) y puede ser causado por un aumento de la señalización del TGF-β. Se esperaba que con los futuros avances en el escaneo de exomas y otras innovaciones en genética molecular, pronto sería posible revelar la base genética del habitus marfanoide (6).
Conflicto de Interés
No hay conflicto de intereses entre los autores.
- Pyeritz RE. El síndrome de Marfan. Annu Rev Med 2000; 51: 481-10.
- Carta L, Pereira L, Arteaga-Solis E, et al. Las fibrilinas 1 y 2 realizan funciones parcialmente superpuestas durante el desarrollo aórtico. J Biol Chem 2006; 281: 8016-23.
- Habashi JP, Juez DP, Holm TM, et al. Losartán, un antagonista AT1, previene el aneurisma aórtico en un modelo de ratón de síndrome de Marfan. Science 2006; 312: 117-21.
- Alpendurada F, Wong J, Kiotsekoglou A, et al. Evidencia de miocardiopatía de Marfan. Eur J Heart Fail 2010;12: 1085-91.
- Hetzer R, Siegel G, Delmo-Walter EM. Miocardiopatía en el síndrome de Marfan. Eur J Cardiothorac Surg 2016;49: 561-67.
- Grahame R, Hakim AJ. Aracnodactilia: una clave para diagnosticar trastornos hereditarios del tejido conectivo. Nat Rev Rheumatol 2013; 9: 358-64.
- Loeys BL, Dietz HD, Braverman AC, et al. The revised Ghent nosology for the Marfan syndrome (en inglés). J Med Genet 2010; 47: 476-85.
- Lang R, Badano L, Afilalo J, et al. Recomendaciones para la Cuantificación de la Cámara Cardíaca por Ecocardiografía en Adultos: Una actualización de la Sociedad Americana de Ecocardiografía y la Asociación Europea de Imágenes Cardiovasculares. Eur Heart J Cardiovasc Imaging 2015;16: 233-71.
- Voigt JU, Pedrizzetti G, Lysyansky P, et al. Definiciones para un estándar común para ecocardiografía de seguimiento de manchas 2D: documento de consenso del Grupo de Trabajo EACVI / ASE / Industry para estandarizar la imagen de deformación. Eur Heart J Cardiovasc Imaging 2015;16: 1-11.
- Malev E, Reeva S, Vasina L, et al. Miocardiopatía en adultos jóvenes con prolapso clásico de la válvula mitral. Cardiol Young 2014; 24: 694-01.
- Maniar HS, Brady BD, Lee U, et al. El deterioro contráctil regional ventricular izquierdo temprano en la regurgitación mitral crónica ocurre en un patrón consistente y heterogéneo. J Thorac Cardiovasc Surg 2014; 148: 1694-9.
- Bijnens BH, Cikes M, Claus P, et al. Imagen de velocidad y deformación para la evaluación de la disfunción miocárdica. Eur J Echocardiogr 2009; 10: 216-26.
- Cook JR, Carta L, Galatioto J, et al. Manifestaciones cardiovasculares en el síndrome de Marfan y enfermedades relacionadas; múltiples genes que causan fenotipos similares. Clin Genet 2015; 87: 11-20.
- Huntgeburth M, Tiemann K, Shahverdyan R et al. El Factor de Crecimiento Transformador b1 regula de forma opuesta la respuesta hipertrófica y contráctil a la estimulación b-adrenérgica en el corazón. PLoS ONE 2011; 6:e26628.
- Matt P, Schoenhoff F, Habashi J, et al. Consorcio GenTAC. Factor beta de crecimiento transformador circulante en el síndrome de Marfan. Circulation 2009; 120: 526-32.
- Hillebrand M, Millot N, Sheikhzadeh S, et al. El factor de crecimiento transformador sérico total-β1 está elevado en todo el espectro de síndromes aórticos genéticos. Clin Cardiol 2014; 37: 672-9.
- Svensson LG, Blackstone EH, Feng J, et al. ¿Se distinguen los Pacientes con EM y Marfanoides en el Seguimiento a Largo Plazo? Ann Thorac Surg 2007; 83: 1067-74.