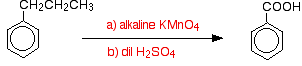einige weitere Reaktionen von Benzol und Methylbenzol
Die Sulfonierung von Methylbenzol
Methylbenzol ist reaktiver als Benzol, da die Methylgruppe dazu neigt, Elektronen in Richtung Ring zu „drücken“. Wie genau dies die Reaktionsgeschwindigkeit erhöht, ist jenseits eines solchen Niveaus – es ist ziemlich komplizierter als nur eine Erhöhung der Elektronendichte des Rings.
Der Effekt dieser größeren Reaktivität ist, dass Methylbenzol mit rauchender Schwefelsäure bei 0 ° C und mit konzentrierter Schwefelsäure reagiert, wenn sie etwa 5 Minuten unter Rückfluss erhitzt werden.
Neben der Auswirkung auf die Reaktionsgeschwindigkeit muss man bei Methylbenzol auch darüber nachdenken, wo die Sulfonsäuregruppe relativ zur Methylgruppe am Ring endet.
Methylgruppen neigen dazu, neue Gruppen in die 2- und 4-Positionen des Rings zu „lenken&“(vorausgesetzt, die Methylgruppe befindet sich in der 1- Position). Methylgruppen werden als 2,4-Gruppen bezeichnet. Der Ursprung dieses Regieeffekts liegt auch jenseits des UK-A-Niveaus.
Man erhält also eine Mischung, die hauptsächlich aus zwei Isomeren besteht. Es werden nur etwa 5 – 10% des 3-Isomeren gebildet.
Die wichtigsten Reaktionen sind:
![]()
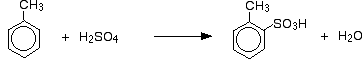
und:
![]()
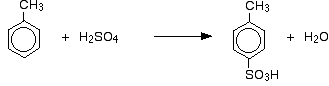
bei der Sulfonierung hängt der genaue Anteil der gebildeten Isomeren von der Reaktionstemperatur ab. Mit zunehmender Temperatur erhalten Sie zunehmende Anteile des 4-Isomers und weniger des 2-Isomers.
Dies liegt daran, dass die Sulfonierung reversibel ist. Die Sulfonsäuregruppe kann wieder vom Ring fallen und an anderer Stelle wieder anhaften. Dies begünstigt tendenziell die Bildung des thermodynamisch stabilsten Isomeren. Dieser Austausch geschieht mehr bei höheren Temperaturen.
Das 4- Isomer ist stabiler, da es keine Unordnung im Molekül gibt, wie es der Fall wäre, wenn die Methylgruppe und die Sulfonsäuregruppe nebeneinander wären.
Seitenkettenoxidation in Alkylbenzolen
Ein Alkylbenzol ist einfach ein Benzolring, an den eine Alkylgruppe gebunden ist. Methylbenzol ist das einfachste Alkylbenzol.
Alkylgruppen sind normalerweise ziemlich oxidationsbeständig. Wenn sie jedoch an einen Benzolring gebunden sind, werden sie leicht durch eine alkalische Lösung von Kaliummanganat(VII) (Kaliumpermanganat) oxidiert.
Methylbenzol wird mit einer mit Natriumcarbonat alkalisch gestellten Kaliummanganatlösung(VII) unter Rückfluß erhitzt. Die violette Farbe des Kaliummanganats (VII) wird schließlich durch einen dunkelbraunen Niederschlag von Manganoxid (IV) ersetzt.
Abschließend wird mit verdünnter Schwefelsäure angesäuert.
Insgesamt wird das Methylbenzol zu Benzoesäure oxidiert.
![]()
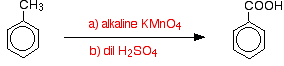
Interessanterweise wird jede Alkylgruppe unter diesen Bedingungen wieder zu einer -COOH-Gruppe am Ring oxidiert. So wird beispielsweise auch Propylbenzol zu Benzoesäure oxidiert.
![]()