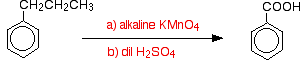niektóre reakcje benzenu i metylobenzenu
sulfonowanie metylobenzenu
Metylobenzenu jest bardziej reaktywne niż benzen ze względu na tendencję grupy metylowej do „pchania” elektronów w kierunku pierścienia. Dokładnie to, jak zwiększa szybkość reakcji, przekracza poziom UK A – jest to raczej bardziej skomplikowane niż tylko wzrost gęstości elektronów pierścienia.
efekt tej większej reaktywności polega na tym, że metylobenzen reaguje z dymiącym kwasem siarkowym w temperaturze 0°C i ze stężonym kwasem siarkowym, jeśli są one podgrzewane pod chłodnicą zwrotną przez około 5 minut.
podobnie jak wpływ na szybkość reakcji, z metylobenzenem trzeba również pomyśleć o tym, gdzie grupa kwasu sulfonowego kończy się na pierścieniu w stosunku do grupy metylowej.
grupy metylowe mają tendencję do „kierowania" nowych grup do pozycji 2 – i 4 – na pierścieniu (zakładając, że grupa metylowa znajduje się w pozycji 1). Mówi się, że grupy metylowe są 2,4-kierunkowe. Pochodzenie tego efektu reżyserskiego jest również poza brytyjskim poziomem A.
otrzymujemy więc mieszaninę, która składa się głównie z dwóch izomerów. Powstaje tylko około 5-10% 3-izomeru.
główne reakcje to:
![]()
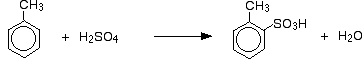
oraz:
![]()
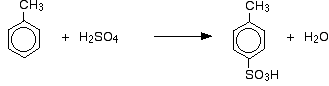
w przypadku sulfonowania dokładna proporcja powstających izomerów zależy od temperatury reakcji. Wraz ze wzrostem temperatury, otrzymujemy coraz większe proporcje izomeru 4 i mniej izomeru 2.
wynika to z faktu, że sulfonowanie jest odwracalne. Grupa kwasu sulfonowego może ponownie spaść z pierścienia i ponownie przyłączyć się gdzie indziej. Sprzyja to powstawaniu najbardziej stabilnego termodynamicznie izomeru. Wymiana ta odbywa się częściej w wyższych temperaturach.
izomer 4 – jest bardziej stabilny, ponieważ nie ma bałaganu w cząsteczce, tak jak byłoby, gdyby grupa metylowa i grupa kwasu sulfonowego były obok siebie.
utlenianie łańcucha bocznego w alkilobenzenach
alkilobenzen jest po prostu pierścieniem benzenowym z dołączoną do niego grupą alkilową. Metylobenzen jest najprostszym alkilobenzenem.
grupy alkilowe są zwykle dość odporne na utlenianie. Jednakże, gdy są przyłączone do pierścienia benzenowego, są łatwo utleniane przez zasadowy roztwór manganianu potasu (VII) (nadmanganianu potasu).
metylobenzen ogrzewa się pod chłodnicą zwrotną roztworem manganianu potasu(VII), alkalicznym węglanem sodu. Purpurowy kolor manganianu potasu(VII) zostaje ostatecznie zastąpiony ciemnobrązowym osadem tlenku manganu (IV).
mieszaninę ostatecznie zakwasza się rozcieńczonym kwasem siarkowym.
ogólnie metylobenzen utlenia się do kwasu benzoesowego.
![]()
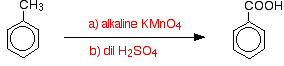
Co ciekawe, każda grupa alkilowa jest w tych warunkach utleniona z powrotem do grupy A-COOH na pierścieniu. Tak więc, na przykład, propylobenzen jest również utleniany do kwasu benzoesowego.
![]()