Frontiers in Immunology
- Einleitung
- T- und B-Zellkompartimente und zwei konventionelle Stromazelluntergruppen
- Eine neu identifizierte Stroma-Untergruppe, marginale retikuläre Zellen
- MRCs und der Antigen-Eintrittsweg in SLOs
- MRCs und Organisator-Stromazellen in der SLO-Entwicklung
- Beziehung zwischen MRCs und anderen Stroma-Teilmengen
- Remodellierung von SLOs und tertiären lymphoiden Strukturen
- Schlussfolgerung
- Erklärung zum Interessenkonflikt
- Danksagungen
Einleitung
Sekundäre lymphoide Organe / Gewebe (SLOs) sind essentiell für die effiziente Induktion adaptiver Immunantworten. Verschiedene Arten von SLOs, einschließlich der Lymphknoten (LNs), der Milz und der schleimhautassoziierten lymphatischen Gewebe (MALTs) wie Peyers Patches (PPs), sind strategisch an verschiedenen Stellen im Körper positioniert. SLOs ist ein aufwendiger Filter, der Antigene abtastet und mit hochempfindlichen Immunsensoren ausgestattet ist. Um fremde Antigene zu sammeln und zu filtrieren, enthalten SLOs spezialisierte Gewebestrukturen, die mit dem Endothel oder Epithel assoziiert sind. Immunzellen wie Lymphozyten, dendritische Zellen (DCs) und Makrophagen akkumulieren zu hohen Dichten und bilden Kompartimente. Ein bemerkenswertes Merkmal, das allen SLOs gemeinsam ist, ist die getrennte Lokalisation von B-Zellen und T-Zellen. Die Architektur von SLOs wird durch verschiedene Arten von nicht hämatopoetischen Stromazellen mesenchymalen Ursprungs unterstützt, die Netzwerke aufbauen und Kompartimente definieren (Müller und Germain, 2009; Roozendaal und Mebius, 2011). Stroma-Netzwerke bieten nicht nur einen funktionellen Halt, sondern auch einen Raum für Immunzellaktivitäten sowie ein physikalisches Gerüst für das Gewebe. Darüber hinaus gibt es immer mehr Hinweise darauf, dass Stromazellen auch eine entscheidende Rolle bei der Funktion und Homöostase von Immunzellen spielen (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). SLOs sind so programmiert, dass sie sich aus den Anlagen entwickeln, die an bestimmten Orten und während begrenzter Zeiträume im Fötus und Säugling auftreten. Darüber hinaus ist bekannt, dass Stromazellen für die SLO-Entwicklung und -Wartung wichtig sind (Mebius, 2003). Hier konzentriere ich mich auf eine kürzlich identifizierte Stroma-Untergruppe, marginale retikuläre Zellen (MRCs), und fasse ihre Eigenschaften zusammen. Ich diskutiere auch die Beziehung zwischen MRCs und Gewebestruktur, andere Stroma-Teilmengen, und immunologische Funktionen.
T- und B-Zellkompartimente und zwei konventionelle Stromazelluntergruppen
Wie oben beschrieben, lokalisieren sich B-Zellen und T-Zellen in unterschiedlichen Regionen innerhalb von SLOs. B-Zellen sammeln sich an, um Follikel (B-Zone) im äußeren Kortex unter der Kapsel im LNs oder in der äußeren periarteriolären lymphatischen Hülle (PALS) in der Milz zu bilden. Eine Ansammlung großer Follikel ist das Kerngewebe von PPs. Während der Immunantwort bilden aktivierte B-Zellen in den Follikeln Keimzentren, in denen sie sich zu hochaffinen Antikörperproduzenten differenzieren (Cyster et al., 2000). Im Gegensatz dazu lokalisieren sich T-Zellen in einem separaten Bereich (T-Zone) neben den Follikeln, d. H. Dem Parakortex in LNs, inneren PALS in der Milz oder interfollikulären Region (IFR) in PPs. DCs akkumulieren auch in der T-Zone, um Antigen- und Prime-T-Zellen zu präsentieren (Steinman et al., 1997).
Es gibt zwei verschiedene Arten von mesenchymalen Stroma-Teilmengen in den B- und T-Zonen (Abbildung 1A). Follikuläre dendritische Zellen (FDCs) bilden ein dichtes Netzwerk im Zentrum der Follikel und haben aufgrund ihrer Bedeutung für die Antikörperproduktion durch B-Zellen (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs exprimieren CR1 / CD35, CD23 und gelegentlich MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Im Gegensatz dazu umfasst ein ausgeklügeltes Netzwerk fibroblastischer retikulärer Zellen (FRCs) das Gerüst der T-Zone, das Podoplanin / gp38 und verschiedene Komponenten der extrazellulären Matrix (ECM) produziert (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Im Allgemeinen werden Immunzellmigration und -lokalisation durch eine Vielzahl von Chemokinen reguliert (Mackay, 2001). Ruhende Lymphozyten und reife DCs reagieren sehr gut auf „homöostatische Chemokine“ (Cyster, 1999; Müller et al 2003). In Übereinstimmung damit gibt es klare Korrelationen zwischen Chemokinen, die von Stromazelluntergruppen produziert werden, und der Lokalisierung von Immunzellen, die die entsprechenden Rezeptoren exprimieren; CXCL13, das von FDCs produziert wird, ist ein Lockstoff von B-Zellen, die CXCR5 exprimieren, während CCL19 und CCL21 aus T-Zonen-FRCs T-Zellen und reife DCs über den gemeinsamen Rezeptor CCR7 anziehen (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Darüber hinaus wird angenommen, dass Lymphozyten, die robust im Gewebeparenchym wandern, um Antigene zu scannen, stromale Netzwerke als Standbein nutzen (Bajénoff et al 2006). Eine Vielzahl von Faktoren, die von Stroma-Teilmengen produziert werden, sind auch für die Aktivierung und das Überleben von Immunzellen erforderlich (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Daher ist die Struktur und Funktion des stromalen Netzwerks in jedem Kompartiment wahrscheinlich für die Aktivität von Immunzelluntergruppen optimiert.
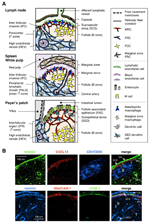
ABBILDUNG 1. Stromazelluntergruppen und Gewebestrukturen von SLOs. (A) Schematische Darstellung von Gewebestrukturen in Maus-SLOs mit Schwerpunkt auf Stromazellen und dem Antigen-Transportapparat. Stromale Elemente, einschließlich mesenchymaler, endothelialer und epithelialer Zellen sowie myeloischer Zellen wie Makrophagen und dendritischer Zellen (im rechten Bereich aufgeführt), werden zur Hervorhebung gezeichnet. (B) Oben: Das Gewebsgerüst, das aus drei verschiedenen Arten von Stromazellen in der äußeren kortikalen Region von LN besteht. Fluoreszierende Immunfärbung eines Maus-LN-Abschnitts. In der oberen Mikroaufnahme befindet sich ein kleiner ruhender Follikel (B) ohne Keimzentrum, der von FDCs unterstützt wird, die CR1 / CD35 exprimieren, aber nicht nachweisbare Spiegel von CXCL13 aufweisen. Stattdessen bilden MRCs ein Laminin + CXCL13 + retikuläres Netzwerk am äußeren Rand des Follikels unterhalb der Kapsel (CA) und des SCS. Das von FRCs im Paracortex (T) aufgebaute Netzwerk ist Laminin+CXCL13-CR1/CD35-. Unten: Die MAdCAM-1 + MRC-Schicht ist eng mit der LYVE-1 + lymphatischen Endothelschicht im SCS assoziiert. Beachten Sie, dass die MRC-Ebene auf den IFC-Bereich erweitert wird.
Das Stroma-Netzwerk in der T-Zone besteht aus FRCs und einem ECM-Bündel, das als retikuläre Faser bekannt ist und eine „Leitung“ bildet, die den Durchgang von Substanzen mit niedrigem Molekulargewicht erleichtert (Gretz et al., 1997, 2000; Nolte et al., 2003). Diese Leitung transportiert verschiedene Faktoren und lösliche Antigene tief im Gewebe, während Partikel und große Moleküle überwiegend aus den Lymphozytenkompartimenten ausgeschlossen sind. Tatsächlich werden durch Lymphe übertragene Chemokine aus peripheren Geweben schnell durch die Leitung zur hohen Endothelvene transportiert, um die Mobilisierung zirkulierender Zellen in das LNs zu steuern (Palframan et al., 2001). Darüber hinaus kontaktieren einige residente DCs direkt die Leitung und fangen durch Lymphe übertragene Antigene ein (Sixt et al., 2005).
Eine neu identifizierte Stroma-Untergruppe, marginale retikuläre Zellen
Der äußere Rand des LN-Cortex, direkt unter der Kapsel, ist vom Sinus subcapsularis umgeben (SCS; Abbildung 1A). Die luminale Oberfläche des SCS ist mit lymphatischen Endothelzellen bedeckt und ihre kortikale Seite wird von der Basalmembran, dem sogenannten „Boden“, unterstützt (Szakal et al., 1983). Insbesondere innerhalb des Gehirns breiten sich retikuläre Fasern vom Boden in den Paracortex aus (Gretz et al., 1997). Wichtig ist, dass auch im äußersten Bereich der Follikel eine dünne Schicht retikulärer Struktur beobachtet wird. FRC-ähnliche Stromazellen im follikulären Retikulum exprimieren CXCL13 und MAdCAM-1, jedoch nicht CCL21, was darauf hindeutet, dass sich diese Zellen von T-Zonen-FRCs unterscheiden, während der FDC-Marker CR1 / CD35 in diesen Zellen nicht oder nur schwach exprimiert wurde (Katakai et al., 2008; Abbildungen 1B und 2A). FDCs erzeugen keine retikulären Fasern, und dementsprechend fehlt der retikuläre Marker ER-TR7 im Zentrum der Follikel praktisch (Katakai et al., 2004a, b). Darüber hinaus exprimieren retikuläre Zellen in der subkapsulären Region spezifisch RANKL / TRANCE, ein Zytokin der TNF-Familie, das für die LN-Entwicklung essentiell ist (Dougall et al., 1999; Kong et al., 1999). Daher wurden diese Stromazellen als neue Stroma-Untergruppe angesehen und als marginale retikuläre Zellen bezeichnet (MRCs; Katakai et al., 2008). Bemerkenswert ist, dass eine erhebliche Menge an CXCL13 konstitutiv in MRCs in ruhenden kleinen Follikeln exprimiert wird, selbst wenn FDCs nicht nachweisbare Mengen an CXCL13 exprimieren (Abbildung 1B). Es ist bekannt, dass der äußere Rand von PALS in der Milz, insbesondere der, der über den Follikeln liegt, von einer MAdCAM-1 + -Stromaschicht begrenzt ist. Die Zellen, die die Auskleidung der Basalmembran unter dem marginalen Sinus (MS) bilden, exprimieren auch CXCL13 und RANKL, was darauf hinweist, dass diese Zellen eine Art von MRCs sind (Katakai et al., 2008). In MALTs bilden MRC-ähnliche retikuläre Zellen ein Netzwerk in der subepithelialen Kuppel (SED) -Region direkt unter der Basalmembran des follikelassoziierten Epithels (FAE; Katakai et al., 2008; Knoop et al., 2009). Zusammengenommen wird angenommen, dass MRCs eine Stroma-Teilmenge sind, die SLOs gemeinsam ist, sich jedoch von FDCs und FRCs unterscheidet.
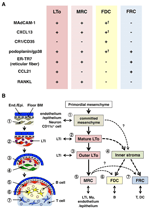
ABBILDUNG 2. Beziehung zwischen MRCs und anderen Stromazelluntergruppen in SLOs. (A) Muster der Markerexpression in Stromazelluntergruppen. Die Expressionsniveaus von MAdCAM-1, CXCL13 und Podoplanin / gp38 in FDCs sind oft schwach oder durch Immunhistochemie nicht nachweisbar (†). (B) Schematische Darstellung eines verallgemeinerten Modells der SLO-Entwicklung mit den Standorten der Stromazell-Teilmengen (links) und einer mutmaßlichen Genealogie der Stromazell-Teilmengen (rechts). Zahlen, die Zellelemente in der linken Zeichnung angeben, stellen Stromazellen-Teilmengen dar, die im rechten Schema gezeigt werden. BM, Basalmembran; Ende.In: Epi., endotheliale oder epitheliale Schicht.
MRCs und der Antigen-Eintrittsweg in SLOs
Sekundäre lymphatische Organe zeichnen sich durch besondere Strukturen aus, die Antigene filtrieren und in die Lymphozytenkompartimente transportieren (Abbildung 1A). LNs sind mit Lymphgefäßen verbunden, um durch Lymphe übertragene Antigene zu vermessen. Da die afferenten Lymphgefäße zum SCS offen sind, sind das Sinuslymphendothel und die Basalmembran sozusagen die Vorderseite des LN-Filters. Die Milz filtert Blut, in dem sich Äste der Zentralarterie zur MS und Randzone (MZ) öffnen, wo Immunzellen den Blutinhalt untersuchen. In diesen spezialisierten Sinusstrukturen sind die Grenzbarrieren das lymphatische Endothel im SCS des LN und das Blutendothel im MS der Milz, die beide vom MRC-Retikulum unterstützt werden. Interessanterweise sind CD169 + metallophile Makrophagen selektiv in der Nähe der Sinusauskleidung über die Follikel verteilt, von denen sich einige über die Endothelbarriere absetzen und partikuläre Antigene aus dem Sinuslumen in das Lymphozytenkompartiment transportieren (Szakal et al., 1983; Taylor et al., 2005; Carrasco und Batista, 2007; Phan et al., 2009). DCs, die Antigene aus den Geweben über die Lymphgefäße transportieren, gelangen zum SCS und wandern anschließend über den Boden des interfollikulären Kanals in den Parakortex (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). In MALTs fungiert die FAE als Barriere, in der eine spezialisierte Epithelzelle namens M-Zellen Bakterien oder Partikel aus dem Darmlumen auf darunter liegende DCs oder Makrophagen überträgt (Kraehenbuhl und Neutra, 2000). Daher unterstützen MRCs den Frontline-Antigen-Transport-Apparat in jedem SLO. Das grundlegende Design von SLOs besteht darin, dass die Follikel hauptsächlich in Richtung der Stelle des Antigeneintritts angeordnet sind und von T-Zonen begleitet werden. Aus stromischer Sicht scheint also die gesamte Gewebearchitektur in Richtung der MRC-Schicht organisiert zu sein.Obwohl die immunologischen Funktionen von MRCs schwer fassbar bleiben, wurde zuvor gezeigt, dass das von MRCs im äußeren Follikel aufgebaute Leitungsnetzwerk kleine lösliche Antigene zu follikulären B-Zellen und FDCs transportiert (Bajénoff und Germain, 2009; Roozendaal et al., 2009). Die meisten CD169 + -Makrophagen befinden sich auf der kortikalen Seite des SCS-Bodens und ragen eine Verlängerung in das Sinuslumen hinein, um Partikel einzufangen (Phan et al., 2009). Daher könnten MRCs an der Lokalisation, Morphologie und Funktion dieser Makrophagen beteiligt sein. Die Entwicklung von M-Zellen in PPs erfordert eine RANKL-RANK-Signalisierung, die wahrscheinlich von einem RANKL-exprimierenden MRC-Netzwerk direkt unter der FAE gesteuert wird (Knoop et al., 2009). Die Hemmung des LT-Signalwegs, der MRC-Signaturen in der weißen Milzpulpa abschafft, stört die MS-Struktur (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; In: Zindl et al., 2009). Darüber hinaus impliziert eine erhöhte ICAM-1-, VCAM-1- und CXCL13-Expression, dass MRCs an der dynamischen interstitiellen Migration von follikulären B-Zellen als funktionelles Gerüst beteiligt sind. Es wurde gezeigt, dass CD169 + -Makrophagen in diesem Bereich partikuläre Antigene direkt an antigen-spezifische B-Zellen abgeben (Carrasco und Batista, 2007; Phan et al., 2009), was darauf hindeutet, dass die MRC-netzwerkvermittelte Kontrolle der B-Zellmigration diesen Prozess beeinflussen kann. Da MRCs auch in der IFC-Region vorhanden sind, regulieren sie möglicherweise die Transmigration von DCs von der SCS in Richtung der T-Zone.
MRCs und Organisator-Stromazellen in der SLO-Entwicklung
Sekundäre lymphatische Organe entwickeln sich aus den Anlagen, die Aggregate von mesenchymalen und hämatopoetischen Zellen sind, die mit Gefäßen oder Epithel assoziiert sind, an einer definierten Stelle und Periode im Fötus oder Säugling (Mebius, 2003). Ein kritisches Ereignis bei der Entwicklung der SLO-Anlagen ist die Akkumulation von CD45 + CD4 + CD3- hämatopoetischen Zellen, die auch als Lymphoid Tissue Inducer (LTi) -Zellen bezeichnet werden und mit mesenchymalen Stromazellen interagieren, die als Lymphoid Tissue Organizer (LTo) -Zellen bezeichnet werden (Mebius et al., 1997). Ein Zytokin der TNF-Familie, Lymphotoxin (LT) -α1β2, das von LTi-Zellen exprimiert wird, überträgt Signale über den LT-β-Rezeptor an LTo-Zellen. LTo-Zellen induzieren anschließend die Expression von Adhäsionsmolekülen, einschließlich ICAM-1, VCAM-1 und MAdCAM-1, und Chemokinen CXCL13, CCL19 und CCL21 (Honda et al., 2001; Cupedo et al., 2004a; Bénézech et al 2010). Insbesondere ist CXCL13 besonders wichtig, um LTi-Zellen über seinen Rezeptor CXCR5 an die Anlagen anzulocken (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Es wird angenommen, dass eine positive Rückkopplungsschleife, d.h. neu eingewanderte LTi-Zellen, die LT produzieren, aktivieren LTo-Stromazellen weiter und fördern so die Organisation der Anlagen. Als sich nach der Geburt Lymphozyten anzusammeln begannen, dehnt sich das Gewebe aus und die Kompartimente, die von verschiedenen Stromazelluntergruppen unterstützt werden, werden induziert (Cupedo et al., 2004b; Bajénoff und Germain 2009).
Marginale retikuläre Zellen und LTo-Zellen exprimieren ein sehr ähnliches Muster verschiedener Marker (Abbildung 2A), was darauf hindeutet, dass zwischen diesen beiden Stromazellen eine Beziehung besteht. LTo-Zellen scheinen im Randbereich der LN-Anlagen neben dem lymphatischen Sinus des präsumptiven SCS konzentrierter zu sein (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Diese LTo-Zellschicht scheint sich mit dem Wachstum der Anlagen nach außen auszudehnen, was letztendlich zur MRC-Schicht zu werden scheint (Katakai et al., 2008). Wenn sich Lymphozyten um die zentrale Arterie in der postnatalen Milz ansammeln, dehnen sich LTO-Zellen, die MAdCAM-1 und RANKL exprimieren, mit der Schicht aus und werden zu MRCs in der weißen Pulpa. Diese Ergebnisse deuten stark darauf hin, dass MRCs ein direkter Nachkomme des LTo-Stromas sind, die die Eigenschaften von LTo-Zellen an spezialisierten Stellen innerhalb von SLOs bewahren. Selbst RAG-defiziente Mäuse weisen eine subkapsuläre MRC-Schicht in atrophischem LNs und geschrumpften periarteriellen MRC-Hüllen in der Milz auf, was darauf hinweist, dass die MRC-Entwicklung unabhängig von B- und T-Zellen erfolgt und vor ihrer Besiedlung programmiert wird (Katakai et al., 2008). Da SLOs effizient Antigene proben, um Immunantworten auszulösen, müssen die Antigensammelstrukturen, die während der Entwicklung aufgebaut werden, danach beibehalten werden. Dementsprechend ist es vernünftig, dass diese Gewebestrukturen während des gesamten Erwachsenenalters von Organisator-ähnlichen Stromazellen aufrechterhalten werden.
Beziehung zwischen MRCs und anderen Stroma-Teilmengen
Abbildung 2B zeigt die mögliche Genealogie von Stroma-Teilmengen in SLOs. Im Embryo wird das Urmesenchym, das sich in unmittelbarer Nähe des Gefäßsystems oder Epithels befindet, zur Bildung des Anlagekerns verpflichtet und zieht LTi-Zellen an. Auch Nervenzellen oder andere weniger charakterisierte Zellen sind am initialen Prozess beteiligt (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). Die Akkumulation von LTi-Zellen erleichtert die Reifung von Mesenchymzellen zu LTo-Zellen, was letztendlich den Aufbau der Grundarchitektur erleichtert. Typischerweise neigen LTo-Zellen dazu, sich an der Peripherie der Anlage zu konzentrieren und sich mit Gewebewachstum nach außen auszudehnen, während Stromazellen, die schwache oder keine LTo-Signaturen aufweisen, umgekehrt im inneren Teil der Anlage zunehmen. Die postnatale Besiedlung von B- und T-Zellen führt zu Kompartimenten mit der Induktion konventioneller Stroma-Teilmengen.
Wenn dieses Schema korrekt ist, folgt daraus, dass alle Stroma-Teilmengen in adulten SLOs ursprünglich von LTo-Zellen abgeleitet sind. Haben MRCs, die die Eigenschaften von LTo-Zellen bewahren, die Fähigkeit, sich in FDCs oder FRCs zu differenzieren? MRCs teilen viele Signaturen mit anderen Teilmengen (Abbildung 2A), was darauf hindeutet, dass dies möglich ist. Eine Spekulation ist, dass MRCs als stromale Stammzellen fungieren, die während des gesamten Erwachsenenalters kontinuierlich alle Stroma-Untergruppen versorgen. Obwohl diese Idee faszinierend ist, muss sie in Zukunft sorgfältig geprüft und weiter validiert werden. Mesenchymzellen sind im Allgemeinen in Abhängigkeit von der Umgebung sehr flexibel und können daher leicht verändert werden. Eine verlängerte Kultivierung von aus LNs isolierten Stromazellen führt zu einem Verlust der Expression vieler Gene, insbesondere homöostatischer Chemokine (Katakai et al., 2004a; Tomei et al., 2009). Dies deutet darauf hin, dass die In-vivo-Phänotypen der Stromazelluntergruppen durch die Gewebebedingungen, die reversibel sind und nicht auf terminale Differenzierung zurückzuführen sind, optimal aufrechterhalten werden. Darüber hinaus induzieren Entzündungsreize die robuste Proliferation von Stromazellen und den dramatischen Umbau von SLOs (Katakai et al., 2004a; Chyou et al., 2011). Obwohl MRCs in andere Teilmengen umgewandelt werden könnten, könnten sich herkömmliche Stroma-Teilmengen daher auch selbst erneuern und in erwachsenen SLOs austauschbar sein.
Remodellierung von SLOs und tertiären lymphoiden Strukturen
Während Immunantworten werden stromale Strukturen innerhalb von SLOs dramatisch remodelliert (Gretz et al., 1997; Katakai et al., 2004a). Einige Infektionen verursachen innerhalb weniger Tage eine schwere Störung der Gewebestrukturen innerhalb des LNs und der weißen Milzpulpa, die mit der Ausrottung der Erreger wiederhergestellt wird (Mueller et al., 2007a,b; Scandella et al., 2008; Johannes und Abraham, 2009). Dieser Wiederherstellungsprozess rekapituliert wahrscheinlich einen selbstorganisierenden Prozess über eine Rückkopplungsreaktion ähnlich der SLO-Entwicklung. Wichtig ist, dass LTi-ähnliche Zellen auch in adulten Geweben vorhanden sind und den infektionsassoziierten Umbau von SLOs regulieren (Kim et al., 2003; Scandella et al., 2008). Obwohl die Rolle von MRCs in solchen Prozessen unbekannt ist, spielen sie möglicherweise eine organisatorische Rolle in Zusammenarbeit mit LTi-ähnlichen Zellen und bestimmen den äußeren Rahmen von SLOs während der Rekonstruktion.
Bei chronischen Entzündungen, die mit verschiedenen Organpathologien einhergehen, führt eine große Anzahl infiltrierender Lymphozyten häufig zu Organisationen, die SLOs ähneln und als tertiäre lymphoide Gewebe bekannt sind (TLTs; Drayton et al., 2006). B- und T-Zellen werden getrennt und entsprechende Netzwerke von Stromazelluntergruppen induziert. Es wäre interessant zu bestimmen, ob MRCs in diesen ektopischen lymphoiden Strukturen vorhanden sind; MRC-ähnliche Zellen und verwandte Gewebestrukturen werden jedoch nicht in TLTs beobachtet, die sich während der Maus-Autoimmungastritis entwickelten (Katakai et al., 2006, 2008). Es sollte betont werden, dass TLTs grundsätzlich keine programmierten lymphoiden Organisationen sind und natürlich nicht mit den antigentransportierenden Strukturen assoziiert sind. Daher fehlen MRCs wahrscheinlich in TLTs. Obwohl Stromazellen, die MRCS phänotypisch ähnlich sind, in einigen Läsionen induziert werden könnten, würden sie nicht als MRCs identifiziert, es sei denn, sie assoziieren eng mit der spezifischen Endothel- oder Epithelstruktur und bilden ein schichtförmiges Retikulum an den äußeren Follikeln.
Schlussfolgerung
Marginale retikuläre Zellen sind eine einzigartige Stromazelluntergruppe, die SLOs gemeinsam ist. MRCs unterscheiden sich deutlich von herkömmlichen Teilmengen, die nach der Geburt durch Wechselwirkungen mit Lymphozyten induziert oder gereift sind, und werden direkt von LTo-Stromazellen in den Anlagen abgeleitet und unabhängig von Lymphozyten. Das Netzwerk von MRCs ist eng mit dem Antigen-Transport-Apparat von SLOs verbunden und soll direkt oder indirekt die Antigenabgabe an Lymphozytenkompartimente sowie die Lokalisierung und Migration von Immunzellen steuern. MRCs spielen wahrscheinlich eine entscheidende Rolle bei der Aufrechterhaltung der SLO-Strukturen als äußeres Gerüst und können im Steady State oder während des Gewebeumbaus in andere Stroma-Untergruppen umgewandelt werden. Es wird wichtig sein, alle Stroma-Teilmengen, Gewebestrukturen und immunologischen Mikroumgebungen gemeinsam zu betrachten, um das SLO-System umfassend zu verstehen.
Erklärung zum Interessenkonflikt
Der Autor erklärt, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Diese Arbeit wurde teilweise durch Zuschüsse für junge Wissenschaftler und für wissenschaftliche Forschung in innovativen Bereichen des japanischen Ministeriums für Bildung, Kultur, Sport, Wissenschaft und Technologie unterstützt.
Bajénoff, M., Egen, JG, Koo, LY, Laugier, JP, Brau, F., Glaichenhaus, N. und Germain, RN (2006). Stromazellnetzwerke regulieren Lymphozyteneintritt, Migration und Territorialität in Lymphknoten. Immunität 25, 989-1001.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bajénoff, M. und Germain, R. N. (2009). Die B-Zell-Follikelentwicklung baut das Leitungssystem um und ermöglicht die Abgabe löslicher Antigene an follikuläre dendritische Zellen. Blut 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H. und Weih, F. (2007). Unterschiedliche Rollen des Lymphotoxin-Beta-Signals und des Homöodomänen-Transkriptionsfaktors Nkx2.3 in der Ontogenese endothelialer Kompartimente in der Milz. Zellgewebe Res. 328, 473-486.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, CF, Anderson, G. und Caamaño, JH (2010). Ontogenese von Stromaorganisatorzellen während der Lymphknotenentwicklung. In: J. Immunol. 184, 4521–4530.
Pubmed Abstract / Pubmed Full Text
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., und Förster, R. (2011). Afferente Lymphe abgeleitete T-Zellen und DCs verwenden verschiedene Chemokinrezeptor CCR7-abhängige Routen für den Eintritt in den Lymphknoten und intranodale Migration. Nat. Immunol. 12, 879–887.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Carrasco, YR und Batista, FD (2007). B-Zellen erwerben ein Antigen in einem makrophagenreichen Bereich an der Grenze zwischen dem Follikel und dem subkapsulären Sinus des Lymphknotens. Immunität 27, 160-171.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. und Lu, T. T. (2011). Koordinierte Regulation des vaskulär-stromalen Lymphknotenwachstums zuerst durch CD11c + -Zellen und dann durch T- und B-Zellen. In: J. Immunol. 187, 5558–5567.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G. und Mebius, R. E. (2004a). Präsumptive Lymphknotenorganisatoren sind in sich entwickelnden mesenterialen und peripheren Knoten unterschiedlich vertreten. In: J. Immunol. 173, 2968–2975.
Pubmed Zusammenfassung / Pubmed Volltext
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G. und Mebius, R. E. (2004b). Die Initiierung der zellulären Organisation in Lymphknoten wird durch nicht von B-Zellen abgeleitete Signale reguliert und ist nicht abhängig von CXC Chemokin Ligand 13. In: J. Immunol. 173, 4889–4896.
Pubmed Zusammenfassung / Pubmed Volltext
Cyster, JG (1999). Chemokine und Zellmigration in sekundären lymphatischen Organen. Wissenschaft 286, 2098-2102.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, EH, Hyman, PL, Tang, HL, Luther, SA und Ngo, VN (2000). Follikuläre Stromazellen und Lymphozyten Homing zu Follikeln. Immunol. Offenbarung 176: 181-193.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J. und Schuh, J. (1999). RANK ist essentiell für die Entwicklung von Osteoklasten und Lymphknoten. Gene Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H. und Ruddle, N. H. (2006). Lymphoide Organentwicklung: von der Ontogenese zur Neogenese. Nat. Immunol. 7, 344–353.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Eberl, G., Marmon, S., Sonnenschein, M. J., Rennert, P. D., Choi, Y., und Littman, D. R. (2004). Eine wesentliche Funktion für den Kernrezeptor RORy (t) bei der Erzeugung von fetalen lymphoiden Gewebeinduktionszellen. Nat. Immunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M. und Kraehenbuhl, J. (2002). CD4 + CD3- Zellen induzieren die Entwicklung von Peyer-Patches: Rolle der α4β1-Integrin-Aktivierung durch CXCR5. Immunität 17, 363-373.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, MS, Collier, AR, Boyd, RL und Turley, SJ (2010). Lymphknotenfibroblastische retikuläre Zellen präsentieren direkt peripheres Gewebeantigen unter stationären und entzündlichen Bedingungen. In: J. Exp. Med. 207, 689–697.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Gretz, J. E., Anderson, A. O. und Shaw, S. (1997). Schnüre, Kanäle, Korridore und Leitungen: Kritische architektonische Elemente, die die Zellinteraktionen im Lymphknotenkortex erleichtern. Immunol. Offenbarung 156, 11-24.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E. und Shaw, S. (2000). Durch Lymphe übertragene Chemokine und andere Moleküle mit niedrigem Molekulargewicht erreichen über spezielle Leitungen hohe Endothelvenolen, während eine funktionelle Barriere den Zugang zu den Lymphozyten-Mikroumgebungen im Lymphknotenkortex einschränkt. In: J. Exp. Med. 192, 1425–1440.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T. und Nishikawa, S.-I. (2001). Molekulare Grundlage für die hämatopoetische / mesenchymale Interaktion während der Initiierung der Peyer-Patch-Organogenese. In: J. Exp. Med. 193, 621–630.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G. und Aguzzi, A. (2005). Lymphotoxin-β-Rezeptor-abhängige Gene in Lymphknoten- und follikulären dendritischen Zelltranskriptomen. In: J. Immunol. 174, 5526–5536.
Pubmed Zusammenfassung / Pubmed Volltext
Kaldjian, EP, Gretz, JE, Anderson, AO, Shi, Y. und Shaw, S. (2001). Räumliche und molekulare Organisation des Lymphknoten-T-Zell-Kortex: Ein labyrinthischer Hohlraum, der von einer Epithel-ähnlichen Monoschicht fibroblastischer retikulärer Zellen begrenzt wird, die an einer basalmembranartigen extrazellulären Matrix verankert sind. Int. Immunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H. und Shimizu, A. (2004a). Lymphknotenfibroblastische retikuläre Zellen konstruieren das Stroma-Retikulum über Kontakt mit Lymphozyten. In: J. Exp. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M. und Shimizu, A. (2004b). Eine neuartige retikuläre Stromastruktur im Lymphknotenkortex: eine Immunplattform für Interaktionen zwischen dendritischen Zellen, T-Zellen und B-Zellen. Int. Immunol. 16, 1133–1142.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S. und Shimizu, A. (2006). Spontane großskalige lymphoide Neogenese und ausgewogene Autoimmunität versus Toleranz im Magen von H + / K + -ATPase-reaktiven TCR-transgenen Mäusen. In: J. Immunol. 177, 7858–7867.
Pubmed Zusammenfassung / Pubmed Volltext
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T. und Shimizu, A. (2008). Organisator-ähnliche retikuläre Stromazellschicht, die erwachsenen sekundären lymphoiden Organen gemeinsam ist. In: J. Immunol. 181, 6189–6200.
Pubmed Zusammenfassung / Pubmed Volltext
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, M. D. und Lane, P. J. (2003). CD4 + CD3- Accessory-Zellen costimulieren primierte CD4-T-Zellen durch OX40 und CD30 an Stellen, an denen T-Zellen mit B-Zellen zusammenarbeiten. Immunität 18, 643-654.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H. und Williams, I. R. (2009). RANKL ist notwendig und ausreichend, um die Entwicklung von Antigen-M-Zellen im Darmepithel zu initiieren. In: J. Immunol. 183, 5738–5747.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. und Miyasaka, M. (1996). Die Milzrandzone fehlt bei alymphoplastischen Aly-mutierten Mäusen. EUR. In: J. Immunol. 26, 669–675.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, AJ, Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, CR, Lacey, DL, Mak, TW, Boyle, WJ und Penninger, JM (1999). OPGL ist ein Schlüsselregulator der Osteoklastogenese, Lymphozytenentwicklung und Lymphknotenorganogenese. Natur 397, 315-323.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Kraehenbuhl, J. P. und Neutra, M. R. (2000). Epitheliale M-Zellen: Differenzierung und Funktion. Jahr. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G. und Luther, S. A. (2007). Fibroblastische retikuläre Zellen in Lymphknoten regulieren die Homöostase naiver T-Zellen. Nat. Immunol. 8, 1255–1265.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R. und Turley, S. J. (2011). Die regulierte Freisetzung von Stickoxid durch nichthämatopoetisches Stroma steuert die Ausdehnung des aktivierten T-Zell-Pools in Lymphknoten. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G. und Cyster, J. G. (2000). Koexpression der Chemokine ELC und SLC durch T-Zonen-Stromazellen und Deletion des ELC-Gens in der plt/plt-Maus. Prok. Natl. Acad. Sci. USA 97, 12694-12699.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Luther, S. A., Ansel, K. M., und Cyster, JG (2003). Überlappende Rollen von CXCL13, Interleukin 7 Rezeptor α und CCR7 Liganden in der Lymphknotenentwicklung. In: J. Exp. Med. 197, 1191–1198.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Mackay, CR (2001). Chemokine: Hohe Einflussfaktoren der Immunologie. Nat. Immunol. 2, 95–101.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J. und das Konsortium des immunologischen Genomprojekts. (2012). Transkriptionelle Profilierung von Stroma aus entzündeten und ruhenden Lymphknoten definiert immunologische Kennzeichen. Nat. Immunol. 13, 499–510.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mebius, R. E., Rennert, P. und Weissman, I. L. (1997). Sich entwickelnde Lymphknoten sammeln CD4 + CD3- LTß + -Zellen, die sich zu APC, NK-Zellen und Follikelzellen, aber nicht zu T- oder B-Zellen differenzieren können. Immunität 7, 493-504.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Mebius, R. E. (2003). Organogenese von lymphatischen Geweben. Nat. In: Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Müller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R. und Matloubian, M. (2007a). Regulation der homöostatischen Chemokinexpression und des Zelltransports während der Immunantwort. Wissenschaft 317, 670-674.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Müller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P. und Ahmed, R. (2007b). Virales Targeting von fibroblastischen retikulären Zellen trägt zur Immunsuppression und Persistenz bei chronischer Infektion bei. Prok. Natl. Acad. Sci. USA 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Müller, S. N. und Germain, R. N. (2009). Stromazelle trägt zur Homöostase und Funktionalität des Immunsystems bei. Nat. In: Rev. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Müller, G., Höpken, U.E., und Lipp, M. (2003). Der Einfluss von CCR7 und CXCR5 auf die Entwicklung lymphoider Organe und die systemische Immunität. Immunol. Offenbarung 195, 117-135.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G. und Mebius, R. E. (2003). Ein Leitungssystem verteilt Chemokine und kleine blutgetragene Moleküle durch die weiße Milzpulpa. In: J. Exp. Med. 198, 505–512.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., und Förster, R. (2003). Kooperierende Mechanismen von CXCR5 und CCR7 bei der Entwicklung und Organisation sekundärer lymphoider Organe. In: J. Exp. Med. 197, 1199–1204.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A. und von Andrian, U. H. (2001). Entzündlicher Chemokintransport und Präsentation in HEV: ein Fernsteuerungsmechanismus für die Rekrutierung von Monozyten in Lymphknoten in entzündeten Geweben. In: J. Exp. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Phan, T. G., Grün, J. A., Grau, E. E., Xu, Y., und Cyster, J. G. (2009). Immunkomplexrelais durch subkapsuläre Sinusmakrophagen und nichtkognate B-Zellen treibt die Reifung der Antikörperaffinität voran. Nat. Immunol. 10, 786–793.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Roozendaal, R., Mempel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H. und Carroll, M. C. (2009). Leitungen vermitteln den Transport von niedermolekularem Antigen zu Lymphknotenfollikeln. Immunität 30, 264-276.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Roozendaal, R. und Mebius, R. E. (2011). Wechselwirkungen zwischen Stromazellen und Immunzellen. Jahr. In: Rev. Immunol. 29, 23–43.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T. und Ludewig, B. (2008). Wiederherstellung der Integrität lymphoider Organe durch Wechselwirkung lymphoider gewebeinduzierender Zellen mit Stroma der T-Zell-Zone. Nat. Immunol. 9, 667–675.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., und Sorokin, L. (2005). Das Leitungssystem transportiert lösliche Antigene von der afferenten Lymphe zu residenten dendritischen Zellen im T-Zell-Bereich des Lymphknotens. Immunität 22, 19-29.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Steinman, R. M., Pack, M. und Inaba, K. (1997). Dendritische Zellen in den T-Zellbereichen lymphoider Organe. Immunol. Offenbarung 156, 25-37.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
St John, A. L., und Abraham, S. N. (2009). Salmonellen stören die Lymphknotenarchitektur durch TLR4-vermittelte Unterdrückung homöostatischer Chemokine. Nat. Med. 15, 1259–1265.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W. und Fagarasan, S. (2010). Die Erfassung von Umweltreizen durch follikuläre dendritische Zellen fördert die Immunglobulin-A-Generation im Darm. Immunität 33, 71-83.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Szabo, M. C., Butcher, E. C. und McEvoy, L. M. (1997). Spezialisierung von schleimhautfollikulären dendritischen Zellen durch Schleimhautadressin-Zelladhäsionsmolekül-1-Anzeige. In: J. Immunol. 158, 5584–5588.
Pubmed Zusammenfassung / Pubmed Volltext
Szakal, A. K., Holmes, K. L., und Tew, J. G. (1983). Transport von Immunkomplexen aus dem Sinus subcapsularis zu Lymphknotenfollikeln auf der Oberfläche nichtphagozytischer Zellen, einschließlich Zellen mit dendritischer Morphologie. In: J. Immunol. 131, 1714–1727.
Pubmed Abstract / Pubmed Full Text
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D. und Gordon, S. (2005). Makrophagenrezeptoren und Immunerkennung. Jahr. In: Rev. Immunol. 23, 901–944.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., und Szakal, A. K. (1997). Follikuläre dendritische Zellen und Präsentation von Antigen- und Costimulationssignalen an B-Zellen. Immunol. Offenbarung 156, 39-52.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A. und Swartz, M. A. (2009). Der Flüssigkeitsfluss reguliert die Stromazellorganisation und die CCL21-Expression in einer gewebetechnischen Lymphknoten-Mikroumgebung. In: J. Immunol. 183, 4273–4283.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J. und Mebius, R. E. (2009). Chemokin CXCL13 ist essentiell für die Lymphknoteninitiierung und wird durch Retinsäure und neuronale Stimulation induziert. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V. und Kioussis, D. (2007). Der Tyrosinkinase-Rezeptor RET ist ein Schlüsselregulator der Peyer-Patch-Organogenese. Natur 446, 547-551.
Pubmed Zusammenfassung | Pubmed Volltext / CrossRef Volltext
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, MB, Rajewsky, K., Pasparakis, M. und Kollias, G. (2006). FDC-spezifische Funktionen von p55TNFR und IKK2 bei der Entwicklung von FDC-Netzwerken und Antikörperantworten. Immunität 24, 65-77.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D. und Chaplin, D. D. (2009). Das Lymphotoxin LTa1ß2 kontrolliert die postnatale und adulte Milz- und Sinusgefäßstruktur und -funktion. Immunität 30, 408-420.
Pubmed Zusammenfassung / Pubmed Volltext / CrossRef Volltext