Idiopathic intracranial hypertension
Assessment | Biopsychology | Comparative |Cognitive | Developmental | Language | Individual differences |Personality | Philosophy | Social |
Methods | Statistics |Clinical | Educational | Industrial |Professional items |World psychology |
Biological:Behavioural genetics · Evolutionary psychology · Neuroanatomy · Neurochemistry · Neuroendocrinology ·Neuroscience · Psychoneuroimmunology · Physiological Psychology · Psychopharmacology(Index, Outline)
MRI brain.jpg|
| ICD-10 | G932 | |
|---|---|---|
| ICD-9 | 348.2 | |
| OMIM | 243200 | |
| Krankheitendb | 1331 | |
| MedlinePlus | 000351 | |
| Emedizin | neuro/329 oph/ 190 neuro/537 | |
| MeSH | {{{MeshNumber}}} | |
Idiopathische intrakranielle Hypertension (IIH), manchmal auch unter den älteren Namen benigne intrakranielle Hypertension (BIH) oder Pseudotumor cerebri (PTC) ist eine neurologische Erkrankung, die durch einen erhöhten intrakraniellen Druck (Druck um die gehirn) in Abwesenheit eines Tumors oder anderer Krankheiten. Die Hauptsymptome sind Kopfschmerzen, Übelkeit und Erbrechen sowie pulsierender Tinnitus (pulsierendes Summen in den Ohren), Doppeltsehen und andere visuelle Symptome. Unbehandelt kann es zu einer Schwellung der Papille im Auge kommen, die zu Sehverlust führen kann.IIH wird mit einem Gehirnscan (um andere Ursachen auszuschließen) und einer Lumbalpunktion diagnostiziert; Lumbalpunktion kann auch vorübergehende und manchmal dauerhafte Linderung der Symptome bieten. Einige reagieren auf Medikamente (mit dem Medikament Acetazolamid), andere erfordern eine Operation, um den Druck zu lindern. Die Erkrankung kann in allen Altersgruppen auftreten, tritt jedoch am häufigsten bei jungen Frauen auf, insbesondere bei Frauen mit Fettleibigkeit.
Anzeichen und Symptome
Das häufigste Symptom von IIH sind Kopfschmerzen, die in fast allen (92-94%) Fällen auftreten. Es ist charakteristisch schlimmer am Morgen, verallgemeinert im Charakter und pochend in der Natur. Es kann mit Übelkeit und Erbrechen verbunden sein. Die Kopfschmerzen können durch jede Aktivität, die den Hirndruck weiter erhöht, wie Husten und Niesen, verschlimmert werden. Die Schmerzen können auch im Nacken und in den Schultern auftreten. Viele haben pulsierenden Tinnitus, ein Rauschen in einem oder beiden Ohren (64-87%); Dieser Ton ist synchron mit dem Puls. Verschiedene andere Symptome, wie Taubheit der Extremitäten, generalisierte Schwäche, Geruchsverlust und Koordinationsstörungen, werden seltener berichtet; keine sind spezifisch für IIH. Bei Kindern können zahlreiche unspezifische Anzeichen und Symptome vorliegen.
Der erhöhte Druck führt zur Kompression und Traktion der Hirnnerven, einer Gruppe von Nerven, die aus dem Hirnstamm entstehen und Gesicht und Hals versorgen. Am häufigsten ist der Abducens-Nerv (sechster Nerv) beteiligt. Dieser Nerv versorgt den Muskel, der das Auge nach außen zieht. Diejenigen mit sechster Nervenlähmung erleben daher horizontale Doppelbilder, die schlimmer sind, wenn sie auf die betroffene Seite schauen. Seltener sind der N. oculomotorius und der N. Trochlea (dritte bzw. vierte Nervenlähmung) betroffen; Beide spielen eine Rolle bei Augenbewegungen. Der Gesichtsnerv (siebter Hirnnerv) ist gelegentlich betroffen – das Ergebnis ist eine vollständige oder teilweise Schwäche der Muskeln des Gesichtsausdrucks auf einer oder beiden Seiten des Gesichts.
Der erhöhte Druck führt zu einem Papillenödem, bei dem die Papille anschwillt, die Stelle, an der der Sehnerv in den Augapfel eindringt. Dies tritt in praktisch allen Fällen von IIH auf, aber nicht jeder hat Symptome davon. Diejenigen, bei denen Symptome auftreten, berichten typischerweise von „vorübergehenden visuellen Verdunkelungen“, Episoden von Sehschwierigkeiten, die in beiden Augen auftreten, aber nicht unbedingt gleichzeitig. Ein langfristig unbehandeltes Papillenödem führt zu einem Sehverlust, zunächst in der Peripherie, aber zunehmend in Richtung Sehzentrum.Die körperliche Untersuchung des Nervensystems ist normalerweise normal, abgesehen vom Vorhandensein eines Papillenödems, das bei der Untersuchung des Auges mit einem kleinen Gerät, einem Ophthalmoskop, oder genauer mit einer Funduskamera beobachtet wird. Wenn es Anomalien des Hirnnervs gibt, können diese bei der Augenuntersuchung in Form eines Schielens (dritte, vierte oder sechste Nervenlähmung) oder als Gesichtsnervenlähmung bemerkt werden. Wenn das Papillenödem seit langem besteht, können die Gesichtsfelder verengt und die Sehschärfe verringert sein. Gesichtsfeldtests durch automatisierte (Humphrey-) Perimetrie werden empfohlen, da andere Testmethoden möglicherweise weniger genau sind. Ein langjähriges Papillenödem führt zu einer Optikusatrophie, bei der die Bandscheibe blass aussieht und der Sehverlust tendenziell fortgeschritten ist.
Ursachen
„Idiopathisch“ bedeutet „unbekannter Ätiologie“. Daher kann IIH nur diagnostiziert werden, wenn es keine alternative Erklärung für die Symptome gibt. Der intrakranielle Druck kann durch Medikamente wie hochdosierte Vitamin-A-Derivate (z. B. Isotretinoin gegen Akne), langfristige Tetracyclin-Antibiotika (für eine Vielzahl von Hauterkrankungen) und hormonelle Kontrazeptiva erhöht werden. Es gibt zahlreiche andere Krankheiten, meist seltene Erkrankungen, die zu intrakranieller Hypertonie führen können. Wenn es eine zugrunde liegende Ursache gibt, wird der Zustand als „sekundäre intrakranielle Hypertonie“ bezeichnet. Häufige Ursachen für sekundäre intrakranielle Hypertonie sind obstruktive Schlafapnoe (eine schlafbedingte Atemstörung), systemischer Lupus Erythematose (SLE), chronische Nierenerkrankung und Morbus Behçet.
Mechanismus
Die Ursache von IIH ist nicht bekannt. Die Monro-Kellie-Regel besagt, dass der intrakranielle Druck (wörtlich: Druck im Schädel) durch die Menge an Hirngewebe, Liquor cerebrospinalis (CSF) und Blut im knöchernen Schädelgewölbe bestimmt wird. Es gibt daher drei Theorien, warum der Druck in IIH erhöht werden könnte: ein Überschuss an Liquorproduktion, erhöhtes Volumen an Blut oder Hirngewebe oder Verstopfung der Venen, die Blut aus dem Gehirn ableiten.
Die erste Theorie, die der erhöhten Produktion von Zerebrospinalflüssigkeit, wurde in frühen Beschreibungen der Krankheit vorgeschlagen. Es gibt jedoch keine experimentellen Daten, die eine Rolle für diesen Prozess in IIH unterstützen.Die zweite Theorie besagt, dass entweder ein erhöhter Blutfluss zum Gehirn oder eine Zunahme des Hirngewebes selbst zu einem erhöhten Druck führen kann. Es haben sich wenig Beweise angesammelt, um den Vorschlag zu unterstützen, dass ein erhöhter Blutfluss eine Rolle spielt, aber sowohl Biopsieproben als auch verschiedene Arten von Gehirnscans haben einen erhöhten Wassergehalt des Hirngewebes gezeigt. Es bleibt unklar, warum dies der Fall sein könnte.
Die dritte Theorie legt nahe, dass der Blutfluss aus dem Gehirn beeinträchtigt oder verstopft sein kann. Nur bei einem kleinen Teil der Patienten wurde eine zugrunde liegende Verengung der Hirnhöhlen oder Venen nachgewiesen. Eine Stauung des venösen Blutes kann auf einen allgemein erhöhten Venendruck zurückzuführen sein, der mit Fettleibigkeit in Verbindung gebracht wurde.
Diagnose
Die Diagnose kann aufgrund der Anamnese und Untersuchung vermutet werden. Um die Diagnose zu bestätigen und alternative Ursachen auszuschließen, sind mehrere Untersuchungen erforderlich; Weitere Untersuchungen können durchgeführt werden, wenn die Anamnese nicht typisch ist oder der Patient eher ein alternatives Problem hat: Kinder, Männer, ältere Menschen oder Frauen, die nicht übergewichtig sind.
Untersuchungen
Neuroimaging, meist mit Computertomographie (CT/CAT) oder Magnetresonanztomographie (MRT), schließt Massenläsionen aus. In IIH können diese Scans normal sein, obwohl kleine oder schlitzartige Ventrikel und „leeres Sella-Zeichen“ (Abflachung der Hypophyse aufgrund von erhöhtem Druck) gesehen werden können. In allen Fällen (oder nach Ansicht einiger Experten nur in atypischen Fällen) wird auch ein MR-Venogramm durchgeführt, um die Möglichkeit einer venösen Obstruktion oder einer zerebralen venösen Sinusthrombose auszuschließen.
Die Lumbalpunktion wird durchgeführt, um den Öffnungsdruck zu messen und Liquor cerebrospinalis (CSF) zu erhalten, um alternative Diagnosen auszuschließen. Wenn der Öffnungsdruck erhöht wird, kann der Liquor zur Entlastung entfernt werden (siehe unten). Der Liquor wird auf abnormale Zellen, Glukose- und Proteinspiegel untersucht; In IIH liegen alle innerhalb normaler Grenzen. Gelegentlich kann die Druckmessung trotz sehr suggestiver Symptome normal sein. Dies kann darauf zurückzuführen sein, dass der Liquordruck im Laufe des Tages schwanken kann. Wenn der Verdacht hoch bleibt, kann es notwendig sein, eine längere Überwachung des ICP durch einen Druckkatheter durchzuführen.
Klassifizierung
Die ursprünglichen Kriterien für IIH wurden 1937 von Dandy beschrieben.
1ZEICHEN & Symptome eines erhöhten ICP – CSF-Drucks >25 cmH2O
2Keine lokalisierenden Zeichen mit Ausnahme der Abducens-Lähmung
3normale Liquorzusammensetzung
4Normal zu kleinen (Schlitz-) Ventrikeln bei der Bildgebung ohne intrakranielle Masse
Sie wurden 1985 von Smith modifiziert, um die „modifizierten Dandy-Kriterien“ zu werden. Smith schloss die Verwendung fortschrittlicherer Bildgebung ein: Dandy hatte eine Ventrikulographie benötigt, aber Smith ersetzte dies durch Computertomographie. In einem Papier von 2001 änderten Digre und Corbett die Kriterien von Dandy weiter. Sie fügten die Anforderung hinzu, dass der Patient wach und wachsam ist, da das Koma eine angemessene neurologische Beurteilung ausschließt und den Ausschluss einer venösen Sinusthrombose als zugrunde liegende Ursache erfordert. Darüber hinaus fügen sie die Anforderung hinzu, dass keine andere Ursache für den erhöhten ICP gefunden wird.
1Symptome eines erhöhten intrakraniellen Drucks (Kopfschmerzen, Übelkeit, Erbrechen, vorübergehende visuelle Verdunkelungen oder Papillenödeme)
2Keine lokalisierenden Anzeichen mit Ausnahme der Abducens (sechsten) Nervenlähmung
3Der Patient ist wach und aufmerksam
4normale CT/ MRT-Befunde ohne Anzeichen einer Thrombose
5LP Öffnungsdruck von >25 cmH2O und normale biochemische und zytologische Zusammensetzung des Liquors
6keine andere Erklärung für den erhöhten intrakraniellen Druck
In a 2002 review, Friedman und Jacobson schlagen eine alternative Reihe von Kriterien, abgeleitet von Smith. Diese erfordern das Fehlen von Symptomen, die nicht durch eine Diagnose von IIH erklärt werden konnte, aber nicht die tatsächliche Anwesenheit von Symptomen (wie Kopfschmerzen) zurückzuführen auf IIH erfordern. Diese Kriterien erfordern auch, dass die Lumbalpunktion bei seitlich liegendem Patienten durchgeführt wird, da eine in aufrechter Sitzposition durchgeführte Lumbalpunktion zu künstlich hohen Druckmessungen führen kann. Friedman und Jacobson bestehen auch nicht für jeden Patienten auf MR-Venographie; vielmehr ist dies nur in atypischen Fällen erforderlich (siehe oben „Diagnose“).
Behandlung
Das primäre Ziel bei der Behandlung von IIH ist die Vorbeugung von Sehverlust und Blindheit sowie die Symptomkontrolle. IIH wird hauptsächlich durch die Verringerung des Liquordrucks und gegebenenfalls durch Gewichtsverlust behandelt. IIH kann nach der Erstbehandlung abklingen, in eine spontane Remission übergehen (obwohl sie zu einem späteren Zeitpunkt noch rückfällig werden kann) oder chronisch anhalten.
Lumbalpunktion
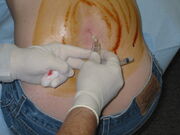
Eine Lumbalpunktion wird durchgeführt. Ein großer Bereich auf der Rückseite wurde mit einem Desinfektionsmittel auf Jodbasis gewaschen und hinterlässt eine braune Färbung. In diesem Bild sitzt der Patient aufrecht, was die Durchführung des Verfahrens erleichtern kann, aber jede Messung des Öffnungsdrucks unzuverlässig macht.
Der erste Schritt bei der Symptomkontrolle ist die Drainage von Liquor cerebrospinalis durch Lumbalpunktion. Bei Bedarf kann dies gleichzeitig mit einer „diagnostischen“ LP durchgeführt werden. In einigen Fällen reicht dies aus, um die Symptome zu kontrollieren, und es ist keine weitere Behandlung erforderlich.Das Verfahren kann bei Bedarf wiederholt werden, aber dies wird im Allgemeinen als Hinweis darauf genommen, dass zusätzliche Behandlungen erforderlich sein können, um die Symptome zu kontrollieren und das Sehvermögen zu erhalten; Wiederholte LPs werden von Patienten als unangenehm angesehen. Wiederholte LPs sind manchmal erforderlich, um den ICP dringend zu kontrollieren, wenn sich das Sehvermögen schnell verschlechtert.
Medikamente
Die am besten untersuchte medizinische Behandlung ist Acetazolamid (Diamox), das das Enzym Carboanhydrase hemmt und die Liquorproduktion um sechs bis 57 Prozent reduziert. Es kann die Symptome einer Hypokaliämie (niedriger Kaliumspiegel im Blut) verursachen, zu denen Muskelschwäche und Kribbeln in den Fingern gehören. Acetazolamid kann nicht in der Schwangerschaft angewendet werden, da es in Tierversuchen embryonale Anomalien verursacht hat, und es wurde gezeigt, dass es beim Menschen metabolische Azidose sowie Störungen des Blutelektrolytspiegels beim Neugeborenen verursacht. Das Diuretikum Furosemid wird manchmal verwendet, wenn Acetazolamid nicht vertragen wird, aber dies hat wenig Einfluss auf den ICP.
Verschiedene Analgetika (Schmerzmittel) können zur Kontrolle der Kopfschmerzen eingesetzt werden. Neben herkömmlichen Wirkstoffen wie Paracetamol haben eine niedrige Dosis des Antidepressivums Amitriptylin sowie das Antikonvulsivum Topiramat einen zusätzlichen Nutzen für die Schmerzlinderung gezeigt.
Die Verwendung von Steroiden zur Verringerung des ICP ist umstritten; Sie können bei schweren Papillenödemen eingesetzt werden, ansonsten wird von ihrer Verwendung abgeraten.
Chirurgie
Bei der Behandlung von IIH gibt es zwei chirurgische Hauptverfahren: Dekompression der Sehnervenscheide sowie Fenestrierung und Shunting. Eine Operation würde normalerweise nur angeboten, wenn die medikamentöse Therapie entweder erfolglos ist oder nicht toleriert wird. Die Wahl zwischen diesen beiden Verfahren hängt vom vorherrschenden Problem in IIH ab. Keines der Verfahren ist perfekt: Beide können erhebliche Komplikationen verursachen, und beide können schließlich bei der Kontrolle der Symptome versagen. Es gibt keine randomisierten kontrollierten Studien, um die Entscheidung zu treffen, welches Verfahren am besten ist.
Die Sehnervenscheidenfensterung ist eine ophthalmologische Operation, bei der ein Schnitt in die Bindegewebsauskleidung des Sehnervs in seinem Teil hinter dem Auge vorgenommen wird. Es ist nicht ganz klar, wie es das Auge vor dem erhöhten Druck schützt, aber es kann das Ergebnis einer Ablenkung des Liquors in die Umlaufbahn oder der Schaffung eines Bereichs von Narbengewebe sein, der den Druck senkt. Die Auswirkungen auf den intrakraniellen Druck selbst sind bescheidener. Darüber hinaus kann das Verfahren zu erheblichen Komplikationen führen, einschließlich Blindheit in 1-2%. Das Verfahren wird daher hauptsächlich bei Personen empfohlen, die nur begrenzte Kopfschmerzsymptome, aber ein signifikantes Papillenödem oder ein bedrohtes Sehvermögen aufweisen, oder bei Personen, die sich einer erfolglosen Behandlung mit einem Shunt unterzogen haben oder eine Kontraindikation für eine Shuntoperation haben.Shunt-Chirurgie, in der Regel von Neurochirurgen durchgeführt, beinhaltet die Schaffung einer Leitung, durch die LIQUOR in eine andere Körperhöhle abgelassen werden kann. Das anfängliche Verfahren ist in der Regel ein lumboperitonealer (LP) Shunt, der den Subarachnoidalraum in der Lendenwirbelsäule mit der Peritonealhöhle verbindet. Im Allgemeinen ist ein Druckventil in der Schaltung enthalten, um eine übermäßige Drainage zu vermeiden, wenn der Patient aufrecht steht und daher einen relativ hohen ICP aufweist. LP-Shunting bietet in etwa der Hälfte der Fälle eine langfristige Linderung; Andere erfordern eine Revision des Shunts, oft mehr als einmal – in der Regel aufgrund einer Shunt—Obstruktion. Wenn der lumboperitoneale Shunt wiederholt revidiert werden muss, kann ein ventrikuloatrialer oder ventrikuloperitonealer Shunt in Betracht gezogen werden. Diese Shunts werden normalerweise durch stereotaktische Chirurgie in einen der Seitenventrikel des Gehirns eingeführt und dann entweder mit dem rechten Vorhof des Herzens bzw. der Peritonealhöhle verbunden. Angesichts des verringerten Revisionsbedarfs bei ventrikulären Shunts ist es möglich, dass dieses Verfahren zum First-Line-Typ der Shunt-Behandlung wird.
Bei schwerer Adipositas hat sich gezeigt, dass eine Magenbypass-Operation zu einer deutlichen Verbesserung der Symptome führt.
Prognose
Es ist nicht bekannt, wie viel Prozent der Menschen mit IIH spontan remittieren und wie viel Prozent chronische Krankheiten entwickeln.
IIH hat normalerweise keinen Einfluss auf die Lebenserwartung. Die Hauptkomplikationen von IIH entstehen durch unbehandeltes oder behandlungsresistentes Papillenödem. In verschiedenen Fallserien wird berichtet, dass das langfristige Risiko einer signifikanten Beeinträchtigung des Sehvermögens durch IIH zwischen 10 und 25% liegt.
Epidemiologie
Die Inzidenz von IIH wird stark von Geschlecht und Körpergewicht bestimmt. Die Zahlen bei Frauen liegen bei Frauen zwischen 20 und 45 Jahren.
Im Durchschnitt tritt IIH bei etwa 1 pro 100.000 Menschen auf und kann bei Kindern und Erwachsenen auftreten. Das Durchschnittsalter bei der Diagnose beträgt 30 Jahre. IIH tritt vorwiegend bei Frauen auf, insbesondere im Alter von 20 bis 45 Jahren, die vier- bis achtmal häufiger betroffen sind als Männer. Übergewicht und Adipositas prädisponieren eine Person stark für IIH: frauen, die mehr als zehn Prozent über ihrem idealen Körpergewicht liegen, entwickeln dreizehnmal häufiger IIH, und diese Zahl steigt bei Frauen, die mehr als zwanzig Prozent über ihrem idealen Körpergewicht liegen, auf das Neunzehnfache. Bei Männern besteht diese Beziehung auch, aber der Anstieg ist nur fünffach bei denen über 20% über ihrem idealen Körpergewicht.
Trotz mehrerer Berichte über IIH in Familien gibt es keine bekannte genetische Ursache für IIH. Menschen aller Ethnien können IIH entwickeln. Bei Kindern gibt es keinen Unterschied in der Inzidenz zwischen Männern und Frauen.Aus den nationalen Krankenhauseintrittsdatenbanken geht hervor, dass der Bedarf an neurochirurgischen Eingriffen für IIH im Zeitraum zwischen 1988 und 2002 deutlich zugenommen hat. Dies wurde zumindest teilweise auf die steigende Prävalenz von Fettleibigkeit zurückgeführt, obwohl ein Teil dieses Anstiegs durch die zunehmende Beliebtheit des Rangierens gegenüber der Sehnervenscheidenfensterung erklärt werden kann.
Geschichte
Der erste Bericht der IIH stammt von dem deutschen Arzt Heinrich Quincke, der sie 1893 unter dem Namen seröse Meningitis beschrieb. Der Begriff „Pseudotumor cerebri“ wurde 1904 von seinem Landsmann Max Nonne eingeführt. Zahlreiche weitere Fälle tauchten später in der Literatur auf; in vielen Fällen kann der erhöhte Hirndruck tatsächlich auf Grunderkrankungen zurückzuführen sein. Zum Beispiel kann der vom Londoner Neurologen Sir Charles Symonds berichtete otitische Hydrozephalus auf eine venöse Sinusthrombose zurückzuführen sein, die durch eine Mittelohrentzündung verursacht wurde. Diagnostische Kriterien für IIH wurden 1937 vom Baltimore-Neurochirurgen Walter Dandy entwickelt; Dandy führte auch eine subtemporale dekompressive Operation bei der Behandlung der Erkrankung ein.
Die Begriffe „gutartig“ und „Pseudotumor“ leiten sich von der Tatsache ab, dass ein erhöhter Hirndruck mit Hirntumoren assoziiert sein kann. Bei den Patienten, bei denen kein Tumor gefunden wurde, wurde daher ein „Pseudotumor cerebri“ (eine Erkrankung, die einen Hirntumor nachahmt) diagnostiziert. Die Krankheit wurde 1955 in „benigne intrakranielle Hypertonie“ umbenannt, um sie von der intrakraniellen Hypertonie aufgrund lebensbedrohlicher Krankheiten (wie Krebs) zu unterscheiden; dies wurde jedoch auch als irreführend empfunden, da jede Krankheit, die jemanden blind machen kann, nicht als gutartig angesehen werden sollte, und der Name wurde daher 1989 in „idiopathische (ohne erkennbare Ursache) intrakranielle Hypertonie“ geändert.
Die Shunt-Chirurgie wurde 1949 eingeführt; Anfangs wurden ventrikuloperitoneale Shunts verwendet. Im Jahr 1971 wurden gute Ergebnisse mit lumboperitonealem Shunt berichtet. Negative Berichte über das Rangieren in den 1980er Jahren führten zu einer kurzen Zeit (1988-1993), in der die Sehnervenfensterung (die ursprünglich 1871 in einem nicht verwandten Zustand beschrieben worden war) populärer war. Seitdem wird mit gelegentlichen Ausnahmen überwiegend Rangieren empfohlen.
Siehe auch
- Hypertonie
- 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 Binder DK, Horton JC, Lawton MT, McDermott MW (März 2004). Idiopathische intrakranielle Hypertonie. Neurochirurgie 54 (3): 538-51; Diskussion 551-2.
- Sismanis A (Juli 1998). Pulsierender Tinnitus. 15 Jahre Erfahrung. Am J Otol 19 (4): 472-7.
- 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Soler D, Cox T, Bullock P, Calver DM, Robinson RO (Januar 1998). Diagnose und Behandlung von gutartiger intrakranieller Hypertonie. Bogen. Dis. Kind. 78 (1): 89–94.
- 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Friedman DI, Jacobson DM (2002). Diagnostische Kriterien für idiopathische intrakranielle Hypertension. Neurologie 59 (10): 1492-1495.
- 5,00 5,01 5,02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 Acheson JF (2006). Idiopathic intracranial hypertension and visual function. Br. Med. Bull. 79-80 (1): 233–44.
- 6.0 6.1 6.2 Dandy WE (October 1937). Intracranial pressure without brain tumor – diagnosis and treatment. Ann. Surg. 106 (4): 492–513.
- Smith JL (1985). Whence pseudotumor cerebri?. J. Clin. Neuroophthalmol. 5 (1): 55–6.
- 8.0 8.1 Digre KB, Corbett JJ (2001). Idiopathic intracranial hypertension (pseudotumor cerebri): A reappraisal. Neurologist 7: 2–67.
- Curry WT, Butler WE, Barker FG (2005). Schnell steigende Inzidenz von Liquor-Shunt-Verfahren für idiopathische intrakranielle Hypertension in den Vereinigten Staaten, 1988-2002. Neurochirurgie 57 (1): 97-108; Diskussion 97-108.
- Quincke HALLO (1893). Meningitis serosa. Samml. Klin. Vortr. 67: 655.
- Nonne M (1904). Über Fälle vom Symptomkomplex „Tumor Cerebri“ mit Ausgang in Heilung (Pseudotumor Cerebri). Dtsch. Z. Nervenheilk. 27 (3-4): 169–216.
- 12,0 12,1 12,2 Johnston ich (2001). Die historische Entwicklung des Pseudotumor-Konzepts. Neurochirurgie. Fokus 11 (2): 1.
- Symonds CP (1931). Otitischer Hydrozephalus. Gehirn 54 (3705): 55-71. (1955). Gutartige Formen der intrakraniellen Hypertonie; toxischer und otitischer Hydrozephalus. Kapitel 78 (1): 1-41.
- Corbett JJ, Thompson HS (Oktober 1989). Das rationale Management der idiopathischen intrakraniellen Hypertonie. Bogen. Neurol. 46 (10): 1049–51. In: Bandyopadhyay S (2001). Pseudotumor cerebri. Bogen. Neurol. 58 (10): 1699–701.
- Idiopathic intracranial hypertension at the Open Directory Project
|
v·d·e
Nervous system disorders, primarily CNS (G04–G47, 323–349) |
||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inflammation |
|
Both/either
|
||||||||||||||||||||||
| Brain/ encephalopathy |
|
|||||||||||||||||||||||
| Spinal cord/ myelopathy |
Syringomyelia · Syringobulbia · Morvan’s syndrome · Vascular myelopathy (Foix-Alajouanine syndrome) · Spinal cord compression |
|||||||||||||||||||||||
| Both/either |
|
|
||||||||||||||||||||||
| {| class=“navbox collapsible nowraplinks“ style=“margin:auto; „ | ||||||||||||||||||||||||
|
··
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|}
This page uses Creative Commons Licensed content from Wikipedia (view authors).