Kardiomyopathie bei Patienten mit Marfan-Syndrom und Marfanoid Habitus
Ekaterina Luneva MD,PhD*, Eduard Malev MD, PhD1,2, Alexandra Korshunova MD1,2, Svetlana Reeva MD, PhD1,2, Eugeniy Timofeev MD, PhD1,2 und Eduard Zemtsovsky Prof, MD, PhD1,2 1 Abteilung für Bindegewebserkrankungen, Almazov North-West Federal Medical Research Centre, Sankt Petersburg, Russland
2 Abteilung für Propädeutik der inneren Krankheiten, Staatliche Pädiatrische Medizinische Universität, Sankt Petersburg, Russland
*Korrespondenz:Ekaterina Luneva, MD, PhD,Almazov North-West Federal Medical Research Centre,2 Akkuratova str., Sankt-Petersburg, 197341,Russland,Tel: +7-8127023749,Fax: +7-8127023744, E-Mail:
Empfangsdatum: 29. Dezember 2016 / Akzeptiertes Datum: 17. März 2017 / Veröffentlichungsdatum: 20. März 2017
Zitat: Lunev E, Malev E, Korshunova A, et al. Kardiomyopathie bei Patienten mit Marfan-Syndrom und Marfanoid-Habitus. Curr Res Cardiol 2017;4(1): 138-42.
Dieser Open-Access-Artikel wird unter den Bedingungen der Creative Commons Attribution Non-Commercial License (CC BY-NC) (http://creativecommons.org/licenses/by-nc/4.0/) vertrieben, die die Wiederverwendung, Verbreitung und Reproduktion des Artikels erlaubt, sofern das Originalwerk ordnungsgemäß zitiert wird und die Wiederverwendung auf nichtkommerzielle Zwecke beschränkt ist. Für die kommerzielle Wiederverwendung kontaktieren Sie
Abstract
ZIELE: Der Begriff „Marfan-Kardiomyopathie“ wird verwendet, um Änderungen der linksventrikulären Funktion in Abwesenheit einer signifikanten Klappenpathologie beim Marfan-Syndrom anzuzeigen. Es ist noch nicht bekannt, ob bei Patienten mit ähnlichen Bindegewebsanomalien wie dem Marfanoid-Habitus Veränderungen der Herzfunktion auftreten.
METHODEN: An der Studie nahmen 98 Personen teil – 8 Patienten mit Marfan-Syndrom, 24 mit Marfanoid-Habitus und 66 gesunde Probanden. Bei allen Patienten wurde eine Echokardiographie durchgeführt. Speckle-Tracking-Echokardiographie wurde verwendet, um die linksventrikulären Deformationsindizes zu bewerten. Die Konzentrationen des transformierenden Wachstumsfaktors-β1 und -β2 im Serum wurden durch einen enzymgebundenen Immunosorbens-Assay bestimmt.
ERGEBNISSE: Die systolische linksventrikuläre Funktion war in der Marfan-Syndrom-Gruppe signifikant niedriger; In der MS-Gruppe wurde im Vergleich zur Kontrollgruppe eine Verschlechterung der longitudinalen linksventrikulären Belastung festgestellt. Bei marfanoiden Habitus-Probanden fanden wir eine signifikante Abnahme der Umfangsdehnung im interventrikulären Septum und in der unteren Wand. die Serumspiegel der transformierenden Wachstumsfaktoren β1 und β2 waren bei Patienten mit Marfan-Syndrom erhöht. Die Erhöhung des transformierenden Wachstumsfaktors β1 war im Gegensatz zum transformierenden Wachstumsfaktor β2 in der Marfanoid-Habitusgruppe statistisch nicht signifikant. Negative Korrelationen zwischen dem Serumspiegel des transformierenden Wachstumsfaktors β2 und der systolischen radialen Belastung in der Marfanoid-Habitus-Gruppe wurden ebenfalls gefunden.
FAZIT: Eine Verschlechterung der regionalen Myokarddeformation kann das erste Anzeichen für eine Verschlechterung der linksventrikulären systolischen Funktion und das Vorliegen einer primären Kardiomyopathie bei asymptomatischen Marfanoid-Habituspatienten sein, die ihre Langzeitprognose beeinflussen und durch eine erhöhte Signalisierung des transformierenden Wachstumsfaktors β verursacht werden können.
Schlüsselwörter
Marfan-Syndrom; Marfanoid-Habitus; Kardiomyopathie; Linksventrikuläre systolische Funktion; Myokarddeformation; Transformierender Wachstumsfaktor-β
MS ist eine der häufigsten erblichen Störungen des Bindegewebes.Im Bereich der MS-Komplikationen sind Aortenaneurismus, Mitralklappenprolaps und Myokarddysfunktion (1). MS-Manifestationen verursachtdurch Mutationen von Fibrillin-1, einer strukturellen Komponente der extrazellulären Matrix,und auch Verletzung der Regulation des transformierenden Wachstumsfaktors-β. Eine Reihe von Studien (2,3) zeigten, dass eine übermäßige Aktivierung des TGF-β-Signalwegs der Hauptgrund für die Beeinträchtigung der LV-Funktion und der Aortapathologie bei MS ist. Eine Verschlechterung der systolischen und diastolischen Funktion und eine Vergrößerung der LV-Dimensionen wurde bei Patienten mit MS in Bezug auf das Fehlen einer hämodynamischen Überlastung aufgrund von Mitral- oder Aorteninsuffizienz bei Vorhandensein von Mitralklappenprolaps oder Aortendilatation festgestellt. Der Begriff „Marfancardiomyopathie“ wird verwendet, um Änderungen der linksventrikulären Funktion in anzuzeigendas Fehlen einer signifikanten Klappenpathologie bei MS (4,5). Trotz der Tatsache, dasskardiomyopathie bei MS ist gut untersucht, es ist noch nicht bekannt, ob es Veränderungen in der Herzfunktion bei Patienten mit ähnlichen Bindegewebsanomalien wie Marfanoid Habitus. marfanoid Habitus umfasst Arachnodaktylie, Langhände und Füße, erhöhte Hautdehnung, Gelenkhypermobilität und Veränderungen indie Physiologie des Pektus (Tabelle 1).
| Messbare Skelettzeichen | Weitere Merkmale des marfanoiden Habitus |
|---|---|
| Arm spanne zu höhe verhältnis > 1.03 | Skoliose von > 5 Grad |
| Verhältnis von Handlänge zu Höhe > 11% | Pectus-Deformitäten (excavatum oder carinatum) |
| Verhältnis von Fußlänge zu Höhe > 15% | Kieferdeformitäten mit Überfüllung der Zähne |
| Verhältnis von Oberkörpersegment zu Unterkörpersegment < 0.89 | Hoch gewölbter Gaumen |
| Lange Füße (oft mit Hammerzehen), die sich beim Tragen abflachen und pronieren |
Tabelle 1: Marfanoide Habituskriterien
Marfanoid Merkmale sind in mehreren vererbbaren Störungen der connectivetissue, imitiert einige der Veränderungen des Marfan-Syndroms, aber notaccompanied durch Luxation der Linse, und Aneurysma der Aorta. Unvollständige Formen des marfanoiden Habitus sind alltäglich und wahrscheinlich gutartig; ihre Anwesenheit sollte jedoch eine Bewertung für ein anderes Merkmal erblicher Bindegewebserkrankungen auslösen (6).
In diesem Artikel untersuchten wir die morphologischen und funktionellen Eigenschaften des LV bei Patienten mit MS und marfanoidem Habitus.
Materialien und Methoden
In der Studie wurden 98 Personen eingeschlossen, 8 von ihnen waren Patienten mit MS, 24patienten mit Marfanoid Habitus und 66 gesunde Probanden.
Patienten mit MS wurden im Almazov Federal Centre regelmäßig überwacht.Die Diagnose MS wurde nach Gent-Kriterien gestellt (7). Mutationen offibrillin-1 nicht Bildschirm für diese Studie. Die Patienten hatten keine signifikante (mehrals leichte) Mitral- oder Aorteninsuffizienz. Probanden mit marfanoidem Habitus wurden von Patienten mit nicht bestätigter MS ausgescreent und haben keine Anzeichen von Aortenaneurismus und Linsensubluxation. Tabelle 1 stellt marfanoide Habituskriterien nach Grahame R, et al. (6). Kontrollgruppe bestand ausgesunde Studenten der Pädiatrischen Medizinischen Universität.
Die Echokardiographie wurde bei allen Patienten von einem erfahrenen Echokardiographen unter Verwendung eines Vivid 7-Ultraschallsystems (GE Healthcare) durchgeführt, das mit einem harmonischen 3,5-Hz-Phased-Array-Wandler ausgestattet war und eine Bewertung der Abmessungen der Herzkammern und der systolischen Funktion von LV beinhaltete, gemessen nach der Simpson-Doppeldeckerregel. Standard 2-dimensionale transthoracicechocardiographic Aufnahmen wurden verwendet, um linksventrikulär als LV enddiastolicdiameter zu beurteilen, um rechten Ventrikel als rechten Ventrikel Enddiastolicdiameter zu beurteilen, für linke Vorhöfe verwendeten wir linken artia Durchmesser nach currentguideline (8). Zusätzlich verwendeten wir Speckle Tracking Echokardiographiezur Beurteilung der linksventrikulären Deformationsindizes (Dehnung und Dehnungsrate) (9). Die Längsdehnung wird aus apikalen 4-, 3- und 2-Kammerbildern erhalten. Radiale und umlaufende Dehnungen wurden aus LV-Kurzaxiebildern auf der Ebene der Mitralklappe, der Papillarmuskeln und des Apex erhalten.Die Bildanalyse wurde offline auf einer EchoPAC’08 Workstation (GE Healthcare) durchgeführt. Der LV war in 18 Segmente unterteilt. Die Dehnungsrate wurde als maximaler negativer Wert während der Auswurfphase bestimmt.Die maximale systolische Dehnung wurde als die Größe der Dehnung am Aortenklappenverschluss definiert. Die maximale longitudinale frühe diastolische Füllungsdehnungsrate wurde ebenfalls gemessen.
Wir bewerten biologisch aktive transformierende Wachstumsfaktor-β1- und -β2-Proteinkonzentrationen aus EDTA-Blutproben unter Verwendung von Standardverfahren durch enzymgebundene Immunosorbens-Assays unter Verwendung des Human Platinum ELISAtest-Systems (Bender MedSysteMarfan syndrome Diagnostics GmbH, Wien, Österreich). Die Inter-Assay- und Intra-Assay-Variationen betrugen 8% bzw. 6%. Die Empfindlichkeit betrug 5 pg/ml.
Statistische Analyse
Alle Daten werden als Mittelwert ± Standardabweichung dargestellt. Die Signifikanz der Unterschiede zwischen quantitativen Merkmalen wurde mit dem Student’s t-Test bestimmt, zwischen kleinen Stichproben und qualitativen Merkmalen, die mit nichtparametrischen Methoden bestimmt wurden: Fisher’s exact test oder Chi-Quadrat-Test (p<0.05). Therelationship zwischen Paaren von kontinuierlichen Variablen wurde durch thePearson Korrelation ausgedrückt. Effektgrößen für Verformungsindizes wurden mit Cohens d unter Verwendung von Mittelwerten und Standardabweichungen gemessen. Statistische Signifikanzwurde auf p<0.05 gesetzt. Alle statistischen Analysen wurden mit Statistica 10software (StatSoft, Inc.).
Ergebnisse
Merkmale der in die Studie eingeschlossenen Patienten sind in Tabelle 2 dargestellt.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| Sex, female/male | 0/8 | Jan-23 | 42/24 | (1-2) р=0.55 |
| (1-3) р=0.0006 | ||||
| (2-3) р=0.00001 | ||||
| Age, years | 28 ± 9.2 | 22 ± 3.4 | 20 ± 1.8 | (1-2) 0,01 |
| (1-3) 0,0001 | ||||
| (2-3) 0,0005 | ||||
| Höhe, m | 186 ± 12 | 181 ± 9.1 | 170 ± 8.4 | (1-2) 0,22 |
| (1-3) 0,00001 | ||||
| (2-3) 0,00001 | ||||
| Gewicht, kg | 71 ± 26 | 62 ± 9.7 | 61 ± 9.5 | (1-2) 0,16 |
| (1-3) 0,03 | ||||
| (2-3) 0.66 | ||||
| Kriterien für das Marfan-Syndrom | ||||
| Aortendurchmesser an den Nasennebenhöhlen von Valsalva über Z-Score 2 oder Aortenwurzeldissektion, n (%) | 5 (63%) | 0 (0%) | 0 (0%) | (1-2) 0,008 |
| (1-3) 0,008 | ||||
| (2-3) 1,0 | ||||
| Ektopische Linsen, n (%) | 3 (38%) | 0 (0%) | 0 (0%) | (1-2) 0,065 |
| (1-3) 0,065 | ||||
| (2-3) 1.0 | ||||
| Bewertung der systemischen Merkmale des Marfan-Syndroms | ||||
| Handgelenk- UND Daumenzeichen, n (%) | 4 (50%) | 8 (33%) | 0 (0%) | (1-2) 0,41 |
| (1-3) 0,025 | ||||
| (2-3) 0,002 | ||||
| Handgelenk- ODER Daumenzeichen, n (%) | 7 (88%) | 16 (67%) | 0 (0%) | (1-2) 0,38 |
| (1-3) 0,0002 | ||||
| (2-3) <0.00001 | ||||
| Pectus carinatum deformity, n (%) | 7 (88%) | 3 (13%) | 0 (0%) | (1-2) 0.18 |
| (1-3) 0.0003 | ||||
| (2-3) <0.00001 | ||||
| Pectus excavatum or chest asymmetry, n (%) | 4 (50%) | 16 (67%) | 0 (0%) | (1-2) 0.41 |
| (1-3) 0.025 | ||||
| (2-3) <0.00001 | ||||
| Hindfoot deformity or plain pes planus, n (%) | 5 (63%) | 18 (75%) | 7 (11%) | (1-2) 0.5296 |
| (1-3) 0.0166 | ||||
| (2-3) <0.00001 | ||||
| Pneumothorax, n (%) | 0(0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 0.27 | ||||
| Durale Ektasie, n (%) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1,0 |
| (1-3) 1,0 | ||||
| (2-3) 1,0 | ||||
| Protrusio acetabuli, n (%) | 0 (0%) | 0 (0%) | 0 (0%) | (1-2) 1,0 |
| (1-3) 1,0 | ||||
| (2-3) 1.0 | ||||
| Reduzierte US/LS UND erhöhte Arm/Höhe UND keine schwere Skoliose, n (%)* | 2 (25%) | 0 (0%) | 0 (0%) | (1-2) 0,15 |
| (1-3) 0,15 | ||||
| (2-3) 1,0 | ||||
| Skoliose oder thorakolumbale Kyphose, n (%) | 7 (88%) | 23 (96%) | 20 (30%) | (1-2) 0,54 |
| (1-3) 0,0016 | ||||
| (2-3) <0.00001 | ||||
| Reduced elbow extension, n (%) | 1(13%) | 0 (0%) | 0 (0%) | (1-2) 1,0 |
| (1-3) 1,0 | ||||
| (2-3) 1.0 | ||||
| Facial features (3/5)**, n (%) | 6 (75%) | 1 (4%) | 0 (0%) | (1-2) 0.15 |
| (1-3) 0.0018 | ||||
| (2-3) 1.0 | ||||
| Skin striae, n (%) | 0 (0%) | 1 (4%) | 0 (0%) | (1-2) 1.0 |
| (1-3) 1.0 | ||||
| (2-3) 1.0 | ||||
| Myopia > 3 diopters, n (%) | 4 (50%) | 10 (42%) | 8 (12%) | (1-2) 0.69 |
| (1-3) 0.066 | ||||
| (2-3) 0.011 | ||||
| Mitral vaLVe prolapse (all types), n (%) | 2 (25%) | 8 (33%) | 0 (0%) | (1-2) 0.65 |
| (1-3) 0.15 | ||||
| (2-3) 0.002 | ||||
| Systemic features score, points | 8,1 ± 1,2 | 5,4 ± 1,6 | 2,1 ± 0,5 | (1-2) 0.0002 |
| (1-3) <0.00001 | ||||
| (2-3) <0.00001 | ||||
| Kriterien des marfanoiden Habitus*** | ||||
| Skelettale Anzeichen des marfanoiden Habitus | 5 (63%) | 19 (79%) | 5 (8%) | (1-2) 0.41 |
| (1-3) n/a | ||||
| (2-3) <0.00001 | ||||
| Kieferdeformitäten mit Überfüllung der Zähne | 5 (63%) | 14 (58%) | 16 (24%) | (1-2) 0,84 |
| (1-3) 0,07 | ||||
| (2-3) 0.005 | ||||
| Hoch gewölbter Gaumen | 7 (88%) | 12 (50%) | 8 (12%) | (1-2) 0,028 |
| (1-3) 0,0004 | ||||
Tabelle 2: Merkmale der in die Studie eingeschlossenen Patienten
In Gruppen mit MS und Marfanoid-Habitus dominiert.Patienten mit MS waren älter als diejenigen mit marfanoid Habitus andindividuals aus der Kontrollgruppe. Patienten mit MS waren größer alsandere. Im Vergleich zum Marfanoid-Habitus wurden bei Patienten mit DIABETES signifikant häufig systemische Merkmale gefunden. Systemische Merkmale sind erlaubtunterscheidung von MS-Patienten von Marfanoid-Habitus-Patienten. Auf der anderen Seite wurden Marfanoid-Habituskriterien sowohl bei MS- als auch bei Marfanoidhabituspatienten gefunden, erlaubten jedoch eine Trennung des Marfanoid-Habitus von gesunden Personen. Somit ermöglicht das Vorhandensein von Skelettzeichen in Abwesenheit anderer Gent-Kriterien die Überprüfung des Marfanoid-Habitus mit hoher Empfindlichkeit (79%)und Spezifität (91%).
Die Ergebnisse der morphologischen und funktionellen Bewertung des Herzens warenin Tabelle 3 zusammengefasst.
| Marfan syndrome (n=8) | Marfanoid habitus (n=24) | Control group (n=66) | p (Student’s t-test, Fisher’s exact test) | |
| End-diastolic LV diameter, mm | 50.5 ± 4.6 | 46.7 ± 4.54 | 44.1 ± 4.94 | (1-2) 0.012 |
| (1-3) 0.0003 | ||||
| (2-3) 0.027 | ||||
| End-systolic LV diameter, mm | 34.8 ± 3.8 | 29.5 ± 4.9 | 28.4 ± 3.9 | (1-2) 0.005 |
| (1-3) 0.0014 | ||||
| (2-3) 0.33 | ||||
| End-diastolic LV volume, mm | 114.3 ± 12.6 | 98.7 ± 19.2 | 89.3 ± 19.2 | (1-2) 0.019 |
| (1-3) 0.0002 | ||||
| (2-3) 0.046 | ||||
| End-systolic LV volume, mm | 55.2 ± 14.0 | 33.9 ± 12.6 | 33.9 ± 8.9 | (1-2) 0.0028 |
| (1-3) 0.0026 | ||||
| (2-3) 1.0 | ||||
| Ejection fraction, % | 52.8 ± 8.9 | 66.4 ± 7.5 | 67 ± 5.3 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 0.48 | ||||
| Left ventricular mass index, g/m2 | 111.8 ± 31.5 | 78.5 ± 18.9 | 83.7 ± 15.9 | (1-2) 0.027 |
| (1-3) 0.033 | ||||
| (2-3) 0.23 | ||||
| E/A ratio | 1.50 ± 0,47 | 1.53 ± 0.42 | 1.69 ± 0.4 | (1-2) 0,87 |
| (1-3) 0,10 | ||||
| (2-3) 0,48 | ||||
| Enddiastolischer Durchmesser des rechten Ventrikels, мм | 31 ± 7.2 | 23 ± 4.26 | 24 ± 3.13 | (1-2) 0,0006 |
| (1-3) 0,00001 | ||||
| (2-3) 0,23 | ||||
| Durchmesser des linken Vorhofs, мм | 37 ± 4.97 | 30 ± 3.98 | 30 ± 2.99 | (1-2) 0.0003 |
| (1-3) 0.00001 | ||||
| (2-3) 1.0 | ||||
| Aortic diameter at the sinuses of Valsalva, mm | 43.1 ± 15.1 | 30.3 ± 4.5 | 24.0 ± 4.5 | (1-2) 0.0007 |
| (1-3) 0.00001 | ||||
| (2-3) 0.00001 | ||||
| Z-score | 6.86 ± 5.83 | 1.56 ± 0.93 | 1.59 ± 0.17 | (1-2) 0.039 |
| (1-3) 0.038 | ||||
| (2-3) 0.88 | ||||
| Mitral regurgitation grade, none/mild (%) | 0/8 (0/100%) | 6/18 (25/75%) | 24/42 (36/64%) | (1-2) 0.29 |
| (1-3) 0.047 | ||||
| (2-3) 0.44 |
Table 3: Echokardiographische Daten in Studiengruppen
Es gab keinen statistisch signifikanten Unterschied in der Größe des rechten Ventrikels und des linken Vorhofs bei jungen Patienten in der Kontrollgruppe im Vergleich zu Marfanoidhabitu-Patienten, aber erwartungsgemäß unterscheiden sich diese Dimensionen statistisch bei Patienten der MS-Gruppe. Die linksventrikuläre Vergrößerung wurde jedoch nicht nur bei MS-Patienten, sondern auch bei Marfanoid-Habitus-Patienten im Vergleich zur Kontrollgruppe festgestellt.
Wie erwartet war die systolische LV-Funktion in der MS-Gruppe signifikant niedriger, aber es gab keine statistisch signifikanten Unterschiede in der linksventrikulären EFbetween Patienten mit Marfanoid Habitus und Kontrollgruppe. Auch eine Verschlechterung der longitudinalen linksventrikulären Belastung wurde in der MS-Gruppe festgestellt (Belastung: -15,7 ± 0,9% vs. -19,6 ± 3,4%, p = 0,002; Dehnungsrate: -0,94 ± 0,09 s-1 vs. -1,22 ± 0,8 s-1, p = 0,00001). Gleichzeitig wurden bei marfanoiden Habituspatienten keine Veränderungen der globalen Längengrad-, Umfangs- oder Radialdehnung / Dehnungsrate festgestellt (Tabelle 4).
| Walls | Strain / Strain rate | Marfanoid habitus (n=24) | Control group (n=66) | р (Student’s t-test) | |
| Anteroseptal | L | Strain, % | –17.8 ± 4.1 | –18.7 ± 3.4 | 0.34 |
| Strain rate, s-1 | –1.09 ± 0.21 | –1.13 ± 0.2 | 0.42 | ||
| C | Strain, % | –22.9 ± 6.48 | –26.6 ± 4.5 | 0.014 (Cohen’s d = 0.66) | |
| Strain rate, s-1 | –1.64 ± 0.51 | –1.68 ± 0.39 | 0.72 | ||
| R | Strain, % | 41.5 ± 16.6 | 40.7 ± 16.4 | 0.84 | |
| Strain rate, s-1 | 1.79 ± 0.62 | 1.60 ± 0.44 | 0.17 | ||
| Anterior | L | Strain, % | –20.0 ± 4.46 | –19.9 ± 3.3 | 0.92 |
| Strain rate, s-1 | –1.35 ± 0.46 | –1.23 ± 0.26 | 0.24 | ||
| C | Strain, % | –17.2 ± 6.15 | –19.4 ± 4.4 | 0.12 | |
| Strain rate, s-1 | –1.43 ± 0.43 | –1.48 ± 0.39 | 0.61 | ||
| R | Strain, % | 42.6 ± 15.9 | 42.6 ± 17.2 | 1 | |
| Strain rate, s-1 | 1.71 ± 0.60 | 1.66 ± 0.51 | 0.72 | ||
| Anterolateral | L | Strain, % | –18.6 ± 4.52 | –17.3 ± 4.2 | 0.23 |
| Strain rate, s-1 | –1.39 ± 0.35 | –1.24 ± 0.31 | 0.07 | ||
| C | Strain, % | –14.8 ± 5.79 | –15.0 ± 5.1 | 0.88 | |
| Strain rate, s-1 | –1.21 ± 0.43 | –1.28 ± 0.41 | 0.49 | ||
| R | Strain, % | 40.9 ± 14.6 | 43.3 ± 16.7 | 0.51 | |
| Strain rate, s-1 | 1.62 ± 0.63 | 1.63 ± 0.52 | 0.94 | ||
| Inferolateral | L | Strain, % | –19.5 ± 3.8 | –18.4 ± 4.1 | 0.24 |
| Strain rate, s-1 | –1.40 ± 0.32 | –1.28 ± 0.3 | 0.12 | ||
| C | Strain, % | –14.8 ± 6.43 | –16.3 ± 4.8 | 0.31 | |
| Strain rate, s-1 | –1.13 ± 0.46 | –1.21 ± 0.39 | 0.45 | ||
| R | Strain, % | 39.2 ± 14.0 | 42.3 ± 15.3 | 0.37 | |
| Strain rate, s-1 | 1.61 ± 0.53 | 1.64 ± 0.53 | 0.81 | ||
| Inferior | L | Strain, % | –20.6 ± 3.96 | –19.9 ± 3.5 | 0.45 |
| Strain rate, s-1 | –1.27 ± 0.24 | –1.22 ± 0.2 | 0.36 | ||
| C | Strain, % | –16.5 ± 5.73 | –19.8 ± 4.9 | 0.017 (Cohen’s d = 0.62) | |
| Strain rate, s-1 | –1.23 ± 0.38 | –1.28 ± 0.38 | 0.58 | ||
| R | Strain, % | 38.9 ± 11.0 | 41.5 ± 14.3 | 0.36 | |
| Strain rate, s-1 | 1.58 ± 0.47 | 1.57 ± 0.48 | 0.93 | ||
| Inferoseptal | L | Strain, % | –20.5 ± 4.24 | –20.7 ± 3.1 | 0.83 |
| Strain rate, s-1 | –1.20 ± 0.22 | –1.19 ± 0.19 | 0.85 | ||
| C | Strain, % | –22.0 ± 4.42 | –24.4 ± 4.5 | 0.028 (Cohen’s d = 0.53) | |
| Strain rate, s-1 | –1.42 ± 0.43 | –1.49 ± 0.43 | 0.49 | ||
| R | Strain, % | 38.7 ± 11.2 | 40.7 ± 14.6 | 0.49 | |
| Strain rate, s-1 | 1.65 ± 0.53 | 1.56 ± 0.44 | 0.46 | ||
| Global | L | Strain, % | –19.6 ± 3.49 | –19.6 ± 3.4 | 1 |
| Strain rate, s-1 | –1.25 ± 0.23 | –1.22 ± 0.18 | 0.57 | ||
| C | Strain, % | –18.7 ± 4.26 | –20.5 ± 3.7 | 0.08 | |
| Strain rate, s-1 | –1.35 ± 0.36 | –1.39 ± 0.29 | 0.63 | ||
| R | Strain, % | 41.3 ± 11.4 | 41.3 ± 10.9 | 1 | |
| Strain rate, s-1 | 1.67 ± 0.50 | 1.61 ± 0.37 | 0.59 | ||
Table 4: Globale und lokale Dehnung und Dehnungsrate in Marfanoid-Habitus- und Kontrollgruppen
Um subtile Veränderungen der LV-Kontraktilität bei Marfanoid-Habitus-Patienten aufzudecken, wurde die Speckle-Tracking-Analyse verwendet, um die regionale Dehnung der LV-Wände zu bewerten (Tabelle 4). Wir fanden eine signifikante Abnahme der Umfangsdehnung (ansonsten Längs- oder Radialdehnung) im interventrikulären Septum und inferior wallin Marfanoid Habitus Probanden (Abbildung 1) im Vergleich zur Kontrollgruppe mit mittleren Effektgrößen gemessen nach Cohens d (0,53 – 0,66). In anderen LV-Wändenes wurde kein signifikanter Unterschied gefunden. Die diastolische Funktion blieb in allen erhaltenstudiengruppen.

Abbildung 1: Geringe Umfangsdehnung in der inferioren Wand (Pfeil) bei Marfanoid-Habitus-Patienten
Die TGF-β1- und TGF-β2-Serumspiegel waren bei Patienten mit Marfanoidhabitus erhöht (14,2 ± 27.6 und 2.1 ± 1.7 ng/ml, beziehungsweise) und trotzconsiderable Standardabweichung fanden wir bedeutenden Unterschied mit FRAU (44.6 ± 47.3 ng/ml, p=0.03 und 2.7 ± 1.7 ng/ml, p=0.39, beziehungsweise), undKontrolle (8.4 ± 3.5 ng/ml, p=0,09 und 1,2 ± 0,7 ng/ml, p=0,0006) Gruppen (Abbildung 2).
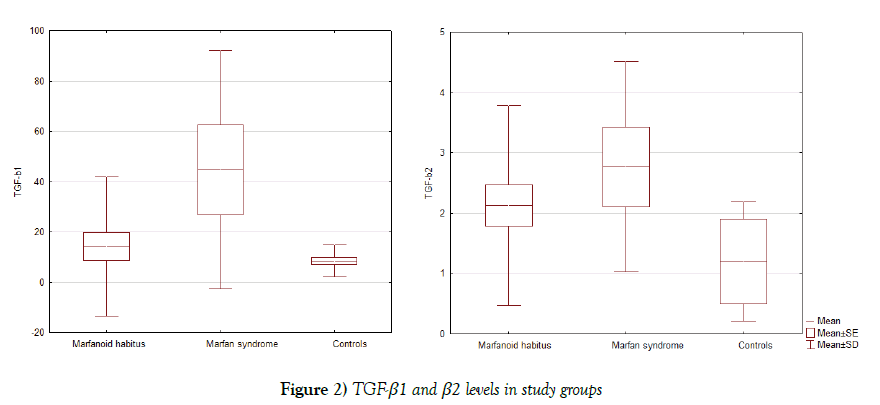
Abbildung 2: TGF-β1- und β2-Spiegel in Studiengruppen
Ein hoher TGF-β1-Serumspiegel (>14,75 ng/ ml) und TGF-β2 (>2,0 ng/ml) bei den meisten Patienten (75%) der MS-Gruppe nachgewiesen.In der Marfanoid-Habitus-Gruppe fanden wir einen hohen TGF-β1-Serumspiegel bei 4 (17%) Patienten und TGF-β2 bei 9 (38%) Patienten, der mehr als kontrolliert ist group.In kontrollgruppe Es gab keine Personen mit erhöhten TGF-ß1-Spiegeln und nur 2 Personen mit hohem TGF-β2-Spiegel.
Zusätzlich haben wir die negativen Korrelationen zwischen dem Serumlevel des transformierenden Wachstumsfaktors β2 und der systolischen radialen Belastung (r = 0,53, p=0,012) in der Marfanoid-Habitus-Gruppe identifiziert. Es gab keine Korrelation zwischen dem GF-β-Spiegel und den Aortendimensionen bei Patienten mit MS und Marfanoidhabitus; es wurde jedoch eine Korrelation zwischen dem TGF-β-Spiegel und den Skelettmerkmalen des marfanoiden Habitus festgestellt – TGF-β2 mit Fußlänge-zu-Höhe-Verhältnis (r = 0,47, p = 0,03), TGF-β1 mit Skoliose (r = 0,72, p = 0,0001). TGF-β1 Serumspiegelauch schwach korreliert mit dem enddiastolischen Volumen (r = 0,42, p = 0,04) und LVMYOKARDMASSE (r = 0,44, p = 0,036).
Diskussion
Die Senkung der globalen LV-Kontraktilität bei Patienten mit MS wurde bereits in mehreren Studien beschrieben (4,5). In unserer Studie fanden wir auch eine Verschlechterung der globalen Kontraktilität und Deformation des LV bei normalen stationären Patienten mit MS. Bei Patienten mit marfanoidem Habitus LV blieb die systolische Funktion erhalten und es wurde nur eine Abnahme der Umfangsdehnung (ansonsten längs oder radial) im interventrikulären Septum und in der unteren Wand festgestellt.
Der marfanoide Habitus ist ein wichtiges gemeinsames Merkmal bei einer Reihe vongenetisch vererbbaren Erkrankungen des Bindegewebssyndroms und ist nicht pathognomonisch von MS (6). Aktuelle Gent- und Marfanoid-Habituskriterien(6,7) ermöglichen es, MS-Patienten in unserer Studie mit hoher Sensitivität und Spezifität von Marfanoid-Habituspatienten zu unterscheiden. Das wichtigste Ergebnis der vorliegenden Untersuchung war, dass die frühe kontraktile Verletzung, die bei Marfanoidhabitu-Patienten mit normaler globaler kontraktiler Funktion beobachtet wurde, regional im LV-Septum und in der unteren Wand verteilt ist. Unseres Wissens ist dies der erste gemeldete Befund eines solchen regionalen kontraktilen Musters, das bei Patienten mit marfanoidem Habitus nachgewiesen wurde. Mehrere Studien zeigten eine regionale kontraktile Dysfunktion bei anderen erblichen Bindegewebsstörungen wie Mitralklappenprolaps (10,11). Bei einigen genetischen Erkrankungen wie der Friedreich-Ataxie, der Fabry-Krankheit oder der Duchenne-Kardiomyopathie treten die ersten regionalen Deformationsveränderungen auch im inferolateralen Segment auf (12).
Derzeit gibt es Daten, die darauf hindeuten, dass eine Beeinträchtigung der Herzfunktion indie MS und ähnliche phänotypische Syndrome haben einen ähnlichen Charakter TGF-ßdysregulation (13). Mechanismus der Herzerkrankung bei diesen Arten von Krankheiten istdie linksventrikuläre Wandumgestaltung aufgrund einer erhöhten Aktivierung des TGF-ßsignalwegs. Huntgeburt et al. (14) zeigen Sie, dass TGF-β die hypertrophe und kontraktile Reaktion auf β-adrenerge Stimulationen im Herzen reguliert, was zu Herzhypertrophie und Myokardfunktionsstörungen führt.Zirkulierendes TGF-β hat Aufmerksamkeit erhalten, da es möglicherweise als Biomarker für das Fortschreiten des Aortenumbaus bei Patienten nicht nur mit MS, sondern auch bei anderen genetischen Aortensyndromen dienen kann (15,16). Neben markedelevation von TGF-β-Spiegel bei Patienten mit MS in unserer Studie zum ersten malhaben die signifikante Erhöhung der Transforming Growth factor-ß1und -β2 Serumspiegel in Marfanoid Habitus-Patienten gezeigt, das kann dazu beitragen, subklinische Myokardbeteiligung – Abnahme der regionalen linksventrikulären systolischen Funktion.
Einschränkungen der Studie
Unsere Studie hat mehrere Einschränkungen. Eine Anzahl von Teilnehmern in verschiedenengruppen nicht gleich. Aufgrund einer seltenen Pathologie wie Marfan-Syndrom ist es unmöglichum eine gleiche Anzahl von Teilnehmern in Studien- und Kontrollgruppe zu erreichen.Die Populationen sind in Bezug auf Alter und Geschlecht unübertroffen, da wir die Teilnehmer nacheinander in die Studie einbezogen haben. Mutationen von Fibrillin-1 wurden nicht gescreentfür diese Studie.
Schlussfolgerung
Die Verschlechterung der regionalen Kontraktilität bei jungen Menschen mit erblich bedingten Gewebestörungen tritt nicht nur bei Personen mit Marfansyndrom auf, sondern auch bei Personen mit marfanoidem Habitus, die angeblichnur Skelettmerkmale ohne kardiovaskuläre Manifestationen. Eine Verschlechterung der regionalen Myokarddeformation kann das erste Anzeichen für eine Verschlechterung der linksventrikulären systolischen Funktion und das Vorliegen einer primären Kardiomyopathie bei asymptomatischen Marfanoid-Habituspatienten sein, die ihre Langzeitprognose beeinträchtigen könnten (17) und durch eine erhöhte TGF-β-Signalisierung verursacht werden können. Es wird erwartet, dass es mit zukünftigen Fortschritten beim Exomscanning und anderen Innovationen in der Molekulargenetik bald möglich sein wird, die genetischen Grundlagen des marfanoiden Habitus aufzudecken (6).
Interessenkonflikt
Kein Interessenkonflikt zwischen den Autoren.
- Pyeritz RE. Das Marfan-Syndrom. Annu Rev Med 2000;51:481-10.
- Carta L, Pereira L, Arteaga-Solis E, et al. Die Fibrilline 1 und 2 erfüllen während der Aortenentwicklung teilweise überlappende Funktionen. J Biol Chemie 2006;281:8016-23.
- Habashi JP, Richter DP, Holm TM, et al. Losartan, ein AT1-Antagonist, verhindert ein Aortenaneurysma in einem Mausmodell des Marfan-Syndroms. Wissenschaft 2006;312: 117-21.
- Alpendurada F, Wong J, Kiotsekoglou A, et al. Beweise für Marfan-Kardiomyopathie. Eur J Herz versagen 2010;12: 1085-91.
- Hetzer R, Siegel G, Delmo-Walter EM. Kardiomyopathie beim Marfan-Syndrom. Eur J Cardiothorac Surg 2016;49:561-67.
- Graham R, Hakim Aj. Arachnodaktylie-ein Schlüssel zur Diagnose von Erbkrankheiten des Bindegewebes. Nat Rev Rheumatol 2013;9:358-64.
- Loeys BL, Dietz HD, Braverman AC, et al. Die überarbeitete Genter Nosologie für das Marfan-Syndrom. J Med Genet 2010;47:476-85.
- Lang R, Badano L, Afilalo J, et al. Empfehlungen für die Quantifizierung der Herzkammer durch Echokardiographie bei Erwachsenen: Ein Update der American Society of Echocardiography und der European Association of Cardiovascular Imaging. Eur Herz J Cardiovasc Imaging 2015;16:233-71.
- Voigt JU, Pedrizzetti G, Lysyansky P, et al. Definitionen für einen gemeinsamen Standard für die 2D-Speckle-Tracking-Echokardiographie: Konsensusdokument der EACVI / ASE / Industry Task Force zur Standardisierung der Deformationsbildgebung. Eur Herz J Kardiovaskuläre Bildgebung 2015;16: 1-11.
- Malev E, Reeva S, Vasina L, et al. Kardiomyopathie bei jungen Erwachsenen mit klassischem Mitralklappenprolaps. Cardiol Jung 2014;24: 694-01.
- Maniar HS, Brady BD, Lee U, et al. Eine frühe linksventrikuläre regionale Kontraktionsstörung bei chronischer Mitralinsuffizienz tritt in einem konsistenten, heterogenen Muster auf. J Thorac Cardiovasc Surg 2014;148:1694-9.
- Bijnens BH, Cikes M, Claus P, et al. Geschwindigkeits- und Deformationsbildgebung zur Beurteilung der Myokardfunktionsstörung. Eur J Echocardiogr 2009;10:216-26.
- Koch JR, Carta L, Galatioto J, et al. Kardiovaskuläre Manifestationen beim Marfan-Syndrom und verwandten Krankheiten; mehrere Gene, die ähnliche Phänotypen verursachen. Clin Genet 2015;87:11-20.
- Huntgeburth M, Tiemann K, Shahverdyan R et al. Der transformierende Wachstumsfaktor b1 reguliert entgegengesetzt die hypertrophe und kontraktile Reaktion auf die b-adrenerge Stimulation im Herzen. PLoS ONE 2011;6:e26628.
- Matt P, Schönhoff F, Habashi J, et al. GenTAC Konsortium. Zirkulierender transformierender Wachstumsfaktor-Beta beim Marfan-Syndrom. Auflage 2009;120:526-32.
- Hillebrand M, Millot N, Sheikhzadeh S, et al. Der Gesamtserum-transformierende Wachstumsfaktor-β1 ist im gesamten Spektrum genetischer Aortensyndrome erhöht. Clin Cardiol 2014;37:672-9.
- Svensson LG, Blackstone EH, Feng J, et al. Sind MS- und Marfanoid-Patienten bei der Langzeitbeobachtung unterscheidbar? Ann Thorac Surg 2007;83:1067-74.