Fronteras en Inmunología
- Introducción
- Compartimentos de células T y B y Dos Subconjuntos de Células Estromales Convencionales
- Un Subconjunto Estromal Recién Identificado, Células Reticulares Marginales
- Los CCRM y la Vía de Entrada de antígenos en los SLO
- MRCs y Células Estromales Organizadoras en Desarrollo SLO
- Relación entre MRCs y Otros subconjuntos Estromales
- Remodelación de SLO y Estructuras Linfoides Terciarias
- Conclusión
- Declaración de conflicto de Intereses
- Agradecimientos
Introducción
Los órganos / tejidos linfoides secundarios (SLO) son esenciales para la inducción eficiente de respuestas inmunitarias adaptativas. Varios tipos de SLO, incluidos los ganglios linfáticos (LN), el bazo y los tejidos linfoides asociados a la mucosa (MALTAS), como los parches de Peyer (PPs), están estratégicamente ubicados en varios lugares del cuerpo. Los SLO son un filtro elaborado que toma muestras de antígenos y está equipado con sensores inmunológicos de alta sensibilidad. Para recolectar y filtrar antígenos extraños, los SLO contienen estructuras de tejido especializadas que están asociadas con el endotelio o el epitelio. Las células inmunitarias, como los linfocitos, las células dendríticas y los macrófagos, se acumulan a altas densidades y forman compartimentos. Una característica notable común a todos los SLO es la localización segregada de las células B y las células T. La arquitectura de los SLO se apoya en varios tipos de células estromales no hematopoyéticas de origen mesenquimatoso, que construyen redes y definen compartimentos (Mueller y Germain, 2009; Roozendaal y Mebius, 2011). Las redes estromales proporcionan no solo un punto de apoyo funcional, sino también un espacio para las actividades de las células inmunitarias, así como un marco físico para el tejido. Además, la creciente evidencia indica que las células estromales también desempeñan un papel crítico en la función de las células inmunitarias y la homeostasis (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Los SLO están programados para desarrollarse a partir del anlagen que se produce en ciertos lugares y durante períodos restringidos en el feto y el bebé. Además, se sabe que las células del estroma son importantes para el desarrollo y el mantenimiento de SLO (Mebius, 2003). Aquí, me enfoco en un subconjunto estromal recientemente identificado, células reticulares marginales (MRCs), y resumo sus características. También discuto la relación entre MRCs y la estructura tisular, otros subconjuntos estromales y funciones inmunológicas.
Compartimentos de células T y B y Dos Subconjuntos de Células Estromales Convencionales
Como se describió anteriormente, las células B y las células T se localizan en regiones distintas dentro de los SLO. Las células B se acumulan para formar folículos (zona B) en la corteza externa debajo de la cápsula en LNs o en la vaina linfoide periarteriolar externa (PALS) en el bazo. Un grupo de folículos grandes es el tejido central de PPs. Durante las respuestas inmunitarias, las células B activadas en los folículos forman centros germinales, donde se diferencian en productores de anticuerpos de alta afinidad (Cyster et al., 2000). Por el contrario, las células T se localizan en un área separada (zona T) adyacente a los folículos, es decir, el paracórtex en LNs, los PALS internos en el bazo o la región interfolicular (IFR) en PPs. Los DCs también se acumulan en la zona T para presentar antígenos y células T primarias (Steinman et al., 1997).
Hay dos tipos diferentes de subconjuntos estromales mesenquimatosos en las zonas B y T (Figura 1A). Las células dendríticas foliculares (FDC) forman una red densa en el centro de los folículos y han recibido una atención considerable debido a su importancia en la producción de anticuerpos por las células B (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). Los FDCs expresan CR1 / CD35, CD23 y ocasionalmente MAdCAM-1(Szabo et al., 1997; Cyster et al., 2000). Por el contrario, una elaborada red de células reticulares fibroblásticas (FRC) comprende el armazón de la zona T, que produce podoplanina/gp38 y varios componentes de matriz extracelular (ECM) (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). En general, la migración y localización de células inmunitarias están reguladas por una variedad de quimiocinas (Mackay, 2001). Los linfocitos en reposo y los DCs maduros son altamente sensibles a las» quimiocinas homeostáticas » (Cyster, 1999; Müller et al 2003). Consistente con esto, hay correlaciones claras entre las quimiocinas producidas por subconjuntos de células estromales y la localización de células inmunes que expresan los receptores correspondientes; CXCL13 producido por FDCs es un atrayente de células B que expresan CXCR5, mientras que CCL19 y CCL21 de FRCs de la zona T atraen células T y DCs maduras a través del receptor común CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Además, se cree que los linfocitos que migran de forma robusta en el parénquima tisular para escanear antígenos utilizan redes estromales como punto de apoyo (Bajénoff et al 2006). Una variedad de factores producidos por los subconjuntos estromales también son necesarios para la activación y supervivencia de las células inmunitarias (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Por lo tanto, es probable que la estructura y función de la red estromal en cada compartimento esté optimizada para la actividad de subconjuntos de células inmunitarias.
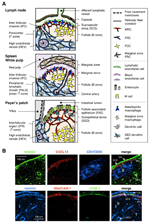
la FIGURA 1. Subconjuntos de células estromales y estructuras tisulares de SLos. A) Representación esquemática de las estructuras tisulares en los SLO de ratón, con especial hincapié en las células estromales y el aparato transportador de antígenos. Los elementos estromales, incluidas las células mesenquimales, endoteliales y epiteliales, así como las células mieloides, como los macrófagos y las células dendríticas (enumeradas en el panel derecho), se dibujan para enfatizar. B) Superior: Estructura tisular construida por tres tipos diferentes de células estromales en la región cortical externa del LN. Inmunotinción fluorescente de una sección de ratón. En la micrografía superior, hay un pequeño folículo en reposo (B) sin un centro germinal, que está soportado por FDCs que expresan CR1/CD35 pero niveles indetectables de CXCL13. En cambio, los MRC forman una red reticular de laminina+CXCL13 + en el borde exterior del folículo debajo de la cápsula (CA) y SCS. La red construida por FRCs en el paracórtex (T) es laminin+CXCL13-CR1/CD35-. Inferior: La capa MAdCAM-1+ MRC está estrechamente asociada con la capa endotelial linfática LYVE-1+ en el SCS. Tenga en cuenta que la capa MRC se extiende al área IFC.
La red estromal en la zona T está compuesta por FRCs y un haz de ECM conocido como fibra reticular, que forma un «conducto» que facilita el paso de sustancias de bajo peso molecular (Gretz et al., 1997, 2000; Nolte et al., 2003). Este conducto transporta varios factores y antígenos solubles profundamente dentro del tejido, mientras que las partículas y las moléculas grandes se excluyen predominantemente de los compartimentos linfocitos. De hecho, las quimiocinas transmitidas por linfa de los tejidos periféricos se transportan rápidamente a la vénula endotelial alta a través del conducto para controlar la movilización de las células circulantes hacia el LNs (Palframan et al., 2001). Además, algunos DCS residentes entran en contacto directo con el conducto y capturan antígenos transmitidos por linfocitos (Sixt et al., 2005).
Un Subconjunto Estromal Recién Identificado, Células Reticulares Marginales
El margen exterior de la corteza del LN, justo debajo de la cápsula, está rodeado por el seno subcapsular (SCS; Figura 1A). La superficie luminal del SCS está cubierta de células endoteliales linfáticas y su lado cortical está respaldado por la membrana basal, llamada «piso» (Szakal et al., 1983). Particularmente dentro de las NIIf, las fibras reticulares se extienden desde el piso hasta el paracórtex (Gretz et al., 1997). Es importante destacar que también se observa una capa delgada de estructura reticular en la región más externa de los folículos. Las células estromales similares a los FRC en el retículo folicular expresan CXCL13 y MAdCAM-1, pero no CCL21, lo que indica que estas células son distintas de los FRC de la zona T, mientras que el marcador de FDC CR1/CD35 no se detectó o solo se expresó débilmente en estas células (Katakai et al., 2008; figuras 1B y 2A). Los FDC no generan fibras reticulares y, en consecuencia, el marcador reticular ER-TR7 está prácticamente ausente en el centro de los folículos (Katakai et al., 2004a, b). Además, las células reticulares de la región subcapsular expresan específicamente RANKL / TRANCE, que es una citocina de la familia TNF que es esencial para el desarrollo de LN (Dougall et al., 1999; Kong et al., 1999). Por lo tanto, se pensó que estas células estromales eran un nuevo subconjunto estromal y se designaron células reticulares marginales (MRCs; Katakai et al., 2008). Cabe destacar que una cantidad sustancial de CXCL13 se expresa constitutivamente en MRCs en folículos pequeños en reposo, incluso si los FDCs expresan niveles indetectables de CXCL13 (Figura 1B). Está bien establecido que el borde exterior de PALS en el bazo, especialmente el que se encuentra sobre los folículos, está bordeado por una capa estromal MAdCAM-1+. Las células que constituyen el revestimiento de la membrana basal debajo del seno marginal (MS) también expresan CXCL13 y RANKL, lo que indica que estas células son un tipo de MRCs (Katakai et al., 2008). En las maltas, las células reticulares similares a las MRCS forman una red en la región del domo subepitelial (SED) justo debajo de la membrana basal del epitelio asociado al folículo (FAE; Katakai et al., 2008; Knoop et al., 2009). Tomados en conjunto, se cree que los MRC son un subconjunto estromal común a los SLO, pero distinto de los FDC y FRC.
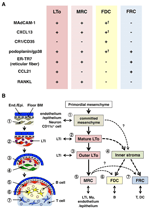
la FIGURA 2. Relación entre MRCs y otros subconjuntos de células estromales en SLos. A) Patrón de expresión de marcadores en subconjuntos de células estromales. Los niveles de expresión de MAdCAM-1, CXCL13 y podoplanina/gp38 en FDCs son a menudo débiles o indetectables por inmunohistoquímica (†). (B) Esquema de un modelo generalizado de desarrollo de SLO con las ubicaciones de subconjuntos de células estromales (izquierda) y una genealogía putativa de subconjuntos de células estromales (derecha). Los números que indican los elementos de celda en el dibujo de la izquierda representan subconjuntos de celdas estromales que se muestran en el esquema de la derecha. BM, membrana basal; Extremo.Epinefrina., capa endotelial o epitelial.
Los CCRM y la Vía de Entrada de antígenos en los SLO
Los órganos linfoides secundarios se caracterizan por estructuras peculiares que filtran y transportan antígenos a los compartimentos linfocitos (Figura 1A). Las LN se conectan con los vasos linfáticos para examinar los antígenos transmitidos por linfa. Debido a que los linfáticos aferentes están abiertos al SCS, el endotelio linfático sinusal y la membrana basal del piso son, por así decirlo, la superficie frontal del filtro LN. El bazo filtra la sangre, en la que las ramas de la arteria central se abren a la esclerosis múltiple y a la zona marginal (ZM), donde las células inmunitarias examinan el contenido sanguíneo. En estas estructuras sinusales especializadas, las barreras fronterizas son el endotelio linfático en el SCS del LN y el endotelio sanguíneo en el MS del bazo, ambos apoyados por el retículo MRC. Curiosamente, los macrófagos metalofílicos CD169 + se distribuyen selectivamente cerca del revestimiento del seno sobre los folículos, algunos de los cuales se asientan a través de la barrera endotelial y transportan antígenos particulados desde la luz del seno hacia el compartimento linfocitario (Szakal et al., 1983; Taylor et al., 2005; Carrasco y Batista, 2007; Phan et al., 2009). Los DCS que transportan antígenos de los tejidos a través de los vasos linfáticos llegan al SCS y posteriormente se mueven hacia el paracórtex a través del piso del canal interfolicular (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). En las maltas, las FAE funcionan como la barrera en la que una célula epitelial especializada llamada células M transfiere bacterias o partículas de la luz intestinal a los DCs o macrófagos subyacentes (Kraehenbuhl y Neutra, 2000). Por lo tanto, los MRC soportan el aparato de transporte de antígenos de primera línea en cada SLO. El diseño básico de SLO es que los folículos están dispuestos principalmente hacia el sitio de entrada del antígeno y están acompañados por zonas T. Por lo tanto, desde un punto de vista estromal, toda la arquitectura del tejido parece estar organizada hacia la capa MRC.
Aunque las funciones inmunológicas de los MRC siguen siendo esquivas, se demostró previamente que la red de conductos construida por los MRC en el folículo externo transporta pequeños antígenos solubles a las células B foliculares y a los FDC (Bajénoff y Germain, 2009; Roozendaal et al., 2009). La mayoría de los macrófagos CD169 + se colocan en el lado cortical del piso del SCS y sobresalen una extensión en la luz sinusal para capturar partículas (Phan et al., 2009). Por lo tanto, los MRCS podrían estar involucrados en la localización, morfología y función de estos macrófagos. El desarrollo de células M en PPs requiere señalización RANKL, que es probablemente controlada por una red MRC que expresa RANKL justo debajo de la FAE (Knoop et al., 2009). La inhibición de la vía LT, que elimina las firmas MRC en la pulpa blanca esplénica, perturba la estructura de MS (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Además, la expresión elevada de ICAM-1, VCAM-1 y CXCL13 implica que los MRC están involucrados en la migración intersticial dinámica de las células B foliculares como un andamio funcional. Se ha demostrado que los macrófagos CD169 + liberan antígenos particulados directamente a las células B específicas de antígenos en esta área (Carrasco y Batista, 2007; Phan et al., 2009), sugiriendo que el control de la migración de células B mediado por la red MRC puede afectar este proceso. Dado que los MRC también están presentes en la región de la CFI, es posible que regulen la transmigración de los DCs desde los SC hacia la zona T.
MRCs y Células Estromales Organizadoras en Desarrollo SLO
Los órganos linfoides secundarios se desarrollan a partir de la anlagen, que son agregados de células mesenquimales y hematopoyéticas asociadas con vasos o epitelio, en un sitio y período definidos en el feto o el lactante (Mebius, 2003). Un evento crítico en el desarrollo del SLO anlagen es la acumulación de células hematopoyéticas CD45+CD4+CD3, que también se conocen como células inductoras de tejido linfoide (LTi) que interactúan con las células del estroma mesenquimatoso llamadas células organizadoras de tejido linfoide (LTo) (Mebius et al., 1997). Una citocina de la familia TNF, la linfotoxina (LT)-α1β2 que es expresada por las células LTi transmite señales a las células LTo a través del receptor LT-β. Las células LTo posteriormente inducen la expresión de moléculas de adhesión, incluyendo ICAM-1, VCAM-1 y MAdCAM-1, y quimiocinas CXCL13, CCL19 y CCL21 (Honda et al., 2001; Cupedo et al., 2004a; Bénézech et al 2010). En particular, CXCL13 es especialmente importante para atraer células LTi al anlagen a través de su receptor CXCR5 (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Se supone que un bucle de retroalimentación positiva, es decir, las células LTi recién inmigradas que producen LT activan aún más las células estromales LTo, promoviendo la organización del anlagen. A medida que los linfocitos comenzaron a acumularse después del nacimiento, el tejido se expande y se inducen los compartimentos soportados por diferentes subconjuntos de células estromales (Cupedo et al., 2004b; Bajénoff y Germain 2009).
Las células reticulares marginales y las células LTo expresan un patrón muy similar de varios marcadores (Figura 2A), lo que sugiere que hay alguna relación entre estas dos células estromales. Las células LTo parecen estar más concentradas en la región marginal del LN anlagen adyacente al seno linfático del presunto SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Esta capa de células LTo parece expandirse hacia el exterior con el crecimiento del anlagen, que finalmente parece convertirse en la capa MRC (Katakai et al., 2008). Del mismo modo, a medida que los linfocitos se acumulan alrededor de la arteria central en el bazo postnatal, las células LTo que expresan MAdCAM-1 y RANKL se expanden con la capa y se convierten en MRCs en la pulpa blanca. Estos hallazgos sugieren fuertemente que los MRC son descendientes directos del estroma LTo, que preservan las características de las células LTo en sitios especializados dentro de los SLO. Incluso los ratones con deficiencia de TRAPO exhiben una capa subcapsular de MRC en LNs atróficas y vainas periarteriales reducidas de MRC en el bazo, lo que indica que el desarrollo de MRC ocurre independientemente de las células B y T y se programa antes de su colonización (Katakai et al., 2008). Dado que los SLO muestrean antígenos de manera eficiente para desencadenar respuestas inmunitarias, las estructuras recolectoras de antígenos que se construyen durante el desarrollo deben mantenerse a partir de entonces. En consecuencia, es razonable que estas estructuras tisulares sean mantenidas por células estromales tipo organizador a lo largo de la edad adulta.
Relación entre MRCs y Otros subconjuntos Estromales
La Figura 2B muestra la posible genealogía de subconjuntos estromales en SLO. En el embrión, el mesénquima primordial que está muy cerca de la vasculatura o el epitelio se compromete a formar el núcleo del anlage y atrae a las células LTi. Las células nerviosas u otras células menos caracterizadas también participan en el proceso inicial(Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). La acumulación de células LTi facilita la maduración de las células mesenquimales en células LTo, lo que en última instancia facilita la construcción de la arquitectura básica. Por lo general, las células LTo tienden a concentrarse en la periferia del anílago y se expanden hacia afuera con el crecimiento del tejido, mientras que las células estromales que exhiben firmas LTo débiles o nulas, por el contrario, aumentan en la porción interna del anílago. La colonización postnatal de las células B y T conduce a compartimentos con la inducción de subconjuntos estromales convencionales.
Si este esquema es correcto, se deduce que todos los subconjuntos estromales en SLO adultos se derivan originalmente de células LTo. Por lo tanto, ¿los MRC que conservan las características de las células LTo tienen la capacidad de diferenciarse en FDC o FRC? Los CMR comparten muchas firmas con otros subconjuntos (Figura 2A), lo que sugiere que esto es posible. Una especulación es que los MRCS funcionan como células madre estromales que suministran continuamente a todos los subconjuntos estromales a lo largo de la edad adulta. Aunque esta idea es intrigante, requerirá una consideración cautelosa y una mayor validación en el futuro. Las células mesenquimales son generalmente de naturaleza altamente flexible dependiendo del entorno circundante, y por lo tanto, las características específicas se pueden cambiar fácilmente. El cultivo extendido de células estromales aisladas de LNs resulta en la pérdida de expresión de muchos genes, particularmente quimiocinas homeostáticas (Katakai et al., 2004a; Tomei et al., 2009). Esto sugiere que los fenotipos in vivo de los subconjuntos de células estromales se mantienen de manera óptima por las circunstancias del tejido, que son reversibles y no debido a la diferenciación terminal. Además, los estímulos inflamatorios inducen la proliferación robusta de células estromales y la remodelación dramática de SLO (Katakai et al., 2004a; Chyou et al., 2011). Por lo tanto, aunque los MRC podrían convertirse en otros subconjuntos, los subconjuntos estromales convencionales también podrían renovarse por sí mismos y ser intercambiables en los SLO adultos.
Remodelación de SLO y Estructuras Linfoides Terciarias
Durante las respuestas inmunitarias, las estructuras estromales dentro de SLO se remodelan drásticamente (Gretz et al., 1997; Katakai et al., 2004a). Algunas infecciones causan una interrupción severa de las estructuras de los tejidos dentro de la LNs y la pulpa blanca esplénica en pocos días, que se restaura a medida que se erradican los patógenos (Mueller et al., 2007a, b; Scandella et al., 2008; San Juan y Abraham, 2009). Este proceso de restauración probablemente recapitula un proceso de autoorganización a través de una reacción de retroalimentación similar al desarrollo SLO. Es importante destacar que las células similares a LTi también están presentes en los tejidos adultos y regulan la remodelación de los SLO asociada a infecciones (Kim et al., 2003; Scandella et al., 2008). Aunque se desconoce el papel de los MRC en tales procesos, es posible que tengan un papel de organización en colaboración con células similares a LTi y determinen el marco exterior de los SLO durante la reconstrucción.
En la inflamación crónica asociada a diversas patologías de órganos, un gran número de linfocitos infiltrantes a menudo conducen a organizaciones similares a los SLO, conocidos como tejidos linfoides terciarios (TLT; Drayton et al., 2006). Las células B y T se segregan y se inducen las redes correspondientes de subconjuntos de células estromales. Sería interesante determinar si los MRC están presentes en estas estructuras linfoides ectópicas; sin embargo, las células similares a los MRC y las estructuras tisulares relacionadas no se observan en los TLT que se desarrollaron durante la gastritis autoinmune en ratones (Katakai et al., 2006, 2008). Se debe enfatizar que los TLT fundamentalmente no son organizaciones linfoides programadas y, naturalmente, no se asocian con las estructuras transportadoras de antígenos. Por lo tanto, es probable que los MRC estén ausentes en los TLT. A pesar de que las células del estroma que son fenotípicamente similares a las CMR podrían inducirse en algunas lesiones, no se identificarían como CMR a menos que se asocien estrechamente con la estructura endotelial o epitelial específica y formen un retículo en capas en los folículos externos.
Conclusión
Las células reticulares marginales son un subconjunto de células estromales único común a los SLO. Los MRC son claramente diferentes de los subconjuntos convencionales que se inducen o maduran a través de interacciones con linfocitos después del nacimiento, y se derivan directamente de células estromales LTo en el anlagen e independientes de los linfocitos. La red de MRCs está estrechamente asociada con el aparato de transporte de antígenos de SLO y se cree que controla directa o indirectamente la entrega de antígenos a los compartimentos de linfocitos, así como la localización y migración de las células inmunitarias. Los MRCS probablemente desempeñan un papel fundamental en el mantenimiento de las estructuras SLO como marco exterior y pueden convertirse a otros subconjuntos estromales en estado estacionario o durante la remodelación tisular. Será importante considerar colectivamente todos los subconjuntos estromales, las estructuras tisulares y los microambiente inmunológico para comprender de manera integral el sistema SLO.
Declaración de conflicto de Intereses
El autor declara que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado en parte por Subvenciones para Jóvenes científicos y de Investigación Científica en Áreas Innovadoras del Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología de Japón.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., and Germain, R. N. (2006). Las redes de células del estroma regulan la entrada, migración y territorialidad de los linfocitos en los ganglios linfáticos. Inmunidad 25, 989-1001.
Resumen de Pubmed / Texto completo de Pubmed / Texto completo cruzado
Bajénoff, M., and Germain, R. N. (2009). El desarrollo del folículo de células B remodela el sistema de conductos y permite la administración de antígenos solubles a las células dendríticas foliculares. Sangre 114, 4989-4997.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H., and Weih, F. (2007). Papeles distintos de la señalización linfotoxina-beta y del factor de transcripción homeodominio Nkx2.3 en la ontogenia de los compartimentos endoteliales en el bazo. Cell Tissue Res. 328, 473-486.
Resumen de Pubmed | Texto Completo de Pubmed/Texto completo cruzado
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Ontogenia de las células organizadoras del estroma durante el desarrollo de los ganglios linfáticos. J. Immunol. 184, 4521–4530.
Resumen/Texto completo de Pubmed
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., and Förster, R. (2011). Las células T y las células D aferentes derivadas de linfocitos usan diferentes rutas dependientes del receptor de quimiocinas CCR7 para entrar en el ganglio linfático y la migración intranodal. NAT. Inmunol. 12, 879–887.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Carrasco, Y. R., y Batista, F. D. (2007). Las células B adquieren antígeno particulado en un área rica en macrófagos en el límite entre el folículo y el seno subcapsular del ganglio linfático. Inmunidad 27, 160-171.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., and Lu, T. T. (2011). Regulación coordinada del crecimiento vascular-estromal de los ganglios linfáticos primero por células CD11c+ y luego por células T y B. J. Immunol. 187, 5558–5567.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). Los presuntos organizadores de ganglios linfáticos están representados de manera diferente en el desarrollo de ganglios mesentéricos y periféricos. J. Immunol. 173, 2968–2975.
Resumen/Texto completo de Pubmed
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., and Mebius, R. E. (2004b). El inicio de la organización celular en los ganglios linfáticos está regulado por señales no derivadas de células B y no depende del ligando quimioquínico CXC 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract | Pubmed Texto Completo
Cyster, J. G. (1999). Quimiocinas y migración celular en órganos linfoides secundarios. Science 286, 2098-2102.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S.A., y Ngo, V. N. (2000). Células del estroma folicular y linfocitos que se dirigen a los folículos. Inmunol. Rev. 176: 181-193.
Resumen de Pubmed | Texto Completo de Pubmed/Texto cruzado
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., and Schuh, J. (1999). El RANK es esencial para el desarrollo de osteoclastos y ganglios linfáticos. Genes Dev. 13, 2412–2424.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Desarrollo de órganos linfoides: de la ontogenia a la neogénesis. NAT. Inmunol. 7, 344–353.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). Función esencial del receptor nuclear RORy (t) en la generación de células inductoras de tejido linfoide fetal. NAT. Inmunol. 5, 64–73.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). Las células CD4 + CD3 inducen el desarrollo del parche de Peyer: papel de la activación de la integrina α4β1 por CXCR5. Inmunidad 17, 363-373.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L., and Turley, S. J. (2010). Las células reticulares fibroblásticas de los ganglios linfáticos presentan directamente antígeno de tejido periférico en condiciones inflamatorias y de estado estacionario. J. Exp. Mediterráneo. 207, 689–697.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Gretz, J. E., Anderson, A. O., y Shaw, S. (1997). Cordones, canales, pasillos y conductos: elementos arquitectónicos críticos que facilitan las interacciones celulares en la corteza de los ganglios linfáticos. Inmunol. Apo. 156, 11-24.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., y Shaw, S. (2000). Las quimiocinas transmitidas por linfocitos y otras moléculas de bajo peso molecular alcanzan vénulas endoteliales altas a través de conductos especializados, mientras que una barrera funcional limita el acceso a los microambientes de los linfocitos en la corteza de los ganglios linfáticos. J. Exp. Mediterráneo. 192, 1425–1440.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., and Nishikawa, S.-I. (2001). Base molecular para la interacción hematopoyética/mesenquimatosa durante el inicio de la organogénesis del parche de Peyer. J. Exp. Mediterráneo. 193, 621–630.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., y Aguzzi, A. (2005). Genes dependientes de receptores de linfotoxina β en transcriptomas de células dendríticas foliculares y ganglios linfáticos. J. Immunol. 174, 5526–5536.
Resumen de Pubmed / Texto completo de Pubmed
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., y Shaw, S. (2001). Organización espacial y molecular de la corteza de linfocitos T de los ganglios linfáticos: cavidad laberíntica delimitada por una monocapa similar al epitelio de células reticulares fibroblásticas ancladas a una matriz extracelular similar a la membrana basal. Int. Inmunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Katakai, T., Hara, T., Sugai, M., Gonda, H., y Shimizu, A. (2004a). Las células reticulares fibroblásticas de los ganglios linfáticos construyen el retículo estromal a través del contacto con los linfocitos. J. Exp. Mediterráneo. 200, 783–795.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M., y Shimizu, A. (2004b). A novel reticular stromal structure in lymph node cortex: an immuno-platform for interactions among dendritic cells, T cells and B cells. Int. Inmunol. 16, 1133–1142.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., and Shimizu, A. (2006). Neogénesis linfoide espontánea a gran escala y autoinmunidad equilibrada versus tolerancia en el estómago de ratones transgénicos TCR reactivos a H+ / K + -ATPasa. J. Immunol. 177, 7858–7867.
Resumen/Texto completo de Pubmed
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., y Shimizu, A. (2008). Capa de células estromales reticulares tipo organizador común a los órganos linfoides secundarios adultos. J. Immunol. 181, 6189–6200.
Resumen/Texto completo de Pubmed
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, M. D., and Lane, P. J. (2003). Las células accesorias CD4 + CD3 coestimulan las células T CD4 cebadas a través de OX40 y CD30 en sitios donde las células T colaboran con las células B. Inmunidad 18, 643-654.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., y Williams, R. I. (2009). RANKL es necesario y suficiente para iniciar el desarrollo de células M de muestreo de antígenos en el epitelio intestinal. J. Immunol. 183, 5738–5747.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S., and Miyasaka, M. (1996). La zona marginal esplénica está ausente en ratones alinfoplásicos mutantes de aly. EUR. J. Immunol. 26, 669–675.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Kong, Y. Y., Yoshida, H., Sarosi, I., Moreno, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., IE, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., and Penninger, J. M. (1999). OPGL es un regulador clave de la osteoclastogénesis, el desarrollo de linfocitos y la organogénesis de ganglios linfáticos. Nature 397, 315-323.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Kraehenbuhl, J. P., y Neutra, M. R. (2000). Células M epiteliales: diferenciación y función. Annu. Reverendo Cell Dev. Biol. 16, 301–332.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., and Luther, S.A. (2007). Las células reticulares fibroblásticas en los ganglios linfáticos regulan la homeostasis de las células T sin tratamiento previo. NAT. Inmunol. 8, 1255–1265.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). La liberación regulada de óxido nítrico por el estroma no hematopoyético controla la expansión del grupo de células T activadas en los ganglios linfáticos. NAT. Inmunol. 12, 1096–1104.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Luther, S.A., Tang, H. L., Hyman, P. L., Farr, A. G., and Cyster, J. G. (2000). Coexpresión de las quimiocinas ELC y SLC por células estromales de la zona T y deleción del gen ELC en el ratón plt / plt. Proc. Natl. Acad. Sci. U. S. A. 97, 12694-12699.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Luther, S. A., Ansel, K. M., and Cyster, J. G. (2003). Funciones superpuestas de los ligandos CXCL13, receptor α de interleucina 7 y CCR7 en el desarrollo de ganglios linfáticos. J. Exp. Mediterráneo. 197, 1191–1198.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Mackay, C. R. (2001). Quimiocinas: factores de alto impacto de la inmunología. NAT. Inmunol. 2, 95–101.
Resumen de Pubmed | Texto Completo de Pubmed/Texto cruzado
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., and The Immunological Genome Project Consortium. (2012). El perfil transcripcional del estroma de los ganglios linfáticos inflamados y en reposo define las características inmunológicas. NAT. Inmunol. 13, 499–510.
Resumen de Pubmed / Texto completo de Pubmed / Texto completo cruzado
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). Los ganglios linfáticos en desarrollo recogen células CD4 + CD3-LTß + que pueden diferenciarse de células APC, células NK y células foliculares, pero no de células T o B. Inmunidad 7, 493-504.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Mebius, R. E. (2003). Organogénesis de tejidos linfoides. NAT. Apo. Immunol. 3, 292–303.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., and Matloubian, M. (2007a). Regulación de la expresión homeostática de quimioquinas y tráfico celular durante las respuestas inmunitarias. Science 317, 670-674.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., and Ahmed, R. (2007b). El objetivo viral de las células reticulares fibroblásticas contribuye a la inmunosupresión y persistencia durante la infección crónica. Proc. Natl. Acad. Sci. U. S. A. 104, 15430-15435.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Mueller, S. N., and Germain, R. N. (2009). La célula estromal contribuye a la homeostasis y a la funcionalidad del sistema inmunitario. NAT. Apo. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Müller, G., Höpken, U. E., and Lipp, M. (2003). El impacto de CCR7 y CXCR5 en el desarrollo de los órganos linfoides y la inmunidad sistémica. Inmunol. Apo. 195, 117-135.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). Un sistema de conductos distribuye quimiocinas y pequeñas moléculas transmitidas por la sangre a través de la pulpa blanca esplénica. J. Exp. Mediterráneo. 198, 505–512.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., and Förster, R. (2003). Mecanismos cooperantes de CXCR5 y CCR7 en el desarrollo y organización de órganos linfoides secundarios. J. Exp. Mediterráneo. 197, 1199–1204.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., and von Andrian, U. H. (2001). Transporte y presentación de quimioquinas inflamatorias en el VHE: un mecanismo de control remoto para el reclutamiento de monocitos a los ganglios linfáticos en tejidos inflamados. J. Exp. Mediterráneo. 194, 1361–1373.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y., and Cyster, J. G. (2009). El relé del complejo inmunitario por macrófagos del seno subcapsular y células B no cognadas impulsa la maduración de afinidad de anticuerpos. NAT. Inmunol. 10, 786–793.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Roozendaal, R., Mempel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., and Carroll, M. C. (2009). Los conductos median el transporte de antígenos de bajo peso molecular a los folículos de los ganglios linfáticos. Inmunidad 30, 264-276.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Roozendaal, R., y Mebius, R. E. (2011). Interacciones entre células estromales e inmunitarias. Annu. Apo. Immunol. 29, 23–43.
Resumen de Pubmed / Texto Completo de Pubmed/Texto cruzado
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S.A., Junt, T., and Ludewig, B. (2008). Restauración de la integridad de los órganos linfoides mediante la interacción de células inductoras de tejido linfoide con estroma de la zona de células T. NAT. Inmunol. 9, 667–675.
Resumen de Pubmed | Texto Completo de Pubmed/Texto completo cruzado
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., y Sorokin, L. (2005). El sistema de conductos transporta antígenos solubles desde la linfa aferente a las células dendríticas residentes en el área de células T del ganglio linfático. Inmunidad 22, 19-29.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Steinman, R. M., Pack, M., e Inaba, K. (1997). Células dendríticas en las áreas de células T de los órganos linfoides. Inmunol. Apo. 156, 25-37.
Resumen de Pubmed / Texto completo de Pubmed / Texto completo cruzado
St John, A. L., and Abraham, S. N. (2009). La salmonela altera la arquitectura de los ganglios linfáticos mediante la supresión de quimiocinas homeostáticas mediada por TLR4. NAT. Mediterráneo. 15, 1259–1265.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W., and Fagarasan, S. (2010). La detección de estímulos ambientales por las células dendríticas foliculares promueve la generación de inmunoglobulina A en el intestino. Inmunidad 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Especialización de las células dendríticas foliculares de la mucosa revelada por la visualización de la molécula de adhesión a la célula de dirección de la mucosa-1. J. Immunol. 158, 5584–5588.
Resumen de Pubmed / Texto completo de Pubmed
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Transporte de complejos inmunes del seno subcapsular a los folículos de los ganglios linfáticos en la superficie de las células no fagocíticas, incluidas las células con morfología dendrítica. J. Immunol. 131, 1714–1727.
Resumen de Pubmed / Texto completo de Pubmed
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Receptores de macrófagos y reconocimiento inmune. Annu. Apo. Immunol. 23, 901–944.
Resumen de Pubmed / Texto Completo de Pubmed / Texto completo cruzado
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F. y Szakal, A. K. (1997). Las células dendríticas foliculares y presentación de antígeno y las señales coestimuladoras a las células B. Inmunol. Apo. 156, 39-52.
Resumen de Pubmed | Texto Completo de Pubmed/Texto completo cruzado
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S.A., y Swartz, M. A. (2009). El flujo de fluidos regula la organización de las células del estroma y la expresión de CCL21 en un microambiente de ganglio linfático diseñado con tejidos. J. Immunol. 183, 4273–4283.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J., and Mebius, R. E. (2009). La quimiocina CXCL13 es esencial para la iniciación de ganglios linfáticos y es inducida por el ácido retinoico y la estimulación neuronal. NAT. Inmunol. 10, 1193–1199.
Resumen de Pubmed | Texto Completo de Pubmed/Texto completo cruzado
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., y Kioussis, D. (2007). El receptor de tirosina cinasa RET es un regulador clave de la organogénesis del parche de Peyer. Nature 446, 547-551.
Resumen de Pubmed / Texto Completo de Pubmed/Texto completo cruzado
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., y Kollias, G. (2006). Funciones específicas de FDC de p55TNFR e IKK2 en el desarrollo de redes de FDC y de respuestas de anticuerpos. Inmunidad 24, 65-77.
Pubmed Abstract | Pubmed Texto Completo | CrossRef Texto Completo
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., and Chaplin, D. D. (2009). La linfotoxina LTa1ß2 controla la estructura y función vascular del seno marginal del bazo postnatal y adulto. Inmunidad 30, 408-420.
Resumen de Pubmed / Texto Completo de Pubmed / Texto Cruzado