La geometría molecular SF6, la Estructura, la Forma y la polaridad de Lewis
El hexafluoruro de azufre o SF6 es un gas inorgánico de efecto invernadero. No es inflamable, inodoro e incoloro, y es un excelente aislante. Es una molécula octaédrica hipervalente que ha sido un tema de conversación interesante entre los entusiastas de la química.
Henri Moissan descubrió la existencia de SF6. Por cierto, también es el descubridor del flúor. La forma estándar de sintetizar SF6 es exponer S8 a F2. Este método causa la formación de unos pocos fluoruros de azufre, pero estos se pueden eliminar mediante calentamiento y luego utilizando NaOH para eliminar cualquier molécula de SF4 adicional.
SF6 no se puede utilizar inmediatamente después de la síntesis. Necesita ser purificado para deshacerse de todos los fluoruros reactivos. Después de eso, necesita pasar por pirólisis.
En esta entrada de blog, aprenderemos la Estructura de Lewis del SF6 y sus ángulos de enlace, geometría molecular y forma que pueden ayudarnos a comprender las propiedades físicas de esta molécula.
| Name of molecule | Sulphur Hexafluoride ( SF6) |
| No of Valence Electrons in the molecule | 48 |
| Hybridization of SF6 | sp3d2 hybridization |
| Bond Angles | 90 degrees |
| Molecular Geometry of SF6 | Octahedral |
Contents
SF6 Valence Electrons
To determine the Lewis Estructura de cualquier molécula, primero necesitamos saber el número total de electrones de valencia. Aquí descubriremos el número total de electrones de valencia para SF6 agregando los electrones de valencia para los átomos de azufre y flúor.
Número total de electrones de valencia en electrones de valencia SF6 de Azufre + Electrones de valencia de Flúor
El azufre tiene seis electrones de valencia.
El flúor tiene siete electrones de valencia, pero como hay seis átomos de flúor en esta molécula, multiplicaremos este número por 6.
= 6 + 7*6
= 6 + 42
= 48 electrones de valencia
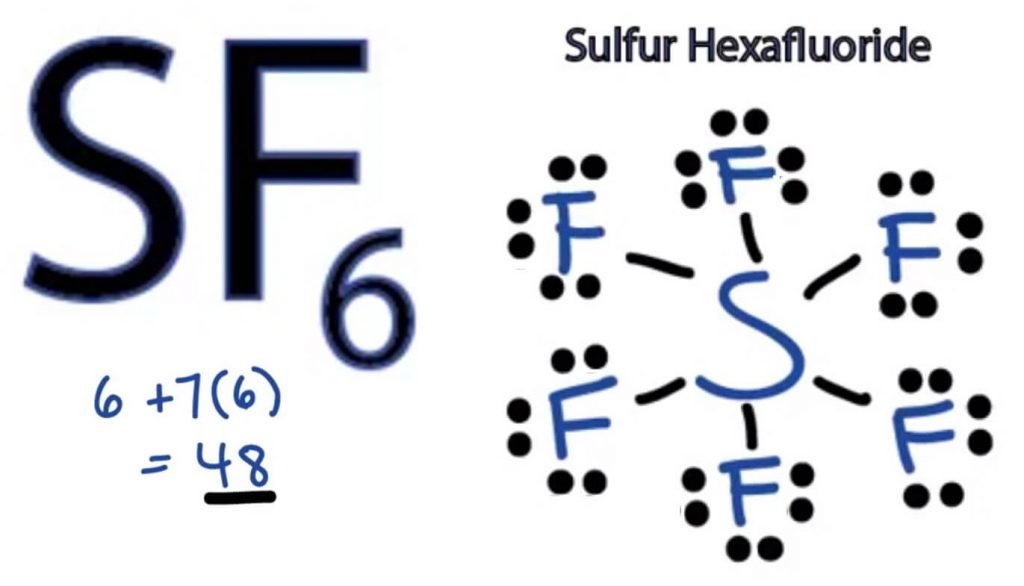
Por lo tanto, SF6 tiene 48 electrones de valencia que nos ayudarán a dibujar la Estructura de Puntos de Lewis del SF6.
SF6 Estructura de Lewis
La estructura de puntos de Lewis de cualquier molécula es una representación pictórica de los átomos involucrados en la formación de la estructura y sus electrones de valencia individuales. Esta estructura nos ayuda a conocer las formaciones de enlaces en la molécula y la disposición de los electrones en ella.
El átomo de azufre tomará la posición central, ya que es menos electronegativo que el flúor. Así que colóquelo en el centro y todos los átomos de flúor a su alrededor de esta manera:
El átomo de flúor necesita solo un electrón de valencia para completar su octeto. Como cada átomo sigue la regla del octeto para lograr una estructura estable, el átomo de flúor compartirá un electrón de valencia del átomo de azufre. Por lo tanto, el azufre compartirá seis de sus electrones de valencia con todos los átomos de flúor que dan lugar a la formación de seis enlaces simples entre S y F.
En la Estructura de Lewis, mostramos los enlaces en la estructura dibujando una línea recta entre dos átomos. Así que todos estos enlaces tomarán 12 electrones de valencia de 48.
Coloque todos los electrones de valencia restantes alrededor de los átomos de flúor y verifique si los octetos de todos los átomos de flúor están completos.
Una vez hecho esto, verás electrones de valencia en las capas exteriores de todos los átomos de flúor, pero el azufre tiene más de 8 electrones en su capa exterior. Esto se debe a que es una excepción al papel de octeto y puede expandir su orbital para acomodar más electrones.
Por lo tanto, esta es la estructura correcta de Lewis de SF6.
Hibridación de SF6
Ahora que conocemos la estructura de Lewis de SF6, ahora podemos determinar la hibridación de los átomos en la molécula. Aquí, como el azufre comparte sus electrones con los átomos de flúor, veremos su hibridación.
La configuración electrónica de SF6 en su estado fundamental es 3s23p4. Pero cuando comparte electrones y está en el estado excitado, los pares de electrones en los orbitales 3s y 3p se desparean. Estos electrones se mueven para llenar los orbitales 3d vacíos más altos. Como resultado, se forman seis orbitales híbridos ( uno de 3s, tres de 3p y dos 3d). Estos orbitales híbridos son los que acomodan los electrones compartidos. Estos orbitales se superponen con los orbitales 2p del átomo de flúor cuando los átomos de azufre y flúor forman enlaces. Estos seis orbitales están en las seis direcciones de la forma de octaedro.
Por lo tanto, el hexafluoruro de azufre tiene hibridación sp3d2.
Ángulo de enlace SF6
Como el azufre comparte sus electrones de valencia con 6 átomos de Flúor, podemos ver que los seis electrones del átomo de azufre se comparten para formar enlaces. El ángulo de unión de F-S-F es de 90 grados.
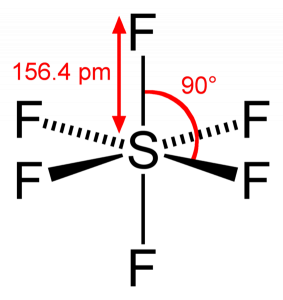
Geometría molecular SF6
Cuando miramos la molécula de hexafluoruro de azufre, el azufre está en la posición central con los átomos de flúor dispuestos simétricamente a su alrededor. Los átomos se colocan en el patrón octaédrico, lo que hace que la geometría molecular de SF6 sea octaédrica.
Forma SF6
Mirando la geometría molecular de la molécula, podemos decir que la molécula SF6 tiene una forma octaédrica ya que tiene ocho lados. Sin embargo, el átomo central se une con seis átomos de flúor, la forma de SF6 es octaédrica.

¿Es SF6 polar o no polar?
SF6 es una molécula no polar. Esto se debe a que la teoría de VSEPR dice que cuando seis átomos de flúor están dispuestos simétricamente alrededor del átomo de azufre, los dipolos de enlace se cancelan. Como resultado, es una molécula no polar.

También tiene las mismas propiedades que las moléculas no polares, como ser no soluble en agua y ser soluble en disolventes orgánicos no polares.
Observaciones finales
Para resumir este artículo, podemos decir que en la estructura de puntos de Lewis de SF6, todos los electrones de valencia se agotan, lo que resulta en la formación de seis enlaces simples entre S-F sin pares de electrones solitarios.
La hibridación de azufre en esta molécula es sp3d2 con ángulos de enlace de 90 grados.
La geometría molecular del SF6 es octaédrica y es una molécula no polar.