Frontières en immunologie
- Introduction
- Les compartiments des cellules T et B et deux Sous-ensembles de cellules Stromales classiques
- Un Sous-ensemble Stromal nouvellement identifié, Cellules réticulaires marginales
- Les MRC et la Voie d’entrée des antigènes dans les ALS
- Les MRC et les Cellules stromales organisatrices du développement de SLO
- Relation entre les MRC et d’autres Sous-ensembles stromaux
- Remodelage des SLO et des Structures Lymphoïdes tertiaires
- Conclusion
- Déclaration de conflit d’intérêts
- Remerciements
Introduction
Les organes/tissus lymphoïdes secondaires (ALS) sont essentiels à l’induction efficace de réponses immunitaires adaptatives. Plusieurs types d’ALS, y compris les ganglions lymphatiques (LNs), la rate et les tissus lymphoïdes associés aux muqueuses (MALTs) tels que les plaques de Peyer (PPs), sont stratégiquement positionnés à divers endroits du corps. Les SLO sont un filtre élaboré qui prélève des antigènes et est équipé de capteurs immunitaires hautement sensibles. Afin de collecter et de filtrer les antigènes étrangers, les ALS contiennent des structures tissulaires spécialisées associées à l’endothélium ou à l’épithélium. Les cellules immunitaires telles que les lymphocytes, les cellules dendritiques (CD) et les macrophages s’accumulent à des densités élevées et forment des compartiments. Une caractéristique remarquable commune à tous les ALS est la localisation séparée des lymphocytes B et des lymphocytes T. L’architecture des SLO est soutenue par plusieurs types de cellules stromales non hématopoïétiques d’origine mésenchymateuse, qui construisent des réseaux et définissent des compartiments (Mueller et Germain, 2009; Roozendaal et Mebius, 2011). Les réseaux stromaux fournissent non seulement un pied fonctionnel, mais aussi un espace pour les activités des cellules immunitaires, ainsi qu’un cadre physique pour le tissu. De plus, de plus en plus de preuves indiquent que les cellules stromales jouent également un rôle essentiel dans la fonction et l’homéostasie des cellules immunitaires (Link et al., 2007; Fletcher et coll., 2010; Suzuki et coll., 2010; Lukacs-Kornek et coll., 2011). Les ALS sont programmés pour se développer à partir de l’anlagène qui se produit à certains endroits et pendant des périodes restreintes chez le fœtus et le nourrisson. De plus, les cellules stromales sont connues pour être importantes pour le développement et la maintenance des ALS (Mebius, 2003). Ici, je me concentre sur un sous-ensemble stromal récemment identifié, les cellules réticulaires marginales (MRC), et je résume leurs caractéristiques. Je discute également de la relation entre les MRC et la structure tissulaire, d’autres sous-ensembles stromaux et les fonctions immunologiques.
Les compartiments des cellules T et B et deux Sous-ensembles de cellules Stromales classiques
Comme décrit ci-dessus, les cellules B et les cellules T se localisent dans des régions distinctes au sein des OSL. Les cellules B s’accumulent pour former des follicules (zone B) dans le cortex externe sous la capsule dans le LNs ou dans la gaine lymphoïde périartériolaire externe (PALS) dans la rate. Un groupe de gros follicules est le tissu central du SPp. Au cours des réponses immunitaires, les cellules B activées dans les follicules forment des centres germinaux, où elles se différencient en producteurs d’anticorps de haute affinité (Cyster et al., 2000). En revanche, les cellules T se localisent dans une zone séparée (zone T) adjacente aux follicules, c’est-à-dire le paracortex dans le LNs, les PALS internes dans la rate ou la région interfolliculaire (IFR) dans le PPs. Les CD s’accumulent également dans la zone T pour présenter l’antigène et les lymphocytes T principaux (Steinman et al., 1997).
Il existe deux types différents de sous-ensembles stromaux mésenchymateux dans les zones B et T (Figure 1A). Les cellules dendritiques folliculaires (FDCS) forment un réseau dense au centre des follicules et ont reçu une attention considérable en raison de leur importance dans la production d’anticorps par les cellules B (Tew et al., 1997; Cyster et coll., 2000; Victoratos et coll., 2006; Suzuki et coll., 2010). Les FDCS expriment CR1/CD35, CD23 et parfois MAdCAM-1 (Szabo et al., 1997; Cyster et coll., 2000). En revanche, un réseau élaboré de cellules réticulaires fibroblastiques (FRC) comprend l’échafaudage de la zone T, qui produit la podoplanine/gp38 et divers composants de la matrice extracellulaire (ECM) (Gretz et al., 1997; Luther et coll., 2000; Kaldjian et coll., 2001; Katakai et coll., 2004a, b). En général, la migration et la localisation des cellules immunitaires sont régulées par une variété de chimiokines (Mackay, 2001). Les lymphocytes au repos et les CD matures sont très sensibles aux « chimiokines homéostatiques » (Cyster, 1999; Müller et al 2003). En conséquence, il existe des corrélations claires entre les chimiokines produites par les sous-ensembles de cellules stromales et la localisation des cellules immunitaires exprimant les récepteurs correspondants; Le CXCL13 produit par les FDCs est un attractif des cellules B exprimant le CXCR5, tandis que le CCL19 et le CCL21 des FRC de la zone T attirent les lymphocytes T et les CD matures par le récepteur commun CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et coll., 2000). De plus, on pense que les lymphocytes qui migrent de manière robuste dans le parenchyme tissulaire pour scanner les antigènes utilisent les réseaux stromaux comme point d’ancrage (Bajénoff et al 2006). Une variété de facteurs produits par les sous-ensembles stromaux sont également nécessaires à l’activation et à la survie des cellules immunitaires (Cyster et al., 2000; Huber et coll., 2005; Link et coll., 2007; Suzuki et coll., 2010; Lukacs-Kornek et coll., 2011; Malhotra et coll., 2012). Par conséquent, la structure et la fonction du réseau stromal dans chaque compartiment sont probablement optimisées pour l’activité des sous-ensembles de cellules immunitaires.
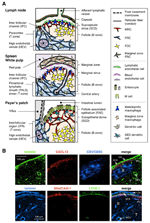
FIGURE 1. Sous-ensembles de cellules stromales et structures tissulaires des ALS. (A) Représentation schématique des structures tissulaires dans les ALS de souris, en mettant l’accent sur les cellules stromales et l’appareil de transport de l’antigène. Les éléments stromaux, y compris les cellules mésenchymateuses, endothéliales et épithéliales ainsi que les cellules myéloïdes telles que les macrophages et les cellules dendritiques (listées dans le panneau de droite), sont mis en évidence. (B) Supérieur: Structure tissulaire construite par trois types différents de cellules stromales dans la région corticale externe de LN. Immunocoloration fluorescente d’une section LN de souris. Dans la micrographie supérieure, il y a un petit follicule au repos (B) sans centre germinal, qui est soutenu par des FDCS exprimant CR1 / CD35 mais des niveaux indétectables de CXCL13. Au lieu de cela, les MRC forment un réseau réticulaire laminine + CXCL13 + dans le bord externe du follicule sous la capsule (CA) et le SCS. Le réseau construit par FRCs dans le paracortex (T) est laminine + CXCL13-CR1/CD35-. Inférieur: La couche de MAdCAM-1+ MRC est étroitement associée à la couche endothéliale lymphatique LYVE-1+ dans le SCS. Notez que la couche MRC est étendue à la zone IFC.
Le réseau stromal dans la zone T est composé de FRC et d’un faisceau ECM appelé fibre réticulaire, qui forme un « conduit » facilitant le passage de substances de faible poids moléculaire (Gretz et al., 1997, 2000; Nolte et coll., 2003). Ce conduit transporte divers facteurs et antigènes solubles profondément dans le tissu, tandis que les particules et les grosses molécules sont principalement exclues des compartiments lymphocytaires. En effet, les chimiokines lymphatiques des tissus périphériques sont rapidement transportées vers la veinule endothéliale supérieure par le conduit pour contrôler la mobilisation des cellules circulantes dans le LNs (Palframan et al., 2001). De plus, certains CD résidents entrent directement en contact avec le conduit et capturent les antigènes lymphatiques (Sixt et al., 2005).
Un Sous-ensemble Stromal nouvellement identifié, Cellules réticulaires marginales
La marge externe du cortex LN, juste sous la capsule, est entourée par le sinus sous-capsulaire (SCS; Figure 1A). La surface luminale du SCS est recouverte de cellules endothéliales lymphatiques et leur côté cortical est soutenu par la membrane basale, appelée « plancher » (Szakal et al., 1983). En particulier dans les IFRs, les fibres réticulaires se propagent du sol dans le paracortex (Gretz et al., 1997). Il est important de noter qu’une fine couche de structure réticulaire est également observée dans la région la plus externe des follicules. Les cellules stromales de type FRC dans le réticulum folliculaire expriment CXCL13 et MAdCAM-1 mais pas CCL21, ce qui indique que ces cellules sont distinctes des FRC de la zone T, tandis que le marqueur FDC CR1 / CD35 n’a pas été détecté ou n’a été que faiblement exprimé dans ces cellules (Katakai et al., 2008; Figures 1B et 2A). Les FDCS ne génèrent pas de fibres réticulaires et, par conséquent, le marqueur réticulaire ER-TR7 est pratiquement absent au centre des follicules (Katakai et al., 2004a, b). De plus, les cellules réticulaires de la région sous-capsulaire expriment spécifiquement RANKL/TRANCE, qui est une cytokine de la famille des TNF essentielle au développement de LN (Dougall et al., 1999; Kong et coll., 1999). Par conséquent, ces cellules stromales étaient considérées comme un nouveau sous-ensemble stromal et étaient désignées cellules réticulaires marginales (MRCs; Katakai et al., 2008). Il est à noter qu’une quantité importante de CXCL13 est exprimée constitutivement en MRC dans les petits follicules au repos, même si les FDCS expriment des niveaux indétectables de CXCL13 (Figure 1B). Il est bien établi que le bord externe des PALS dans la rate, en particulier celui qui se trouve au-dessus des follicules, est bordé par une couche stromale MAdCAM-1 +. Les cellules qui constituent le revêtement de la membrane basale sous le sinus marginal (MS) expriment également CXCL13 et RANKL, indiquant que ces cellules sont un type de MRC (Katakai et al., 2008). Dans les MALTs, les cellules réticulaires similaires aux MRC forment un réseau dans la région du dôme sous-épithélial (SED) juste sous la membrane basale de l’épithélium associé aux follicules (FAE; Katakai et al., 2008; Knoop et coll., 2009). Pris ensemble, les MRC sont considérés comme un sous-ensemble stromal commun aux ALS mais distinct des FDCS et des FRC.
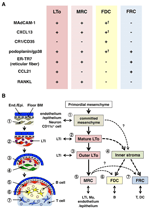
FIGURE 2. Relation entre les MRC et d’autres sous-ensembles de cellules stromales dans les SLO. (A) Modèle d’expression des marqueurs dans les sous-ensembles de cellules stromales. Les niveaux d’expression de MAdCAM-1, de CXCL13 et de podoplanine/gp38 dans les FDCS sont souvent faibles ou indétectables par immunohistochimie (†). (B) Schéma d’un modèle généralisé de développement SLO avec les emplacements des sous-ensembles de cellules stromales (à gauche) et une généalogie putative des sous-ensembles de cellules stromales (à droite). Les nombres indiquant les éléments de cellules dans le dessin de gauche représentent les sous-ensembles de cellules stromales représentés dans le schéma de droite. BM, membrane basale; Fin./ Epi., couche endothéliale ou épithéliale.
Les MRC et la Voie d’entrée des antigènes dans les ALS
Les organes lymphoïdes secondaires sont caractérisés par des structures particulières qui filtrent et transportent les antigènes dans les compartiments lymphocytaires (Figure 1A). Les LNS sont connectés aux vaisseaux lymphatiques pour étudier les antigènes lymphatiques. Parce que les lymphatiques afférents sont ouverts au SCS, l’endothélium lymphatique sinusal et la membrane basale du sol sont, pour ainsi dire, la surface avant du filtre LN. La rate filtre le sang, dans lequel les branches de l’artère centrale s’ouvrent sur la SEP et la zone marginale (MZ), où les cellules immunitaires surveillent le contenu sanguin. Dans ces structures sinusales spécialisées, les barrières frontalières sont l’endothélium lymphatique dans le SCS de la LN et l’endothélium sanguin dans la SEP de la rate, tous deux supportés par le réticulum MRC. Fait intéressant, les macrophages métallophiles CD169+ sont répartis sélectivement près de la muqueuse sinusale sur les follicules, dont certains se déposent à travers la barrière endothéliale et transportent les antigènes particulaires de la lumière sinusale dans le compartiment lymphocytaire (Szakal et al., 1983; Taylor et coll., 2005; Carrasco et Batista, 2007; Phan et coll., 2009). Les CD qui transportent des antigènes des tissus via les vaisseaux lymphatiques arrivent au SCS et se déplacent ensuite dans le paracortex à travers le plancher du canal interfolliculaire (IFC; Steinman et al., 1997; Katakai et coll., 2004b; Braun et coll., 2011). Chez les MALTs, l’EAF fonctionne comme la barrière dans laquelle une cellule épithéliale spécialisée appelée cellules M transfère des bactéries ou des particules de la lumière intestinale vers des CD sous-jacents ou des macrophages (Kraehenbuhl et Neutra, 2000). Par conséquent, les MRC soutiennent l’appareil de transport d’antigènes de première ligne dans chaque SLO. La conception de base des ALS est que les follicules sont principalement disposés vers le site d’entrée de l’antigène et sont accompagnés de zones T. Ainsi, d’un point de vue stromal, toute l’architecture tissulaire semble être organisée vers la couche MRC.
Bien que les fonctions immunologiques des MRC restent insaisissables, il a été précédemment montré que le réseau de conduits construit par les MRC dans le follicule externe transporte de petits antigènes solubles vers les cellules B folliculaires et les CMD (Bajénoff et Germain, 2009; Roozendaal et al., 2009). La plupart des macrophages CD169+ sont positionnés du côté cortical du plancher SCS et font saillie dans la lumière des sinus pour capturer les particules (Phan et al., 2009). Ainsi, les MRC pourraient être impliquées dans la localisation, la morphologie et la fonction de ces macrophages. Le développement de cellules M dans le PPs nécessite une signalisation de RANG de RANKL, qui est probablement contrôlée par un réseau MRC exprimant le RANKL juste sous la FAE (Knoop et al., 2009). L’inhibition de la voie LT, qui abolit les signatures MRC dans la pulpe blanche splénique, perturbe la structure de la SEP (Koike et al., 1996; Balogh et coll., 2007; Katakai et coll., 2008; Zindl et coll., 2009). De plus, l’expression élevée d’ICAM-1, VCAM-1 et CXCL13 implique que les MRC sont impliquées dans la migration interstitielle dynamique des cellules folliculaires B en tant qu’échafaudage fonctionnel. Il a été démontré que les macrophages CD169+ délivrent directement des antigènes particulaires aux cellules B spécifiques de l’antigène dans cette zone (Carrasco et Batista, 2007; Phan et al., 2009), suggérant que le contrôle de la migration des lymphocytes B par le réseau MRC pourrait avoir un impact sur ce processus. Étant donné que les MRC sont également présents dans la région IFC, ils régulent éventuellement la transmigration des DCS du SCS vers la zone T.
Les MRC et les Cellules stromales organisatrices du développement de SLO
Les organes lymphoïdes secondaires se développent à partir de l’anlagène, qui sont des agrégats de cellules mésenchymateuses et hématopoïétiques associées à des vaisseaux ou à l’épithélium, à un site et à une période définis chez le fœtus ou le nourrisson (Mebius, 2003). Un événement critique dans le développement de l’anlagène SLO est l’accumulation de cellules hématopoïétiques CD45 + CD4 + CD3, également appelées cellules inductrices de tissus lymphoïdes (LTi) qui interagissent avec des cellules stromales mésenchymateuses appelées cellules organisatrices de tissus lymphoïdes (LTo) (Mebius et al., 1997). Une cytokine de la famille des TNF, la lymphotoxine (LT)-α1β2 exprimée par les cellules LTi transmet des signaux aux cellules LTo via le récepteur LT-β. Les cellules LTo induisent ensuite l’expression de molécules d’adhésion, notamment ICAM-1, VCAM-1 et MAdCAM-1, et les chimiokines CXCL13, CCL19 et CCL21 (Honda et al., 2001; Cupedo et coll., 2004a; Bénézech et al 2010). En particulier, CXCL13 est particulièrement important pour attirer les cellules LTi vers l’anlagène via son récepteur CXCR5 (Finke et al., 2002; Luther et coll., 2003; Ohl et coll., 2003). On suppose qu’une boucle de rétroaction positive, c’est-à-dire les cellules LTi nouvellement immigrantes qui produisent LT activent davantage les cellules stromales LTo, favorisant l’organisation de l’anlagen. Lorsque les lymphocytes ont commencé à s’accumuler après la naissance, le tissu se dilate et les compartiments supportés par différents sous-ensembles de cellules stromales sont induits (Cupedo et al., 2004b; Bajénoff et Germain 2009).
Les cellules réticulaires marginales et les cellules LTo expriment un modèle très similaire de divers marqueurs (Figure 2A), suggérant qu’il existe une certaine relation entre ces deux cellules stromales. Les cellules LTo semblent être plus concentrées dans la région marginale de l’anlagène LN adjacente au sinus lymphatique du SCS présumé (Finke et al., 2002; Cupedo et coll., 2004a; Eberl et coll., 2004; Katakai et coll., 2008). Cette couche de cellules LTo semble s’étendre vers l’extérieur avec la croissance de l’anlagène, qui semble finalement devenir la couche MRC (Katakai et al., 2008). De même, lorsque les lymphocytes s’accumulent autour de l’artère centrale de la rate postnatale, les cellules LTo exprimant MAdCAM-1 et RANKL se dilatent avec la couche et deviennent des MRC dans la pulpe blanche. Ces résultats suggèrent fortement que les MRC sont un descendant direct du stroma LTo, qui préservent les caractéristiques des cellules LTo sur des sites spécialisés dans les ALS. Même les souris déficientes en CHIFFON présentent une couche de MRC sous-capsulaire dans les LNs atrophiques et des gaines de MRC périartérielles rétrécies dans la rate, ce qui indique que le développement de MRC se produit indépendamment des cellules B et T et est programmé avant leur colonisation (Katakai et al., 2008). Étant donné que les ALS échantillonnent efficacement les antigènes pour déclencher des réponses immunitaires, les structures collectrices d’antigènes qui sont construites pendant le développement doivent être maintenues par la suite. En conséquence, il est raisonnable que ces structures tissulaires soient maintenues par des cellules stromales de type organisateur tout au long de l’âge adulte.
Relation entre les MRC et d’autres Sous-ensembles stromaux
La figure 2B montre la généalogie possible des sous-ensembles stromaux dans les ALS. Dans l’embryon, le mésenchyme primordial qui se trouve à proximité du système vasculaire ou de l’épithélium est engagé pour former le noyau de l’anlage et attire les cellules LTi. Des cellules nerveuses ou d’autres cellules moins caractérisées sont également impliquées dans le processus initial (Veiga-Fernandes et al., 2007; van de Pavert et coll., 2009). L’accumulation de cellules LTi facilite la maturation des cellules mésenchymateuses en cellules LTo, ce qui facilite finalement la construction de l’architecture de base. Typiquement, les cellules LTo ont tendance à se concentrer à la périphérie de l’anlage et à se développer vers l’extérieur avec la croissance tissulaire, tandis que les cellules stromales présentant des signatures LTo faibles ou inexistantes augmentent inversement dans la partie interne de l’anlage. La colonisation postnatale des cellules B et T conduit à des compartiments avec induction de sous-ensembles stromaux conventionnels.
Si ce schéma est correct, il s’ensuit que tous les sous-ensembles stromaux des ALS adultes sont à l’origine dérivés de cellules LTo. Ainsi, les MRC qui préservent les caractéristiques des cellules LTo ont-elles la capacité de se différencier en FDCS ou FRC? Les MRC partagent de nombreuses signatures avec d’autres sous-ensembles (figure 2A), ce qui suggère que cela est possible. Une spéculation est que les MRC fonctionnent comme des cellules souches stromales qui alimentent en permanence tous les sous-ensembles stromaux tout au long de l’âge adulte. Bien que cette idée soit intrigante, elle nécessitera un examen prudent et une validation plus poussée à l’avenir. Les cellules mésenchymateuses sont généralement de nature très flexible en fonction de l’environnement environnant, et ainsi des caractéristiques spécifiques peuvent être facilement modifiées. La culture prolongée de cellules stromales isolées de LNs entraîne une perte d’expression de nombreux gènes, en particulier des chimiokines homéostatiques (Katakai et al., 2004a; Tomei et coll., 2009). Cela suggère que les phénotypes in vivo des sous-ensembles de cellules stromales sont maintenus de manière optimale par les circonstances tissulaires, qui sont réversibles et non dues à la différenciation terminale. De plus, les stimuli inflammatoires induisent la prolifération robuste des cellules stromales et le remodelage spectaculaire des ALS (Katakai et al., 2004a; Chyou et coll., 2011). Par conséquent, bien que les MRC puissent être convertis en d’autres sous-ensembles, les sous-ensembles stromaux conventionnels pourraient également s’auto-renouveler et être interchangeables dans les ALS adultes.
Remodelage des SLO et des Structures Lymphoïdes tertiaires
Au cours des réponses immunitaires, les structures stromales au sein des SLO sont considérablement remodelées (Gretz et al., 1997; Katakai et coll., 2004a). Certaines infections provoquent une perturbation sévère des structures tissulaires dans le LNs et la pulpe blanche splénique en quelques jours, qui est rétablie lorsque les agents pathogènes sont éradiqués (Mueller et al., 2007a, b; Scandella et coll., 2008; Saint Jean et Abraham, 2009). Ce processus de restauration résume probablement un processus d’auto-organisation via une réaction de rétroaction similaire au développement de SLO. Fait important, les cellules de type LTi sont également présentes dans les tissus adultes et régulent le remodelage des ALS associé à l’infection (Kim et al., 2003; Scandella et coll., 2008). Bien que le rôle des MRC dans de tels processus soit inconnu, ils ont peut-être un rôle d’organisation en collaboration avec des cellules de type LTi et déterminent le cadre externe des ALS lors de la reconstruction.
Dans l’inflammation chronique associée à diverses pathologies organiques, un grand nombre de lymphocytes infiltrants conduisent souvent à des organisations similaires aux ALS, appelées tissus lymphoïdes tertiaires (TLTS; Drayton et al., 2006). Les cellules B et T sont séparées et des réseaux correspondants de sous-ensembles de cellules stromales sont induits. Il serait intéressant de déterminer si des MRC sont présentes dans ces structures lymphoïdes ectopiques; cependant, les cellules de type MRC et les structures tissulaires connexes ne sont pas observées dans les TLT qui se sont développées au cours de la gastrite auto-immune de souris (Katakai et al., 2006, 2008). Il convient de souligner que les TLT ne sont fondamentalement pas des organisations lymphoïdes programmées et ne s’associent naturellement pas aux structures de transport d’antigènes. Par conséquent, les MRC sont probablement absentes dans les TLT. Même si des cellules stromales phénotypiquement similaires aux MRC pourraient être induites dans certaines lésions, elles ne seraient pas identifiées comme des MRC à moins qu’elles ne s’associent étroitement à la structure endothéliale ou épithéliale spécifique et ne forment un réticulum en couches au niveau des follicules externes.
Conclusion
Les cellules réticulaires marginales sont un sous-ensemble de cellules stromales unique commun aux ALS. Les MRC sont clairement différentes des sous-ensembles conventionnels induits ou mûris par des interactions avec les lymphocytes après la naissance, et sont directement dérivées des cellules stromales LTo dans l’anlagène et indépendantes des lymphocytes. Le réseau de MRC est étroitement associé à l’appareil de transport d’antigènes des ALS et on pense qu’il contrôle directement ou indirectement l’administration d’antigènes dans les compartiments lymphocytaires ainsi que la localisation et la migration des cellules immunitaires. Les MRC jouent probablement un rôle central dans le maintien des structures de SLO comme cadre externe et peuvent être converties en d’autres sous-ensembles stromaux à l’état d’équilibre ou lors du remodelage tissulaire. Il sera important de considérer collectivement tous les sous-ensembles stromaux, les structures tissulaires et les microenvironnements immunologiques afin de comprendre de manière globale le système SLO.
Déclaration de conflit d’intérêts
L’auteur déclare que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Ce travail a été soutenu en partie par une Subvention pour les Jeunes Scientifiques et pour la Recherche Scientifique sur des Domaines Innovants du Ministère de l’Éducation, de la Culture, des Sports, de la Science et de la Technologie du Japon.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., et Germain, R. N. (2006). Les réseaux de cellules stromales régulent l’entrée, la migration et la territorialité des lymphocytes dans les ganglions lymphatiques. Immunité 25, 989-1001.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef
Bajénoff, M., et Germain, R. N. (2009). Le développement des follicules à cellules B remodèle le système de conduits et permet la livraison d’antigènes solubles aux cellules dendritiques folliculaires. Sang 114, 4989-4997.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H., et Weih, F. (2007). Rôles distincts de la signalisation lymphotoxine-bêta et du facteur de transcription de l’homéodomaine Nkx2.3 dans l’ontogenèse des compartiments endothéliaux de la rate. Tissu cellulaire Res. 328, 473-486.
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G. et Caamaño, J. H. (2010). Ontogenèse des cellules organisatrices stromales pendant le développement des ganglions lymphatiques. J. Immunol. 184, 4521–4530.
Résumé de Pubmed / Texte intégral de Pubmed
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A. et Förster, R. (2011). Les lymphocytes T afférents dérivés de la lymphe et les CD utilisent différentes voies dépendantes du récepteur de la chimiokine CCR7 pour l’entrée dans le ganglion lymphatique et la migration intranodale. NAT. Immunol. 12, 879–887.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Carrasco, Y. R., et Batista, F. D. (2007). Les cellules B acquièrent un antigène particulaire dans une zone riche en macrophages à la limite entre le follicule et le sinus sous-capsulaire du ganglion lymphatique. Immunité 27, 160-171.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. et Lu, T. T. (2011). Régulation coordonnée de la croissance vasculaire-stromale des ganglions lymphatiques d’abord par les cellules CD11c +, puis par les cellules T et B. J. Immunol. 187, 5558–5567.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G. et Mebius, R. E. (2004a). Les organisateurs de ganglions lymphatiques présumés sont représentés de manière différentielle dans les ganglions mésentériques et périphériques en développement. J. Immunol. 173, 2968–2975.
Résumé Pubmed / Texte intégral Pubmed
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., et Mebius, R. E. (2004b). L’initiation de l’organisation cellulaire dans les ganglions lymphatiques est régulée par des signaux dérivés de cellules non B et ne dépend pas du ligand 13 de la chimiokine CXC. J. Immunol. 173, 4889–4896.
Résumé Pubmed / Texte intégral Pubmed
Cyster, J. G. (1999). Chimiokines et migration cellulaire dans les organes lymphoïdes secondaires. Science 286, 2098-2102.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S.a., et Ngo, V. N. (2000). Cellules stromales folliculaires et lymphocytes se dirigeant vers les follicules. Immunol. Apoc. 176:181-193.
Pubmed Résumé | Pubmed Texte Intégral | CrossRef Texte Intégral
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., et Schuh, J. (1999). Le RANG est essentiel pour le développement des ostéoclastes et des ganglions lymphatiques. Gènes Dev. 13, 2412–2424.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Drayton, D. L., Liao, S., Mounzer, R. H. et Ruddle, N. H. (2006). Développement des organes lymphoïdes: de l’ontogenèse à la néogenèse. NAT. Immunol. 7, 344–353.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y. et Littman, D. R. (2004). Une fonction essentielle pour le récepteur nucléaire RORy (t) dans la génération de cellules inducatrices du tissu lymphoïde fœtal. NAT. Immunol. 5, 64–73.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M. et Kraehenbuhl, J. (2002). Les cellules CD4+ CD3 induisent le développement du patch de Peyer : rôle de l’activation de l’intégrine α4β1 par CXCR5. Immunité 17, 363-373.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L. et Turley, S. J. (2010). Les cellules réticulaires fibroblastiques des ganglions lymphatiques présentent directement l’antigène des tissus périphériques dans des conditions d’équilibre et inflammatoires. J. Exp. Med. 207, 689–697.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Gretz, J. E., Anderson, A. O., et Shaw, S. (1997). Cordons, canaux, couloirs et conduits: éléments architecturaux critiques facilitant les interactions cellulaires dans le cortex ganglionnaire. Immunol. Rév. 156, 11-24.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., et Shaw, S. (2000). Les chimiokines lymphatiques et d’autres molécules de faible poids moléculaire atteignent des veinules endothéliales élevées via des conduits spécialisés tandis qu’une barrière fonctionnelle limite l’accès aux microenvironnements des lymphocytes dans le cortex ganglionnaire. J. Exp. Med. 192, 1425–1440.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral Croisé
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., et Nishikawa, S.-I. (2001). Base moléculaire de l’interaction hématopoïétique / mésenchymateuse lors de l’initiation de l’organogenèse du patch de Peyer. J. Exp. Med. 193, 621–630.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G. et Aguzzi, A. (2005). Gènes dépendants des récepteurs de la lymphotoxine β dans les transcriptomes des ganglions lymphatiques et des cellules dendritiques folliculaires. J. Immunol. 174, 5526–5536.
Résumé de Pubmed / Texte intégral de Pubmed
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y. et Shaw, S. (2001). Organisation spatiale et moléculaire du cortex des lymphocytes T ganglionnaires: cavité labyrinthique délimitée par une monocouche ressemblant à un épithélium de cellules réticulaires fibroblastiques ancrées à une matrice extracellulaire ressemblant à une membrane basale. Int. Immunol. 13, 1243–1253.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral Croisé
Katakai, T., Hara, T., Sugai, M., Gonda, H. et Shimizu, A. (2004a). Les cellules réticulaires fibroblastiques des ganglions lymphatiques construisent le réticulum stromal par contact avec les lymphocytes. J. Exp. Med. 200, 783–795.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral Croisé
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M. et Shimizu, A. (2004b). Une nouvelle structure stromale réticulaire dans le cortex ganglionnaire : une plateforme immunologique pour les interactions entre les cellules dendritiques, les cellules T et les cellules B. Int. Immunol. 16, 1133–1142.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral Croisé
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S. et Shimizu, A. (2006). Néogenèse lymphoïde spontanée à grande échelle et auto-immunité équilibrée par rapport à la tolérance dans l’estomac de souris transgéniques TCR réactives à l’ATPase H + / K +. J. Immunol. 177, 7858–7867.
Résumé de Pubmed / Texte intégral de Pubmed
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., et Shimizu, A. (2008). Couche de cellules stromales réticulaires de type organisateur commune aux organes lymphoïdes secondaires adultes. J. Immunol. 181, 6189–6200.
Résumé de Pubmed / Texte intégral de Pubmed
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, Md, et Lane, J. P. (2003). CD4+ CD3 – les cellules accessoires costimulent les lymphocytes T CD4 amorcés à travers OX40 et CD30 aux sites où les lymphocytes T collaborent avec les lymphocytes B. Immunité 18, 643-654.
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral Croisé
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H. et Williams, I. R. (2009). RANKL est nécessaire et suffisant pour initier le développement de cellules M à échantillonnage d’antigènes dans l’épithélium intestinal. J. Immunol. 183, 5738–5747.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral Croisé
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. et Miyasaka, M. (1996). La zone marginale splénique est absente chez les souris alyphoplastiques mutantes aly. EUR. J. Immunol. 26, 669–675.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral CrossRef
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L. Il s’agit de l’un des principaux facteurs de l’évolution de la santé et de la santé au Canada, notamment le développement de la santé et de la promotion de la santé et de la promotion de la santé. L’OPGL est un régulateur clé de l’ostéoclastogenèse, du développement des lymphocytes et de l’organogenèse des ganglions lymphatiques. Nature 397, 315-323.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Kraehenbuhl, J. P., et Neutra, M. R. (2000). Cellules épithéliales M: différenciation et fonction. Annu. Rév. Cell Dev. Biol. 16, 301–332.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Lien, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., et Luther, S.a. (2007). Les cellules réticulaires fibroblastiques des ganglions lymphatiques régulent l’homéostasie des lymphocytes T naïfs. NAT. Immunol. 8, 1255–1265.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., et Turley, S. J. (2011). La libération régulée d’oxyde nitrique par le stroma non hématopoïétique contrôle l’expansion du pool de lymphocytes T activés dans les ganglions lymphatiques. NAT. Immunol. 12, 1096–1104.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Luther, S.A., Tang, H. L., Hyman, P. L., Farr, A. G., et Cyster, J. G. (2000). Coexpression des chimiokines ELC et SLC par les cellules stromales de la zone T et délétion du gène ELC chez la souris plt/plt. Proc. Natl. Acad. Sci. États-Unis 97, 12694-12699.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef
Luther, S.A., Ansel, K. M., et Cyster, J. G. (2003). Rôles chevauchants des ligands CXCL13, du récepteur α de l’interleukine 7 et du CCR7 dans le développement des ganglions lymphatiques. J. Exp. Med. 197, 1191–1198.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Mackay, C. R. (2001). Chimiokines: facteurs d’impact élevés de l’immunologie. NAT. Immunol. 2, 95–101.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral CrossRef
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., et le Consortium du Projet Immunological Genome. (2012). Le profilage transcriptionnel du stroma des ganglions lymphatiques enflammés et au repos définit les caractéristiques immunologiques. NAT. Immunol. 13, 499–510.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Mebius, R. E., Rennert, P., et Weissman, I. L. (1997). Les ganglions lymphatiques en développement recueillent les cellules CD4 + CD3-LTß+ qui peuvent se différencier en cellules APC, NK et folliculaires, mais pas en lymphocytes T ou B. Immunité 7, 493-504.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Mebius, R. E. (2003). Organogenèse des tissus lymphoïdes. NAT. Rév. Immunol. 3, 292–303.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R. et Matloubian, M. (2007a). Regulation of homeostatic chemokine expression and cell trafficking during immune responses. Science 317, 670-674.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral Croisé
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., et Ahmed, R. (2007b). Le ciblage viral des cellules réticulaires fibroblastiques contribue à l’immunosuppression et à la persistance lors d’une infection chronique. Proc. Natl. Acad. Sci. États-Unis 104, 15430-15435.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Mueller, S. N., et Germain, R. N. (2009). La cellule stromale contribue à l’homéostasie et à la fonctionnalité du système immunitaire. NAT. Rév. Immunol. 9, 618–629.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Müller, G., Höpken, U.E., et Lipp, M. (2003). L’impact du CCR7 et du CXCR5 sur le développement des organes lymphoïdes et l’immunité systémique. Immunol. Rév. 195, 117-135.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., et Mebius, R. E. (2003). Un système de conduit distribue les chimiokines et les petites molécules transmises par le sang à travers la pulpe blanche splénique. J. Exp. Med. 198, 505–512.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., et Förster, R. (2003). Mécanismes de coopération de CXCR5 et CCR7 dans le développement et l’organisation des organes lymphoïdes secondaires. J. Exp. Med. 197, 1199–1204.
Résumé de Pubmed | Texte intégral de Pubmed / Texte intégral croisé
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., et von Andrian, U. H. (2001). Transport et présentation inflammatoires de la chimiokine dans le VHE: un mécanisme de contrôle à distance pour le recrutement de monocytes aux ganglions lymphatiques dans les tissus enflammés. J. Exp. Med. 194, 1361–1373.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y. et Cyster, J. G. (2009). Le relais du complexe immunitaire par les macrophages des sinus sous-capsulaires et les cellules B non reconnues entraîne la maturation de l’affinité des anticorps. NAT. Immunol. 10, 786–793.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef
Roozendaal, R., Mempel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H. et Carroll, M. C. (2009). Les conduits assurent la médiation du transport de l’antigène de faible poids moléculaire vers les follicules ganglionnaires. Immunité 30, 264-276.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Roozendaal, R., et Mebius, R. E. (2011). Interactions cellules stromales-cellules immunitaires. Annu. Rév. Immunol. 29, 23–43.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral Croisé
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S.A., Junt, T., et Ludewig, B. (2008). Restauration de l’intégrité des organes lymphoïdes par l’interaction des cellules inductrices de tissus lymphoïdes avec le stroma de la zone des lymphocytes T. NAT. Immunol. 9, 667–675.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral Croisé
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B. et Sorokin, L. (2005). Le système de conduit transporte les antigènes solubles de la lymphe afférente vers les cellules dendritiques résidentes dans la zone des lymphocytes T du ganglion lymphatique. Immunité 22, 19-29.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Steinman, R. M., Pack, M., et Inaba, K. (1997). Cellules dendritiques dans les zones des lymphocytes T des organes lymphoïdes. Immunol. Rév. 156, 25-37.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
St John, A. L., et Abraham, S. N. (2009). La salmonelle perturbe l’architecture des ganglions lymphatiques par la suppression des chimiokines homéostatiques médiée par TLR4. NAT. Med. 15, 1259–1265.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral CrossRef
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W. et Fagarasan, S. (2010). La détection des stimuli environnementaux par les cellules dendritiques folliculaires favorise une génération d’immunoglobulines dans l’intestin. Immunité 33, 71-83.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Szabo, M. C., Butcher, E. C., et McEvoy, L.M. (1997). Spécialisation des cellules dendritiques folliculaires muqueuses révélée par l’affichage de la molécule d’adhésion de l’adresse muqueuse-cellule-1. J. Immunol. 158, 5584–5588.
Résumé de Pubmed / Texte intégral de Pubmed
Szakal, A. K., Holmes, K. L., et Tew, J. G. (1983). Transport des complexes immuns du sinus sous-capsulaire aux follicules ganglionnaires à la surface des cellules nonphagocytaires, y compris les cellules à morphologie dendritique. J. Immunol. 131, 1714–1727.
Résumé de Pubmed / Texte intégral de Pubmed
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D. et Gordon, S. (2005). Récepteurs des macrophages et reconnaissance immunitaire. Annu. Rév. Immunol. 23, 901–944.
Résumé Pubmed / Texte intégral Pubmed / Texte intégral CrossRef
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F. et Szakal, A. K. (1997). Cellules dendritiques folliculaires et présentation de l’antigène et des signaux costimulateurs aux cellules B. Immunol. Rév. 156, 39-52.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Tomei, A.A., Siegert, S., Britschgi, M. R., Luther, S.A. et Swartz, M.A. (2009). Le flux de fluide régule l’organisation des cellules stromales et l’expression du CCL21 dans un microenvironnement ganglionnaire par ingénierie tissulaire. J. Immunol. 183, 4273–4283.
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral CrossRef
van de Pavert, S.A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J. et Mebius, R. E. (2009). La chimiokine CXCL13 est essentielle à l’initiation des ganglions lymphatiques et est induite par l’acide rétinoïque et la stimulation neuronale. NAT. Immunol. 10, 1193–1199.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral Croisé
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V. et Kioussis, D. (2007). Le récepteur de la tyrosine kinase RET est un régulateur clé de l’organogenèse du patch de Peyer. Nature 446, 547-551.
Résumé Pubmed | Texte intégral Pubmed / Texte intégral CrossRef
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., et Kollias, G. (2006). Fonctions spécifiques du FDC du p55TNFR et de l’IKK2 dans le développement des réseaux de FDC et des réponses anticorps. Immunité 24, 65-77.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., et Chaplin, D.D. (2009). La lymphotoxine LTa1ß2 contrôle la structure et la fonction vasculaires du sinus marginal de la rate postnatale et adulte. Immunité 30, 408-420.
Résumé Pubmed / Texte Intégral Pubmed / Texte intégral CrossRef