Idiopathic intracranial hypertension
Assessment | Biopsychology | Comparative |Cognitive | Developmental | Language | Individual differences |Personality | Philosophy | Social |
Methods | Statistics |Clinical | Educational | Industrial |Professional items |World psychology |
Biological:Behavioural genetics · Evolutionary psychology · Neuroanatomy · Neurochemistry · Neuroendocrinology ·Neuroscience · Psychoneuroimmunology · Physiological Psychology · Psychopharmacology(Index, Outline)
MRI brain.jpg|
| ICD-10 | G932 | |
|---|---|---|
| ICD-9 | 348.2 | |
| OMIM | 243200 | |
| DiseasesDB | 1331 | |
| MedlinePlus | 000351 | |
| eMedicine | neuro/329 oph/ 190 neuro/537 | |
| MeSH | {{{MeshNumber}}} | |
Hypertension intracrânienne idiopathique (IIH), parfois appelée par les anciens noms l’hypertension intracrânienne bénigne (BIH) ou pseudotumor cerebri (PTC), est un trouble neurologique caractérisé par une augmentation de la pression intracrânienne (pression autour de la cerveau) en l’absence d’une tumeur ou d’autres maladies. Les principaux symptômes sont des maux de tête, des nausées et des vomissements, ainsi que des acouphènes pulsatiles (bourdonnement dans les oreilles synchrone avec le pouls), une vision double et d’autres symptômes visuels. Si elle n’est pas traitée, elle peut entraîner un gonflement du disque optique dans l’œil, ce qui peut évoluer vers une perte de vision.
L’IIH est diagnostiqué avec un scanner cérébral (pour exclure d’autres causes) et une ponction lombaire; une ponction lombaire peut également apporter un soulagement temporaire et parfois permanent des symptômes. Certains réagissent aux médicaments (avec l’acétazolamide), mais d’autres nécessitent une intervention chirurgicale pour soulager la pression. La maladie peut survenir dans tous les groupes d’âge, mais elle est plus fréquente chez les jeunes femmes, en particulier celles souffrant d’obésité.
Signes et symptômes
Le symptôme le plus courant de l’IIH est le mal de tête, qui survient dans presque tous les cas (92 à 94%). Il est typiquement pire le matin, généralisé dans le caractère et lancinant dans la nature. Il peut être associé à des nausées et des vomissements. Le mal de tête peut être aggravé par toute activité qui augmente encore la pression intracrânienne, comme la toux et les éternuements. La douleur peut également être ressentie dans le cou et les épaules. Beaucoup ont des acouphènes pulsatiles, une sensation de sifflement dans une ou les deux oreilles (64-87%); ce son est synchrone avec le pouls. Divers autres symptômes, tels qu’engourdissement des extrémités, faiblesse généralisée, perte d’odorat et incoordination, sont rapportés plus rarement; aucun n’est spécifique à l’IIH. Chez les enfants, de nombreux signes et symptômes non spécifiques peuvent être présents.
L’augmentation de la pression entraîne une compression et une traction des nerfs crâniens, un groupe de nerfs provenant du tronc cérébral et alimentant le visage et le cou. Le plus souvent, le nerf abducens (sixième nerf) est impliqué. Ce nerf alimente le muscle qui tire l’œil vers l’extérieur. Ceux qui ont une paralysie du sixième nerf ont donc une vision double horizontale qui est pire lorsqu’ils regardent vers le côté affecté. Plus rarement, le nerf oculomoteur et le nerf trochléaire (troisième et quatrième paralysie nerveuse, respectivement) sont affectés; les deux jouent un rôle dans les mouvements oculaires. Le nerf facial (septième nerf crânien) est affecté occasionnellement the il en résulte une faiblesse totale ou partielle des muscles de l’expression faciale d’un ou des deux côtés du visage.
L’augmentation de la pression entraîne un œdème papillaire, qui est un gonflement du disque optique, l’endroit où le nerf optique pénètre dans le globe oculaire. Cela se produit dans pratiquement tous les cas d’IIH, mais tout le monde n’en ressent pas les symptômes. Ceux qui présentent des symptômes signalent généralement des « obscurcissements visuels transitoires », des épisodes de difficulté à voir qui se produisent dans les deux yeux mais pas nécessairement en même temps. L’œdème papillaire non traité à long terme entraîne une perte visuelle, initialement à la périphérie mais progressivement vers le centre de la vision.
L’examen physique du système nerveux est généralement normal, à l’exception de la présence d’un œdème papillaire, qui est observé lors de l’examen de l’œil avec un petit appareil appelé ophtalmoscope ou plus en détail avec une caméra du fond d’œil. S’il y a des anomalies du nerf crânien, celles-ci peuvent être remarquées lors d’un examen de la vue sous la forme d’un strabisme (troisième, quatrième ou sixième paralysie nerveuse) ou d’une paralysie du nerf facial. Si l’œdème papillaire dure depuis longtemps, les champs visuels peuvent être rétrécis et l’acuité visuelle peut être diminuée. L’analyse du champ visuel par périmétrie automatisée (Humphrey) est recommandée car d’autres méthodes d’analyse peuvent être moins précises. L’œdème papillaire de longue date entraîne une atrophie optique, dans laquelle le disque semble pâle et la perte visuelle a tendance à être avancée.
Causes
« idiopathique » signifie « d’étiologie inconnue ». Par conséquent, l’IIH ne peut être diagnostiqué que s’il n’y a pas d’autre explication des symptômes. La pression intracrânienne peut être augmentée en raison de médicaments tels que des dérivés de vitamine A à forte dose (par exemple, l’isotrétinoïne pour l’acné), des antibiotiques à long terme à base de tétracyclines (pour diverses affections cutanées) et des contraceptifs hormonaux. Il existe de nombreuses autres maladies, principalement des affections rares, qui peuvent entraîner une hypertension intracrânienne. S’il existe une cause sous-jacente, la condition est appelée « hypertension intracrânienne secondaire ». Les causes courantes d’hypertension intracrânienne secondaire comprennent l’apnée obstructive du sommeil (un trouble respiratoire lié au sommeil), le lupus érythématose systémique (LED), la maladie rénale chronique et la maladie de Behçet.
Mécanisme
La cause de l’IIH n’est pas connue. La règle de Monro-Kellie stipule que la pression intracrânienne (littéralement: pression à l’intérieur du crâne) est déterminée par la quantité de tissu cérébral, de liquide céphalo-rachidien (LCR) et de sang à l’intérieur de la voûte crânienne osseuse. Trois théories existent donc quant à la raison pour laquelle la pression pourrait être élevée dans l’IIH: un excès de production de LCR, une augmentation du volume de sang ou de tissu cérébral ou une obstruction des veines qui drainent le sang du cerveau.
La première théorie, celle de l’augmentation de la production de liquide céphalo-rachidien, a été proposée dans les premières descriptions de la maladie. Cependant, il n’y a pas de données expérimentales qui soutiennent un rôle pour ce processus dans l’IIH.
La deuxième théorie postule que l’augmentation du flux sanguin vers le cerveau ou l’augmentation du tissu cérébral lui-même peuvent entraîner une augmentation de la pression. Peu de preuves se sont accumulées pour étayer la suggestion selon laquelle l’augmentation du flux sanguin joue un rôle, mais les échantillons de biopsie et divers types d’analyses cérébrales ont montré une teneur accrue en eau du tissu cérébral. On ne sait toujours pas pourquoi cela pourrait être le cas.
La troisième théorie suggère que le flux sanguin du cerveau peut être altéré ou congestionné. Un rétrécissement sous-jacent des sinus cérébraux ou des veines n’a été démontré que chez une faible proportion de patients. La congestion du sang veineux peut résulter d’une augmentation générale de la pression veineuse, liée à l’obésité.
Diagnostic
Le diagnostic peut être suspecté sur la base des antécédents et de l’examen. Pour confirmer le diagnostic, ainsi que pour exclure les causes alternatives, plusieurs investigations sont nécessaires; d’autres investigations peuvent être effectuées si les antécédents ne sont pas typiques ou si le patient est plus susceptible d’avoir un problème alternatif: enfants, hommes, personnes âgées ou femmes qui ne sont pas en surpoids.
Investigations
La neuroimagerie, généralement par tomodensitométrie (CT/CAT) ou imagerie par résonance magnétique (IRM), exclut les lésions de masse. Dans l’IIH, ces scans peuvent être normaux, bien que des ventricules petits ou en forme de fente et un « signe de sella vide » (aplatissement de l’hypophyse dû à une pression accrue) puissent être observés. Un vénogramme MR est également réalisé dans tous les cas (ou selon certains experts uniquement dans les cas atypiques) pour exclure la possibilité d’obstruction veineuse ou de thrombose du sinus veineux cérébral.
La ponction lombaire est réalisée pour mesurer la pression d’ouverture, ainsi que pour obtenir du liquide céphalo-rachidien (LCR) pour exclure d’autres diagnostics. Si la pression d’ouverture est augmentée, le LCR peut être retiré pour soulager (voir ci-dessous). Le LCR est examiné pour détecter des taux anormaux de cellules, de glucose et de protéines; dans l’IIH, tous sont dans les limites normales. Parfois, la mesure de la pression peut être normale malgré des symptômes très suggestifs. Cela peut être dû au fait que la pression du LCR peut fluctuer au cours de la journée. Si la suspicion reste élevée, il peut être nécessaire d’effectuer une surveillance à plus long terme de l’ICP par un cathéter de pression.
Classification
Les critères originaux de l’IIH ont été décrits par Dandy en 1937.
1Signs &symptômes d’augmentation de la pression ICP–CSF >25 cmH2O
2aucun signe de localisation à l’exception de la paralysie nerveuse abducens
3composition normale du LCR
/p>
4 ventricules normaux à petits (fendus) en imagerie sans masse intracrânienne
Ils ont été modifiés par Smith en 1985 pour devenir les « critères de Dandy modifiés ». Smith a inclus l’utilisation d’une imagerie plus avancée: Dandy avait besoin d’une ventriculographie, mais Smith l’a remplacée par une tomodensitométrie. Dans un article de 2001, Digre et Corbett ont modifié davantage les critères de Dandy. Ils ont ajouté l’exigence que le patient soit éveillé et alerte, car le coma empêche une évaluation neurologique adéquate et nécessite l’exclusion de la thrombose des sinus veineux comme cause sous-jacente. En outre, ils ajoutent l’exigence qu’aucune autre cause pour le PIC relevé ne soit trouvée.
1symptômes d’augmentation de la pression intracrânienne (maux de tête, nausées, vomissements, obscurcissements visuels transitoires ou œdème papillaire)
2aucun signe de localisation à l’exception de la paralysie nerveuse abducens (sixième)
3Le patient est éveillé et alerte
4 Résultats normaux de tomodensitométrie / IRM sans preuve de thrombose
5LP pression d’ouverture de >25 cmH2O et composition biochimique et cytologique normale du LCR
6aucune autre explication de l’augmentation de la pression intracrânienne
Dans une revue de 2002, Friedman et Jacobson propose un autre ensemble de critères, dérivé de ceux de Smith. Ceux-ci nécessitent l’absence de symptômes qui ne pourraient pas être expliqués par un diagnostic d’IIH, mais ne nécessitent pas la présence réelle de symptômes (tels que des maux de tête) attribuables à l’IIH. Ces critères exigent également que la ponction lombaire soit réalisée avec le patient allongé sur le côté, car une ponction lombaire réalisée en position assise verticale peut entraîner des mesures de pression artificiellement élevées. Friedman et Jacobson n’insistent pas non plus sur la venographie MR pour chaque patient; au contraire, cela n’est requis que dans les cas atypiques (voir « diagnostic » ci-dessus).
Traitement
L’objectif principal du traitement de l’IIH est la prévention de la perte visuelle et de la cécité, ainsi que le contrôle des symptômes. L’IIH est traité principalement par la réduction de la pression du LCR et, le cas échéant, la perte de poids. L’IIH peut se résorber après le traitement initial, entrer en rémission spontanée (bien qu’il puisse encore rechuter à un stade ultérieur) ou continuer de manière chronique.
Ponction lombaire
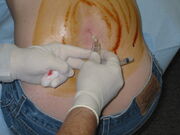
Une ponction lombaire en cours. Une grande surface sur le dos a été lavée avec un désinfectant à base d’iode laissant une coloration brune. Sur cette image, le patient est assis debout, ce qui peut faciliter la procédure mais rend toute mesure de la pression d’ouverture peu fiable.
La première étape du contrôle des symptômes est le drainage du liquide céphalo-rachidien par ponction lombaire. Si nécessaire, cela peut être effectué en même temps qu’un LP « diagnostique ». Dans certains cas, cela suffit pour contrôler les symptômes et aucun traitement supplémentaire n’est nécessaire.
La procédure peut être répétée si nécessaire, mais cela est généralement considéré comme un signe que des traitements supplémentaires peuvent être nécessaires pour contrôler les symptômes et préserver la vision; les LPs répétés sont considérés comme désagréables par les patients. Des LPS répétés sont parfois nécessaires pour contrôler le PIC de toute urgence si la vision se détériore rapidement.
Médicament
Le traitement médical le mieux étudié est l’acétazolamide (Diamox), qui agit en inhibant l’enzyme anhydrase carbonique et réduit la production de LCR de six à 57%. Il peut provoquer des symptômes d’hypokaliémie (faible taux de potassium dans le sang), notamment une faiblesse musculaire et des picotements dans les doigts. L’acétazolamide ne peut pas être utilisé pendant la grossesse, car il a montré qu’il provoquait des anomalies embryonnaires dans des études animales, et chez l’homme, il a été démontré qu’il provoquait une acidose métabolique ainsi que des perturbations des taux d’électrolytes sanguins chez le nouveau-né. Le furosémide diurétique est parfois utilisé si l’acétazolamide n’est pas toléré, mais cela a peu d’effet sur la PCI.
Divers analgésiques (analgésiques) peuvent être utilisés pour contrôler les maux de tête. En plus des agents conventionnels tels que le paracétamol, une faible dose de l’antidépresseur amitriptyline ainsi que de l’anticonvulsivant topiramate ont montré des avantages supplémentaires pour le soulagement de la douleur.
L’utilisation de stéroïdes pour réduire le PIC est controversée; ils peuvent être utilisés dans les œdèmes papillaires sévères, mais sinon leur utilisation est déconseillée.
Chirurgie
Deux interventions chirurgicales principales existent dans le traitement de l’IIH : la décompression de la gaine du nerf optique et la fenestration et le shunt. La chirurgie ne serait normalement offerte que si le traitement médical est soit infructueux, soit non toléré. Le choix entre ces deux procédures dépend du problème prédominant dans l’IIH. Aucune des deux procédures n’est parfaite: les deux peuvent entraîner des complications importantes et les deux peuvent éventuellement échouer à contrôler les symptômes. Il n’y a pas d’essais contrôlés randomisés pour guider la décision quant à la procédure la mieux adaptée.
La fenestration de la gaine du nerf optique est une opération ophtalmologique qui consiste à faire une incision dans la muqueuse du tissu conjonctif du nerf optique dans sa partie derrière l’œil. Il n’est pas tout à fait clair comment il protège l’œil de la pression élevée, mais cela peut être le résultat d’un détournement du LCR dans l’orbite ou de la création d’une zone de tissu cicatriciel qui abaisse la pression. Les effets sur la pression intracrânienne elle-même sont plus modestes. De plus, la procédure peut entraîner des complications importantes, y compris la cécité dans 1 à 2% des cas. La procédure est donc recommandée principalement chez ceux qui présentent des symptômes de maux de tête limités mais un œdème papillaire important ou une vision menacée, ou chez ceux qui ont subi un traitement infructueux avec un shunt ou ont une contre-indication à la chirurgie du shunt.
La chirurgie de shunt, généralement pratiquée par des neurochirurgiens, implique la création d’un conduit par lequel le LCR peut être drainé dans une autre cavité corporelle. La procédure initiale est généralement un shunt lombopéritonéal (LP), qui relie l’espace sous-arachnoïdien de la colonne lombaire à la cavité péritonéale. Généralement, une soupape de pression est incluse dans le circuit pour éviter un drainage excessif lorsque le patient est en érection et présente donc un PIC relativement élevé. Le shunt de LP fournit un soulagement à long terme dans environ la moitié des cas; d’autres nécessitent une révision du shunt, souvent à plus d’une occasion — généralement en raison d’une obstruction du shunt. Si le shunt lombopéritonéal nécessite des révisions répétées, un shunt ventriculo-auriculaire ou ventriculopéritonéal peut être envisagé. Ces shunts sont insérés dans l’un des ventricules latéraux du cerveau, généralement par chirurgie stéréotaxique, puis connectés soit à l’oreillette droite du cœur, soit à la cavité péritonéale, respectivement. Compte tenu du besoin réduit de révisions dans les shunts ventriculaires, il est possible que cette procédure devienne le type de traitement de shunt de première ligne.
En cas d’obésité sévère, il a été démontré que le pontage gastrique entraînait une nette amélioration des symptômes.
Pronostic
On ne sait pas quel pourcentage de personnes atteintes d’IIH remettra spontanément et quel pourcentage développera une maladie chronique.
L’IIH n’affecte normalement pas l’espérance de vie. Les complications majeures de l’IIH proviennent d’un œdème papillaire non traité ou résistant au traitement. Dans diverses séries de cas, le risque à long terme que la vision soit significativement affectée par l’IIH se situe entre 10 et 25%.
Épidémiologie
L’incidence de l’IIH est fortement déterminée par le sexe et le poids corporel. Les chiffres chez les femmes concernent les femmes âgées de 20 à 45 ans.
En moyenne, l’IIH survient chez environ 1 personne sur 100 000 et peut survenir chez les enfants et les adultes. L’âge médian au diagnostic est de 30 ans. L’IIH survient principalement chez les femmes, en particulier chez les 20-45 ans, qui sont quatre à huit fois plus susceptibles que les hommes d’être touchés. Le surpoids et l’obésité prédisposent fortement une personne à l’IIH: les femmes qui dépassent de plus de dix pour cent leur poids corporel idéal sont treize fois plus susceptibles de développer un IIH, et ce chiffre monte à dix-neuf fois chez les femmes qui dépassent de plus de vingt pour cent leur poids corporel idéal. Chez les hommes, cette relation existe également, mais l’augmentation n’est que quintuplée chez ceux de plus de 20% au-dessus de leur poids corporel idéal.
Malgré plusieurs rapports d’IIH dans les familles, il n’y a pas de cause génétique connue pour l’IIH. Des personnes de toutes les ethnies peuvent développer l’IIH. Chez les enfants, il n’y a pas de différence d’incidence entre les hommes et les femmes.
D’après les bases de données nationales sur les admissions dans les hôpitaux, il apparaît que le besoin d’intervention neurochirurgicale pour l’IIH a considérablement augmenté entre 1988 et 2002. Cela a été attribué au moins en partie à la prévalence croissante de l’obésité, bien qu’une partie de cette augmentation puisse s’expliquer par la popularité accrue du shunt sur la fenestration de la gaine du nerf optique.
Histoire
Le premier rapport d’IIH a été fait par le médecin allemand Heinrich Quincke, qui l’a décrit en 1893 sous le nom de méningite séreuse. Le terme « pseudotumor cerebri » a été introduit en 1904 par son compatriote Max Nonne. De nombreux autres cas sont apparus dans la littérature par la suite; dans de nombreux cas, l’augmentation de la pression intracrânienne peut en fait résulter de conditions sous-jacentes. Par exemple, l’hydrocéphalie otitique rapportée par le neurologue londonien Sir Charles Symonds pourrait résulter d’une thrombose du sinus veineux causée par une infection de l’oreille moyenne. Les critères diagnostiques de l’IIH ont été développés en 1937 par le neurochirurgien de Baltimore Walter Dandy; Dandy a également introduit la chirurgie décompressive subtemporale dans le traitement de la maladie.
Les termes « bénin » et « pseudotumeur » dérivent du fait qu’une augmentation de la pression intracrânienne peut être associée à des tumeurs cérébrales. Les patients chez lesquels aucune tumeur n’a été détectée ont donc reçu un diagnostic de « pseudotumor cerebri » (maladie imitant une tumeur cérébrale). La maladie a été renommée « hypertension intracrânienne bénigne » en 1955 pour la distinguer de l’hypertension intracrânienne due à des maladies potentiellement mortelles (telles que le cancer); cependant, cela a également été jugé trompeur car toute maladie pouvant aveugler quelqu’un ne doit pas être considérée comme bénigne, et le nom a donc été révisé en 1989 en « hypertension intracrânienne idiopathique (sans cause identifiable) ».
La chirurgie par shunt a été introduite en 1949; initialement, des shunts ventriculopéritonéaux ont été utilisés. En 1971, de bons résultats ont été rapportés avec le shunt lombopéritonéal. Les rapports négatifs sur les manœuvres dans les années 1980 ont conduit à une brève période (1988-1993) au cours de laquelle la fenestration du nerf optique (qui avait initialement été décrite dans un état non apparenté en 1871) était plus populaire. Depuis lors, la manœuvre est principalement recommandée, à quelques exceptions près.
Voir aussi
- Hypertension
- 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 Binder DK, Horton JC, Lawton MT, McDermott MW (mars 2004). Hypertension intracrânienne idiopathique. Neurochirurgie 54(3): 538-51; discussion 551-2.
- Sismanis A (juillet 1998). Acouphènes pulsatiles. Une expérience de 15 ans. Am J Otol 19(4):472-7.
- 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Soler D, Cox T, Bullock P, Calver DM, Robinson RO (janvier 1998). Diagnostic et prise en charge de l’hypertension intracrânienne bénigne. Arch. Dis. Enfant. 78 (1): 89–94.
- 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Il s’agit de la première édition de la série. Critères diagnostiques de l’hypertension intracrânienne idiopathique. Neurologie 59 (10): 1492-1495.
- 5,00 5,01 5,02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 Acheson JF (2006). Idiopathic intracranial hypertension and visual function. Br. Med. Bull. 79-80 (1): 233–44.
- 6.0 6.1 6.2 Dandy WE (October 1937). Intracranial pressure without brain tumor – diagnosis and treatment. Ann. Surg. 106 (4): 492–513.
- Smith JL (1985). Whence pseudotumor cerebri?. J. Clin. Neuroophthalmol. 5 (1): 55–6.
- 8.0 8.1 Digre KB, Corbett JJ (2001). Idiopathic intracranial hypertension (pseudotumor cerebri): A reappraisal. Neurologist 7: 2–67.
- Curry WT, Butler NOUS, Barker FG (2005). Incidence en hausse rapide des procédures de dérivation du liquide céphalo-rachidien pour l’hypertension intracrânienne idiopathique aux États-Unis, 1988-2002. Neurochirurgie 57(1): 97-108; discussion 97-108.
- Quincke HI (1893). Méningite séreuse. Samml. Klin. Vortr. 67: 655.
- Nonne M (1904). Ueber Falle vom Symptomkomplex « Tumor Cerebri » mit Ausgang in Heilung (Pseudotumor Cerebri). Dtsch. Z. Nervenheilk. 27 (3-4): 169–216.
- 12,0 12,1 12,2 Johnston I (2001). Le développement historique du concept de pseudotumeur. Neurochirurgie. Thème 11(2): 1.
- Symonds CP (1931). Hydrocéphalie otitique. Cerveau 54 (3705): 55-71.
- Foley J (1955). Formes bénignes d’hypertension intracrânienne; hydrocéphalie toxique et otitique. Cerveau 78 (1): 1-41.
- Corbett JJ, Thompson HS (octobre 1989). La gestion rationnelle de l’hypertension intracrânienne idiopathique. Arch. Neurol. 46 (10): 1049–51.
- Bandyopadhyay S (2001). Pseudotumor cerebri. Arch. Neurol. 58 (10): 1699–701.
- Idiopathic intracranial hypertension at the Open Directory Project
|
v·d·e
Nervous system disorders, primarily CNS (G04–G47, 323–349) |
||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inflammation |
|
Both/either
|
||||||||||||||||||||||
| Brain/ encephalopathy |
|
|||||||||||||||||||||||
| Spinal cord/ myelopathy |
Syringomyelia · Syringobulbia · Morvan’s syndrome · Vascular myelopathy (Foix-Alajouanine syndrome) · Spinal cord compression |
|||||||||||||||||||||||
| Both/either |
|
|
||||||||||||||||||||||
| {| class= »navbox collapsible nowraplinks » style= »margin:auto; « | ||||||||||||||||||||||||
|
··
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|}
This page uses Creative Commons Licensed content from Wikipedia (view authors).