Frontiers in Immunology
Introduction
二次リンパ器官/組織(Slo)は、適応免疫応答の効率的な誘導に不可欠です。 リンパ節(LNs)、脾臓、およびPeyer’s patches(PPs)などの粘膜関連リンパ組織(MALTs)を含むいくつかのタイプのSloは、体内のさまざまな場所に戦略的に配置されています。 Sloは抗原を見本抽出し、感度が高い免疫センサーが装備されている精巧なフィルターである。 外来抗原を収集および濾過するために、Sloは、内皮または上皮に関連する特殊な組織構造を含む。 リンパ球、樹状細胞(Dc)、マクロファージなどの免疫細胞は高密度に蓄積し、コンパートメントを形成します。 すべてのSloに共通する顕著な特徴は、B細胞およびT細胞の分離された局在化である。 Sloのアーキテクチャは、ネットワークを構築し、区画を定義する間葉系起源の非造血間質細胞のいくつかのタイプによってサポートされている(Mueller and Germain、2009;Roozendaal and Mebius、2011)。 間質ネットワークは、機能的な足場だけでなく、免疫細胞活動のためのスペースだけでなく、組織のための物理的なフレームワークを提供します。 さらに、成長する証拠は、間質細胞が免疫細胞機能および恒常性においても重要な役割を果たすことを示している(Link et al. ら、2 0 0 7;Fletcher e t a l. Suzukiら、2 0 1 0年。 ら、2 0 1 0;Lukacs−Kornek e t a l., 2011). SLOはある特定の場所でそして胎児および幼児の限られた期間の間に起こるanlagenから成長するためにプログラムされます。 さらに、間質細胞は、SLOの発生および維持に重要であることが知られている(Mebius、2 0 0 3)。 ここでは、最近同定された間質サブセット、辺縁網状細胞(MRCs)に焦点を当て、その特性を要約します。 また、MRCsと組織構造、他の間質サブセット、および免疫学的機能との関係についても議論します。
TおよびB細胞区画および2つの従来の間質細胞サブセット
上記のように、B細胞およびT細胞は、Slo内の異なる領域に局在する。
TおよびB細胞区画および2つの従来の間質細胞サブセット
B細胞はlnsのカプセルの下の外の皮質または脾臓の外のperiarteriolarリンパ様鞘(PALS)に小胞(Bの地帯)を形作るために集まります。 大きい小胞の集りはPPsの中心のティッシュです。 免疫応答の間、卵胞中の活性化されたB細胞は胚中心を形成し、そこでそれらは高親和性抗体生産者に分化する(Cyster e t a l., 2000). 対照的に、T細胞は、卵胞に隣接する別個の領域(Tゾーン)、すなわち、Lnsの傍皮質、脾臓の内側のPAL、またはPpsの濾胞間領域(IFR)に局在する。 DCはまた、tゾーンに蓄積して抗原T細胞およびプライムT細胞を提示する(Steinman e t a l., 1997).
BゾーンとTゾーンには二つの異なるタイプの間葉系間質サブセットがあります(図1A)。 濾胞樹状細胞(Fdc)は、濾胞の中心に密なネットワークを形成し、B細胞による抗体産生においてそれらの重要性のためにかなりの注目を集めている(Tew e t a l. 1997年;Cyster et al. ら,2 0 0 0;Victoratos e t a l. ら,2 0 0 6;Suzuki e t a l., 2010). FDCは、CR1/CD3 5、CD2 3、および場合によってはMadcam−1を発現する(Szabo e t a l. 1997年;Cyster et al., 2000). 対照的に、線維芽細胞網状細胞(Frcs)の精巧なネットワークは、ポドプラニン/gp3 8および種々の細胞外マトリックス(EC M)成分を産生するTゾーンの足場を含む(Gretz e t a l. ら、1 9 9 7;Luther e t a l. ら,2 0 0 0;Kaldjian e t a l. 2001年、Katakai et al.,2004a,b). 一般に、免疫細胞の遊走および局在化は、種々のケモカインによって調節される(Mackay,2 0 0 1)。 休止リンパ球および成熟Dcは、「恒常性ケモカイン」に対して非常に応答性である(Cyster,1 9 9 9;Munller e t a l2 0 0 3)。 Fdcによって産生されるcxcl1 3は、CXCR5を発現するB細胞の誘引物質であり、TゾーンFrcsからのCCL1 9およびCCL2 1は、共通受容体CCR7を介してT細胞および成熟Dcを誘引する(Cyster,1 9 9 9;Cyster e t a l.,1 9 9 9;Cyster e t a l.,1 9 9 9;cyster e t a l.,1 9 9 9;cyster e t a l.,1 9 9 9;cyster e t a l.,1 9 9 9;cyster e t a l.,1 9 9 9;cyster e t a l.,1 9 9 9;cyster e t a l. ら,2 0 0 0;Luther e t a l., 2000). さらに、抗原をスキャンするために組織実質に頑健に移行するリンパ球は、間質ネットワークを足場として使用すると考えられている(Bajénoff et al2006)。 間質サブセットによって産生される種々の因子もまた、免疫細胞の活性化および生存に必要とされる(Cyster e t a l. 2000年;Huber et al. ら、2 0 0 5;Link e t a l. ら,2 0 0 7;Suzuki e t a l. ら、2 0 1 0;Lukacs−Kornek e t a l. ら、2 0 1 1;Malhotra e t a l., 2012). したがって、各コンパートメント内の間質ネットワークの構造と機能は、おそらく免疫細胞サブセットの活性のために最適化されています。
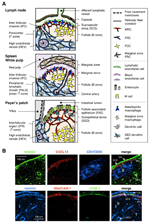
図1. Sloの間質細胞サブセットおよび組織構造。 (A)間質細胞および抗原輸送装置に重点を置いた、マウスSloにおける組織構造の模式図。 間葉系細胞、内皮細胞、上皮細胞、ならびにマクロファージおよび樹状細胞(右パネルに記載されている)などの骨髄系細胞を含む間質要素が強調される。 (B)上部:LNの外側皮質領域にある3種類の間質細胞によって構築された組織骨格。 マウスLNセクションの蛍光免疫染色。 上部の顕微鏡写真では、CR1/CD35を発現するFDCsによってサポートされているが、CXCL13の検出不可能なレベルの胚中心のない小さな休息卵胞(B)があります。 代わりに、Mrcは、カプセル(CA)およびSCSの下の卵胞の外縁にラミニン+CXCL13+網状ネットワークを形成する。 傍皮質(T)におけるFRCsによって構築されたネットワークは、ラミニン+CXCL13-CR1/CD35-である。 下部:MAdCAM-1+MRC層は、SCSにおけるLYVE-1+リンパ内皮層と密接に関連している。 なお、MRC層はIFC領域に拡張される。
Tゾーンの間質ネットワークは、FRCsと網状繊維として知られるECMバンドルで構成され、低分子量物質の通過を容易にする”導管”を形成する(Gretz et al. ら,1 9 9 7,2 0 0 0;Nolte e t a l., 2003). このコンジットは粒子および大きい分子はリンパ球コンパートメントから主に除かれるが、ティッシュの内でさまざまな要因および溶ける抗原を 実際に、末梢組織からのリンパ媒介ケモカインは、循環細胞のLnsへの動員を制御するために、導管を介して高内皮細静脈に急速に輸送される(Palframan e t a l., 2001). さらに、いくつかの常在Dcは、導管に直接接触し、リンパ媒介抗原を捕捉する(Sixt et al., 2005).
新たに同定された間質サブセット、辺縁網状細胞
LN皮質の外側縁は、カプセルのすぐ下にあり、カプセル下洞(SCS;図1A)に囲まれています。 SCSの管腔表面はリンパ内皮細胞で覆われており、その皮質側は「床」と呼ばれる基底膜によって支持されている(Szakal e t a l., 1983). 特にIFRs内では、網状繊維が床から傍皮質へと広がっている(Gretz et al., 1997). 重要なことに、網状構造の薄い層はまた、卵胞の最も外側の領域で観察される。 濾胞網状体中のFRC様間質細胞は、CXCL1 3およびMadcam−1を発現するが、CCL2 1を発現しないことから、これらの細胞はTゾーンFrcsとは異なるが、FDCマーカー CR1/CD3 5は、検出されず、または、これらの細胞においてのみ弱く発現していることを示している(Katakai e t a l. 2008年、図1Bおよび図2A)。 FDCは網状線維を生成せず、したがって、網状マーカー ER−TR7は、卵胞の中心に実質的に存在しない(Katakai e t a l.,2004a,b). さらに、被膜下領域の網状細胞は、LN発生に必須であるTNFファミリーサイトカインであるRANKL/TRANSEを特異的に発現する(Dougall e t a l. ら、1 9 9 9;Kong e t a l., 1999). したがって、これらの間質細胞は新しい間質サブセットであると考えられ、辺縁網状細胞と命名された(MRCs;Katakai et al., 2008). 注目すべきは、fdcが検出不可能なレベルのCXCL1 3を発現していても、実質的な量のCXCL1 3が静止小胞中のMrcsにおいて構成的に発現されることである(図1B)。 脾臓の仲間の外縁、特に卵胞の上にあるものは、MAdCAM-1+間質層によって境界されていることは十分に確立されている。 辺縁洞(MS)の下の基底膜の内層を構成する細胞もまた、CXCL1 3およびRANKLを発現し、これらの細胞がMrcsの一種であることを示す(Katakai e t a l., 2008). 麦芽では、Mrcに類似した網状細胞は、卵胞関連上皮の基底膜のすぐ下の上皮下ドーム(SED)領域にネットワークを形成する(FAE;Katakai et al. ら、2 0 0 8;Knoop e t a l., 2009). まとめると、MrcはSloに共通しているが、FdcおよびFRCsとは異なる間質サブセットであると考えられている。
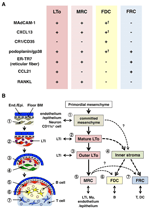
SloにおけるMrcと他の間質細胞サブセットとの関係。 (A)間質細胞サブセットにおけるマーカー発現のパターン。 FdcにおけるMAdCAM-1、CXCL13、およびポドプラニン/gp38の発現レベルは、しばしば弱いか、免疫組織化学(γ)によって検出できない。 (B)間質細胞サブセットの位置を持つSLO開発の一般化モデルの模式図(左)と間質細胞サブセットの推定系図(右). 左図のセル要素を示す数字は、右図に示す間質細胞サブセットを表しています。 BMの基底膜;終わり。/エピ、内皮層または上皮層。
MRCsとSLOsにおける抗原進入経路
二次リンパ器官は、抗原を濾液してリンパ球区画に輸送する特異な構造によって特徴付けられる(図1A)。 LNsはリンパ管とリンパ媒介の抗原を調査するために接続されます。 求心性リンパ管はSCSに開放されているので、洞リンパ内皮および床基底膜は、そのまま、LNフィルターの前面である。 脾臓は、中心動脈の枝がMSおよび辺縁帯(m Z)に開放され、免疫細胞が血液内容物を調査する血液を濾過する。 これらの特殊な洞構造では、境界障壁は、LNのscsにおけるリンパ内皮および脾臓のMSにおける血液内皮であり、両方ともMRC網状体によって支持される。 興味深いことに、CD1 6 9+金属親和性マクロファージは、卵胞上の洞内層の近くに選択的に分布し、そのうちのいくつかは内皮障壁を越えて沈降し、洞内腔か ら、1 9 8 3;Taylor e t a l. ら、2 0 0 5;CarrascoおよびBatista、2 0 0 7;Phanら、2 0 0 8;およびPhanら、2 0 0 9。, 2009). リンパ管を介して組織から抗原を運ぶDCは、SCSに到着し、続いて、濾胞間チャネルの床を横切って傍皮質に移動する(IFC;Steinman e t a l. ら,1 9 9 7;Katakai e t a l. ら,2 0 0 4b;Braunら,2 0 0 4b., 2011). 麦芽では、FAEは、M細胞と呼ばれる特殊な上皮細胞が腸内腔から下にあるDcまたはマクロファージに細菌または粒子を移す障壁として機能する(Kraehenbuhl and Neutra、2000)。 したがって、MRCsは、各SLOにおける最前線の抗原輸送装置をサポートしています。 Sloの基本的な設計は,卵胞が主に抗原侵入部位に向かって配置され,Tゾーンを伴うことである。 したがって、間質の観点から、全組織アーキテクチャはMRC層に向かって組織化されているように見える。
MRCsの免疫学的機能はとらえどころのないままであるが、それは以前に外卵胞中のMRCsによって構築された導管ネットワークは、濾胞B細胞およびFdcに小, 2009). ほとんどのCD1 6 9+マクロファージは、SCS床の皮質側に配置され、粒子を捕捉するために洞内腔に延長部を突き出ている(Phan e t a l., 2009). したがって、MRCsは、これらのマクロファージの局在、形態、および機能に関与している可能性があります。 Ppsにおけるm細胞の発達には、RANKL−RANKシグナル伝達が必要であり、これは、FAEのすぐ下のRANKL発現MRCネットワークによって制御される可能性が高い(Knoop e t a l., 2009). 脾臓白色パルプ中のMRCシグネチャを廃止するLT経路を阻害することは、MS構造を妨害する(Koike e t a l. ら、1 9 9 6;Balogh e t a l. 2007年、Katakai et al., 2008; Zindl et al., 2009). さらに、ICAM−1、VCAM−1、およびCXCL1 3発現の上昇は、Mrcが機能的足場としての濾胞B細胞の動的な間質性遊走に関与していることを意味する。 CD1 6 9+マクロファージは、この領域の抗原特異的B細胞に粒子状抗原を直接送達することが示されている(Carrasco and Batista,2 0 0 7;Phan e t a l. B細胞遊走のMRCネットワーク媒介制御がこのプロセスに影響を与える可能性があることを示唆している。 MrcはIFC領域にも存在するので,SCSからTゾーンへのDcの移動を調節する可能性がある。
MRCsおよび主催者間質細胞SLO開発
二次リンパ器官は、胎児または乳児の定義された部位および期間において、血管または上皮に関連する間葉 SLOアンラゲンの発生における重要な事象は、CD4 5+CD4+CD3−造血細胞の蓄積であり、これは、リンパ組織オーガナイザー(lto)細胞と呼ばれる間葉系間質細胞と相互作用するリンパ組織誘導因子(Lti)細胞としても知られている(Mebius e t a l., 1997). Lti細胞によって発現されるTNFファミリーサイトカイン、リンホトキシン(LT)−α1β2は、LT−β受容体を介してlto細胞にシグナルを伝達する。 続いて、LTO細胞は、ICAM−1、VCAM−1、およびMadcam−1、ならびにケモカインCXCL1 3、CCL1 9、およびCCL2 1を含む接着分子の発現を誘導する(Honda e t a l. ら,2 0 0 1;Cupedo e t a l. ら、2 0 0 4a;Benezechら、2 0 1 0)。 特に、CXCL1 3は、その受容体CXCR5を介してLti細胞をアンラゲンに誘引する際に特に重要である(Finke e t a l. ら,2 0 0 2;Luther e t a l. ら,2 0 0 3;Ohl e t a l., 2003). 正帰還ループ、すなわち LTを産生する新たに移住したLti細胞はさらにLto間質細胞を活性化し,アンラゲンの組織化を促進する。 リンパ球が出生後に蓄積し始めると、組織は膨張し、異なる間質細胞サブセットによって支持された区画が誘導される(Cupedo et al. ら、2 0 0 4b;BajenoffおよびGermain2 0 0 9)。
辺縁網状細胞とLTo細胞は、様々なマーカーの非常に類似したパターンを発現し(図2A)、これら二つの間質細胞の間にいくつかの関係があることを示唆している。 LTO細胞は、推定SCSのリンパ洞に隣接するLNアンラゲンの周辺領域に、より集中しているようである(Finke e t a l. ら,2 0 0 2;Cupedo e t a l. ら、2 0 0 4a;Eberl e t a l. 2004年、Katakai et al., 2008). このLto細胞層は、最終的にはmrc層になるように見える(Katakai e t a l., 2008). 同様に、出生後の脾臓の中心動脈の周りにリンパ球が蓄積すると、MAdCAM-1およびRANKLを発現するLTo細胞は層とともに拡大し、白色パルプ中のMRCsになる。 これらの知見は,MrcがLto間質の直接の子孫であり,Slo内の特殊な部位でLto細胞の特性を維持することを強く示唆している。 RAG欠損マウスでさえ、萎縮性Lnsにおいて被膜下MRC層を示し、脾臓における動脈周囲MRCシースを縮小し、MRC発達がB細胞およびT細胞とは独立して起こり、それらのコロニー形成前にプログラムされていることを示している(Katakai et al., 2008). Sloは、免疫応答を誘発するために抗原を効率的にサンプリングするので、開発中に構築される抗原収集構造は、その後維持される必要がある。 したがって、これらの組織構造は、成人期を通じてオーガナイザー様間質細胞によって維持されることが合理的である。
MRCsと他の間質サブセットとの関係
図2Bは、Sloにおける間質サブセットの可能な系譜を示しています。 胚では、血管系または上皮に近接している原始間充織は、anlageコアを形成するためにコミットされ、LTi細胞を引き付けます。 神経細胞または他の特徴の少ない細胞も初期過程に関与する(Veiga−Fernandes e t a l. ら、2 0 0 7;van d e Pavert e t a l., 2009). Lti細胞の蓄積は、間葉系細胞のLto細胞への成熟を容易にし、最終的には基本的な構造の構築を容易にする。 典型的には、Lto細胞は、眼窩の周辺部に集中し、組織の成長とともに外側に拡大する傾向があり、一方、ltoシグネチャが弱いかまたは全く示さない間質細胞は、逆に眼窩の内側部分で増加する。 B細胞およびT細胞の出生後のコロニー形成は、従来の間質サブセットの誘導を伴う区画につながる。
このスキームが正しければ、成体Sloのすべての間質サブセットは、もともとLTo細胞に由来することになります。
このスキームが正しければ、成体Sloのすべての間質サブセットは、 したがって、LTo細胞の特性を保持するMrcは、FdcまたはFRCsに分化する能力を有するのか? MRCは他のサブセットと多くの署名を共有しています(図2A)。 1つの推測は、Mrcが成人期を通じてすべての間質サブセットを継続的に供給する間質幹細胞として機能することである。 このアイデアは興味深いものですが、将来的には慎重な検討とさらなる検証が必要になります。 間葉系細胞は、一般に、周囲の環境に応じて本質的に非常に柔軟であり、したがって、特定の特徴を容易に変更することができる。 Lnsから単離された間質細胞の拡張培養は、多くの遺伝子、特に恒常性ケモカインについての発現の喪失をもたらす(Katakai e t a l. ら,2 0 0 4a;Tomeiら,2 0 0 4b., 2009). これは、間質細胞サブセットのin vivo表現型が最適に可逆的ではなく、末端分化に起因する組織の状況によって維持されていることを示唆している。 さらに、炎症性刺激は、間質細胞の堅牢な増殖およびSloの劇的なリモデリングを誘導する(Katakai e t a l. ら,2 0 0 4a;Chyoら,2 0 0 4a,2 0 0 5., 2011). したがって、MRCsは他のサブセットに変換することができますが、従来の間質サブセットはまた、自己更新し、大人のSloで交換可能である可能性があります。
Sloおよび三次リンパ構造のリモデリング
免疫応答中に、Slo内の間質構造が劇的にリモデリングされる(Gretz et al. ら,1 9 9 7;Katakai e t a l.、2004a)。 いくつかの感染症は、数日以内にLns内の組織構造および脾臓白色パルプの重度の破壊を引き起こし、これは病原体が根絶されると回復する(Mueller e t a l. ら,2 0 0 7a,b;Scandella e t a l.,2008;聖ヨハネとアブラハム,2009). この復元プロセスは、SLO開発と同様のフィードバック反応を介して自己組織化プロセスを再現する可能性があります。 重要なことに、Lti様細胞は成体組織にも存在し、slosの感染関連リモデリングを調節する(Kim e t a l. ら、2 0 0 3;Scandella e t a l., 2008). このようなプロセスにおけるMRCsの役割は不明であるが、彼らはおそらくLTi様細胞と共同で組織の役割を持っており、再建中にSloの外枠を決定します。
様々な臓器病理に関連する慢性炎症では、多数の浸潤リンパ球が三次リンパ組織として知られるSloに類似した組織につながることが多い(TLTs;Drayton et al., 2006). B細胞とT細胞が分離され、間質細胞サブセットの対応するネットワークが誘導される。 しかし、マウス自己免疫性胃炎の間に発症したTltでは、MRC様細胞および関連組織構造は観察されない(Katakai e t a l., 2006, 2008). Tltは基本的にプログラムされたリンパ組織ではなく、自然に抗原輸送構造と関連しないことを強調すべきである。 したがって、MrcはTltには存在しない可能性が高い。 MRCsに表現型的に類似している間質細胞は、いくつかの病変で誘導されるかもしれないが、彼らは密接に特定の内皮または上皮構造と関連し、外卵胞で層状細網を形成しない限り、それらはMRCsとして同定されないであろう。
結論
辺縁網状細胞は、SLOsに共通のユニークな間質細胞サブセットです。 MRCsは、出生後のリンパ球との相互作用を介して誘導または成熟される従来のサブセットとは明らかに異なり、anlagenのLTo間質細胞から直接誘導され、リンパ球から独立している。 Mrcのネットワークは、Sloの抗原輸送装置と密接に関連しており、リンパ球区画への抗原送達、ならびに免疫細胞の局在および遊走を直接的または間接的に制御すると考えられている。 MRCは、おそらく外側のフレームワークとしてSLO構造を維持する上で極めて重要な役割を果たし、定常状態または組織リモデリング中に他の間質サブセットに変換される可能性があります。 SLOシステムを包括的に理解するためには,すべての間質サブセット,組織構造,免疫学的微小環境を総称して考慮することが重要である。
利益相反に関する声明
著者は、潜在的な利益相反として解釈される可能性のある商業的または財務的関係がない場合に研究が行われた
謝辞
本研究は、文部科学省の若手科学者および革新的な分野に関する科学研究のための補助金の一部を支援されました。
Bajénoff,M.,Egen,J.G.,Koo,L.Y.,Laugier,J.P.,Brau,F.,Glaichenhaus,N.,And Germain,R.N.(2006). 間質細胞ネットワークは、リンパ節におけるリンパ球の侵入、移動、および領土を調節する。 25,989-1001
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Bajénoff,M.,And Germain,R.N. (2009). B細胞の小胞の開発は水路システムを改造し、小胞の樹状細胞に溶ける抗原配達を可能にします。 114,4989-4997.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Balogh,P.,Balázs,M.,Czömpöly,T.,Weih,D.S.,Arnold,H.H.,And Weih,F.(2007). リンホトキシンβシグナル伝達とホメオドメイン転写因子nkx2.3脾臓の内皮コンパートメントの個体発生の明確な役割。 細胞組織Res.328,473-486.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Bénézech,C.,White,A.,Mader,E.,Serre,K.,Parnell,S.,Pfeffer,K.,Ware,C.F.,Anderson,G.,Caamaño,J.H.(2010). リンパ節発達中の間質オーガナイザー細胞の個体発生。 J.Immunol. 184, 4521–4530.
Pubmed Abstract|Pubmed Full Text
Braun,A.,Worbs,T.,Moschovakis,G.L.,Halle,S.,Hoffmann,K.,Bölter,J.,Münk,A.,And Förster,R.(2011). 求心性リンパ由来T細胞およびDcは、リンパ節への進入および節内移動のために、異なるケモカイン受容体CCR7依存経路を使用する。 ナット イムノール 12, 879–887.
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Carrasco,Y.R.,And Batista,F.D.(2007). B細胞はリンパ節の小胞とsubcapsular湾曲間の境界で大食細胞豊富な区域の粒子状の抗原を得ます。 27件中160-171件を表示しています。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Chyou,S.,Benahmed,F.,Chen,J. ることができると考えられている。 リンパ節血管間質成長の調整最初にCd11C+細胞とTおよびB細胞による調整しました。 J.Immunol. 187, 5558–5567.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Cupedo,T.,Vondenhoff,M.F.,Heeregrave,E.J.,De Weerd,A.E.,Jansen,W.,Jackson,D.G.,Kraal,G.,And Mebius,R.E.(2004a). 推定リンパ節の主催者は、腸間膜および末梢節の発達において差動的に表される。 J.Immunol. 173, 2968–2975.
Pubmed Abstract|Pubmed Full Text
Cupedo,T.,Lund,F.E.,Ngo,V.N.,Randall,T.D.,Jansen,W.,Greuter,M.J.,de Waal-Malefyt,R.,Kraal,G.,Cyster,J.G.,And Mebius,R.E.(2004b). リンパ節における細胞組織の開始は、非B細胞由来のシグナルによって調節され、CXCケモカインリガンド13に依存しない。 J.Immunol. 173, 4889–4896.
Pubmed Abstract|Pubmed Full Text
Cyster,J.G.(1999). 二次リンパ器官におけるケモカインおよび細胞遊走。 科学286,2098-2102.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Cyster,J.G.,Ansel,K.M.,Reif,K.,Ekland,E.H.,Hyman,P.L.,Tang,H.L.,Luther,S.A.,And Ngo,V.N.(2000). 卵胞間質細胞およびリンパ球は卵胞にホーミングする。 イムノール 牧師176:181-193。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Dougall,W.C.,Glaccum,M.,Charrier,K.,Rohrbach,K.,Brasel,K.,De Smedt,T.,Daro,E.,Smith,J.,Tometsko,M.E.,Maliszewski,C.R.,Armstrong,A.,Shen,V.,Bain,S.,Cosman,D.,Anderson,D.,Morrissey,P.J. J.,およびSchuh,J.(1 9 9 9)。 ランクは破骨細胞およびリンパ節の開発のために必要です。 遺伝子Dev. 13, 2412–2424.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Drayton,D.L.,Liao,S.,Mounzer,R.H.,And Ruddle,N.H.(2006). リンパ器官の発達:個体発生から新生まで。 ナット イムノール 7, 344–353.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Eberl,G.,Marmon,S.,Sunshine,M.J.,Rennert,P.D.,Choi,Y.,And Littman,D.R.(2004). 胎児リンパ組織誘導細胞の生成における核受容体RORy(t)のための必須の機能。 ナット イムノール 5, 64–73.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Finke,D.,Acha-Orbea,H.,Mattis,A.,Lipp,M.,And Kraehenbuhl,J.(2002). CD4+CD3細胞はPeyerのパッチの開発を誘導します:cxcr5によるα4β1インテグリンの活性化の役割。 17,363-373
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Fletcher,A.L.,Lukacs-Kornek,V.,Reynoso,E.D.,Pinner,S.E.,Bellemare-Pelletier,A. とができるようになりました。 リンパ節線維芽細胞網状細胞は、定常状態および炎症条件下で末梢組織抗原を直接提示する。 J.Exp. メッド 207, 689–697.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Gretz,J.E.,Anderson,A.O.,And Shaw,S.(1997). コード、チャネル、通路および水路:リンパ節の皮質の細胞相互作用を促進する重大な建築要素。 イムノール 156年11月24日に発売された。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Gretz,J.E.,Norbury,C.C.,Anderson,A.O.,Proudfoot,A.E.,And Shaw,S.(2000). 機能障壁がリンパ節の皮質のリンパ球の微小環境へのアクセスを限る間、リンパ媒介されたケモカインおよび他の低分子量の分子は専門にされた水路によって高いendothelial細静脈に達します。 J.Exp. メッド 192, 1425–1440.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
本田圭佑、中野浩、吉田浩、西川浩、Rennert、P.、生田浩、為近、M…
本田圭佑、中野浩、吉田浩、西川浩、Rennert、P.、生田浩、為近、M…
本田圭佑、中野浩、吉田浩、西川浩、Rennert、P.、生田浩、,山口,K.,福本,T.,千葉,T.,西川,S.-I.(2001). Peyerのパッチの器官形成の開始の間のhematopoietic/mesenchymal相互作用のための分子基礎。 J.Exp. メッド 193, 621–630.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Huber,C.,Thielen,C.,Seeger,H.,Schwarz,P.,Montrasio,F.,Wilson,M.R.,Heinen,E.,Fu,Y.X.,Miele,G.,And Aguzzi,A.(2005). リンパ節および濾胞樹状細胞トランスクリプトームにおけるリンホトキシン-β受容体依存遺伝子。 J.Immunol. 174, 5526–5536.
Pubmed Abstract|Pubmed Full Text
Kaldjian,E.P.,Gretz,J.E.,Anderson,A.O.,Shi,Y.,And Shaw,S.(2001). リンパ節T細胞皮質の空間的および分子組織:基底膜様細胞外マトリックスに固定された線維芽細胞網状細胞の上皮様単層によって囲まれた迷路 Int. イムノール 13, 1243–1253.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Katakai,T.,Hara,T.,Sugai,M.,Gonda,H.,Shimizu,A.(2004a). リンパ節線維芽細胞性網状細胞は、リンパ球との接触を介して間質網状体を構築する。 J.Exp. メッド 200, 783–795.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Katakai,T.,Hara,T.,Lee,J.H.,Gonda,H.,Sugai,M.,Shimizu,a.(2004b). リンパ節皮質における新規網状間質構造:樹状細胞、T細胞およびB細胞間の相互作用のための免疫プラットフォーム。 Int. イムノール 16, 1133–1142.
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Katakai,T.,Nomura,T.,Gonda,H.,Sugai,M. ることを明らかにした(2006年)。 H+/K+-ATPase反応性TCRトランスジェニックマウスの胃における自発的な大規模なリンパ系新生とバランスのとれた自己免疫対耐性。 J.Immunol. 177, 7858–7867.
Pubmed Abstract|Pubmed Full Text
Katakai,T.,Suto,H.,Sugai,M.,Gonda,H.,Togawa,A.,Suematsu,S.,Ebisuno,Y.,Katagiri,K.,Kinashi,T.,Shimizu,a.(2008). 成人の二次リンパ器官に共通するオーガナイザー様網状間質細胞層。 J.Immunol. 181, 6189–6200.
Pubmed Abstract|Pubmed Full Text
Kim,M.Y.,Gaspal,F.M.,Wiggett,H.E.,McConnell,F.M.,Gulbranson-Judge,A.,Raykundalia,C.,Walker,L.S.,Goodall,M.D.,And Lane,P.J.(2003). CD4+CD3-アクセサリー細胞は、t細胞がB細胞と協働する部位でox40およびCD30を介してプライミングCD4T細胞を共刺激する。 18,643-654
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Knoop,K.A.,Kumar,N.,Butler,B.R.,Sakthivel,S.K.,Taylor,R.T.,Nochi,T.,Akiba,H.,Yagita,H.,Kiyono,h.,And Williams,I.R. (2009). RANKLは、腸上皮における抗原サンプリングM細胞の開発を開始するために必要かつ十分である。 J.Immunol. 183, 5738–5747.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
小池R.,西村T.,安水R.,田中H.,畑場Y.,畑場Y.,渡辺T.,宮脇S.,宮坂M.(1996). 脾臓周辺帯は、alymphoplastic aly変異マウスには存在しない。 ユーロ J.Immunol. 26, 669–675.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Kong,Y.Y.,Yoshida,H.,Sarosi,I.,Tan,H.L.(1 9 9 9年)、timms,E.,Capparelli,C.,Morony,S.,Oliveir−dos−Santos,A.J.,Van,G.,Itie,A.,Khoo,W.,Wakeham,A.,Dunstan,C.R.,Lacey,D.L.,Mak,T.W.,Boyle,W.J.,およびPenninger,J. OPGLは破骨細胞形成、リンパ球の開発およびリンパ節の器官形成の主調整装置です。 自然397、315-323。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Kraehenbuhl,J.P.,And Neutra,M.R.(2000). 上皮M細胞:分化および機能。 アンヌ セル-デヴ。 バイオル 16, 301–332.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Link,A.,Vogt,T.K.,Favre,S.,Britschgi,M.R.,Acha-Orbea,H.,Hinz,B.,Cyster,J.G.,And Luther,S.A.(2007). リンパ節における線維芽細胞網状細胞は、ナイーブT細胞の恒常性を調節する。 ナット イムノール 8, 1255–1265.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Lukacs-Kornek,V.,Malhotra,D.,Fletcher,A.L.,Acton,S.E.,Elpek,K.G.,Tayalia,P.,Collier,A.R.,And Turley,S.J.(2011). 非造血幹細胞による一酸化窒素の調節された放出は、リンパ節における活性化されたT細胞プールの拡張を制御する。 ナット イムノール 12, 1096–1104.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Luther,S.A.,Tang,H.L.,Hyman,P.L.,Farr,A.G.,And Cyster,J.G.(2000). Tゾーン間質細胞によるケモカインELCおよびSLCの同時発現およびPLT/pltマウスにおけるELC遺伝子の欠失。 プロク… ナトル アカド サイ… 米国97,12694-12699.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Luther,S.A.,Ansel,K.M. およびCyster,J. リンパ節の発達におけるcxcl13、インターロイキン7受容体α、およびCCR7リガンドの重複の役割。 J.Exp. メッド 197, 1191–1198.
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Mackay,C.R.(2001). ケモカイン:免疫学の影響力の高い要因。 ナット イムノール 2, 95–101.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Malhotra,D.,Fletcher,A.L.,Astarita,J.,Lukacs-Kornek,V.,Tayalia,P.,Gonzalez,S.F.,Elpek,K.G.,Chang,S.K.,Knoblich,K.,Hemler,M.E.,Brenner,M.B. およびThe Immunological Genome Project Consortitueを参照されたい。 (2012). 炎症を起こしたリンパ節および安静時リンパ節からの間質の転写プロファイリングは、免疫学的特徴を定義する。 ナット イムノール 13, 499–510.pubmed Abstract/Pubmed Full Text|CrossRef Full Text
Mebius,R.E.,Rennert,P.,And Weissman,I.L.(1997). 発達中のリンパ節は、APC、NK細胞、および濾胞細胞に分化することができるが、T細胞またはB細胞には分化できないCD4+CD3-Lt Β+細胞を収集する。 7,493-504
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Mebius,R.E.(2003). リンパ組織の器官形成。 ナット レヴュー-イムノール 3, 292–303.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Mueller,S.N.,Hosiawa-Meagher,K.A.,Konieczny,B.T.,Sullivan,B.M.,Bachmann,M.F.,Locksley,R.M.,Ahmed,R.,And Matloubian,m.(2007a). 免疫応答中の恒常性ケモカイン発現および細胞輸送の調節。 科学317,670-674.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Mueller,S.N.,Matloubian,M.,Clemens,D.M.,Sharpe,A.H.,Freeman,G.J.,Gangappa,S.,Larsen,C.P.,And Ahmed,R.(2007b). 線維芽細胞網状細胞のウイルス標的化は、慢性感染中の免疫抑制および持続性に寄与する。 プロク… ナトル アカド サイ… 104,15430-15435.
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Mueller,S.N.,And Germain,R.N.(2009). 間質細胞は、免疫系の恒常性および機能性に寄与する。 ナット レヴュー-イムノール 9, 618–629.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Müller,G.,Höpken,U.E.,And Lipp,M.(2003). リンパ器官の発達および全身免疫に対するCCR7およびCXCR5の影響。 イムノール 195頁、117-135頁。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Nolte,M.A.,Beliên,J.A.,Schadee-Eestermans,I.,Jansen,W.,Unger,W.W.,van Rooijen,N.,Kraal,G.,And Mebius,R.E.(2003). コンジットシステムは、ケモカインと小さな血液媒介分子を脾臓の白いパルプを通して分配する。 J.Exp. メッド 198, 505–512.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Ohl,L.,Henning,G.,Krautwald,S.,Lipp,M.,Hardtke,S.,Bernhardt,G.,Pabst,O.,And Förster,R.(2003). 二次リンパ器官の発達と組織におけるCXCR5とCCR7の協力メカニズム。 J.Exp. メッド 197, 1199–1204.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Palframan,R.T.,Jung,S.,Cheng,G.,Weninger,W.,Luo,Y.,Dorf,M.,Littman,D.R.,Rollins,B.J.,Zweerink,H.,Rot,A.,and von Andrian,U.H.(2001). HEVにおける炎症性ケモカイン輸送と提示:炎症組織におけるリンパ節への単球動員のための遠隔制御機構。 J.Exp. メッド 194, 1361–1373.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Phan,T.G.,Green,J.A.,Gray,E.E.,Xu,Y.,And Cyster,J.G.(2009). 被膜下洞マクロファージと非認識B細胞による免疫複合体リレーは、抗体親和性の成熟を駆動します。 ナット イムノール 10, 786–793.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Roozendaal,R.,Mempel,T.R.、ピッチャー、L.A.、ゴンザレス、S.F.、Verschoor、A.、Mebius、R.E.、von Andrian、U.H.、およびCarroll、M.C.(2009年)。 コンジットはリンパ節の小胞への低分子量の抗原の輸送を仲介します。 30,264-276
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Roozendaal,R.,and Mebius,R.E.(2011). 間質細胞-免疫細胞相互作用。 アンヌ レヴュー-イムノール 29, 23–43.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Scandella,E.,Bolinger,B.,Lattmann,E.,Miller,S.,Favre,S.,Littman,D.R.,Finke,D. ることができます。 リンパ組織誘導細胞とt細胞ゾーンの間質との相互作用によるリンパ器官の完全性の回復。 ナット イムノール 9, 667–675.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Sixt,M.,Kanazawa,N.,Selg,M.,Samson,T.,Roos,G.,Reinhardt,D.P.,Pabst,R.,Lutz,M.B.,And Sorokin,L.(2005). 導管系は、可溶性抗原を求心性リンパ節からリンパ節のT細胞領域の常在樹状細胞に輸送する。 22件中19-29件を表示しています。
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Steinman,R.M.,Pack,M.,And Inaba,K.(1997). リンパ器官のT細胞領域の樹状細胞。 イムノール 156頁、25-37頁。
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
St John,A.L.,And Abraham,S.N.(2009). サルモネラは、恒常性ケモカインのTLR4を介した抑制によってリンパ節のアーキテクチャを破壊します。 ナット メッド 15, 1259–1265.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
鈴木、K.、丸谷、M.、川本、S. ることができると考えられている。 濾胞樹状細胞による環境刺激の感知は、腸内での免疫グロブリンA生成を促進する。 33件中71-83件を表示しています。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Szabo,M.C.,Butcher,E.C.,And McEvoy,L.M.(1997). 粘膜アドレス-細胞接着分子-1ディスプレイによって明らかにされた粘膜濾胞樹状細胞の特殊化。 J.Immunol. 158, 5584–5588.
Pubmed Abstract|Pubmed Full Text
Szakal,A.K.,Holmes,K.L.,And Tew,J.G. (1983). 樹状形態を有する細胞を含む、非貪食細胞の表面上の嚢下洞からリンパ節卵胞への免疫複合体の輸送。 J.Immunol. 131, 1714–1727.
Pubmed Abstract|Pubmed Full Text
Taylor,P.R.,Martinez-Pomares,L.,Stacey,M.,Lin,H.H.,Brown,G.D.,And Gordon,S.(2005). マクロファージ受容体と免疫認識。 アンヌ レヴュー-イムノール 23, 901–944.pubmed Abstract/Pubmed Fulltext/CrossRef Fulltext
Tew,J.G.,Wu,J.,Qin,D.,Helm,S.,Burton,G.F.,And Szakal,A.K. (1997). B細胞への抗原およびcostimulatoryシグナルの濾胞樹状細胞および提示。 イムノール 156頁、39-52頁。
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
東名、A.A.、Siegert、S.、Britschgi、M.R.、Luther、S.A.、およびSwartz、M.A.(2009)。 流体の流れは、組織設計リンパ節微小環境における間質細胞の組織とCCL21発現を調節します。 J.Immunol. 183, 4273–4283.
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
van de Pavert,S.A.,Olivier,B.J.,Goverse,G.,Vondenhoff,M.F.,Greuter,M.,Beke,P.,Kusser,K.,Höpken,U.E.,Lipp,M.,Niederreither,K.,Blomhoff,R.,Sitnik,K.,Agace,W.W.,Randall,T.D.,de Jonge,W.J.,And Mebius,R.E.(2009). ケモカインCXCL13はリンパ節の開始のために必要で、レチノイン酸および神経の刺激によって引き起こされます。 ナット イムノール 10, 1193–1199.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Veiga-Fernandes,H.,Coles,M.C.,Foster,K.E.,Patel,A.,Williams,A.,Natarajan,D.,Barlow,A.,Pachnis,V.,And Kioussis,D.(2007). チロシンキナーゼ受容体RETは、パイエルのパッチ器官形成の重要な調節因子である。 446,547-551.
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Victoratos,P.,Lagnel,J.,Tzima,S.,Alimzhanov,M.B.,Rajewsky,K.,Pasparakis,M.,And Kollias,G.(2006). FDCネットワークおよび抗体応答の開発におけるp55tnfrおよびIKK2のFDC特異的機能。 24,65-77
Pubmed要約|Pubmed全文|CrossRef全文
Zindl,C.L.,Kim,T.H.,Zeng,M.,Archambault,A.S.,Grayson,M.H.,Choi,K. ら、schreiber,R.D.,およびChaplin,D.D.(2 0 0 9)。 リンホトキシンLta1Β2は、出生後および成人の脾臓周辺洞血管構造および機能を制御する。 30件中408-420件を表示しています。
Pubmed要約|Pubmed全文|CrossRef全文