Frontiers in Immunology
- Introduction
- przedziały komórek T I B oraz dwa konwencjonalne podzbiory komórek zrębowych
- nowo zidentyfikowany podzbiór zrębowy, krańcowe komórki siateczkowe
- MRCs i Droga wejścia antygenu w SLOs
- MRCs i Organizer Stromal Cells in slo Development
- związek między MRC a innymi podzbiorami Stromal
- przebudowa SLOs i trzeciorzędowych struktur limfatycznych
- wniosek
- Oświadczenie o konflikcie interesów
- podziękowania
Introduction
Secondary lymphoid organs/tissue (Slo) are essential for the efficient induction of adaptive immune responses. Kilka rodzajów SLOs, w tym węzłów chłonnych (LNs), śledziona, i tkanki limfatyczne związane z błoną śluzową (słodów), takich jak plastry Peyera (PPs), są strategicznie rozmieszczone w różnych miejscach w organizmie. SLOs są wyszukanym filtrem, który pobiera antygeny i jest wyposażony w bardzo czułe czujniki odpornościowe. W celu zbierania i filtrowania obcych antygenów, Slo zawierają wyspecjalizowane struktury tkankowe, które są związane z śródbłonkiem lub nabłonkiem. Komórki odpornościowe, takie jak limfocyty, komórki dendrytyczne (DCs) i makrofagi gromadzą się do wysokiej gęstości i tworzą przedziały. Niezwykłą cechą wspólną dla wszystkich SLO jest segregowana lokalizacja limfocytów B i limfocytów T. Architektura SLOs jest wspierana przez kilka rodzajów niehematopoetycznych komórek zrębowych pochodzenia mezenchymalnego, które konstruują sieci i definiują przedziały (Mueller and Germain, 2009; Roozendaal and Mebius, 2011). Sieci zrębowe zapewniają nie tylko funkcjonalną podporę, ale także przestrzeń dla aktywności komórek odpornościowych, a także fizyczną strukturę dla tkanki. Co więcej, rosnące dowody wskazują, że komórki zrębowe odgrywają również kluczową rolę w funkcji komórek odpornościowych i homeostazie (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Slo są zaprogramowane tak, aby rozwijały się z anlagenu, które występują w pewnych miejscach i podczas ograniczonych okresów u płodu i niemowlęcia. Ponadto wiadomo, że komórki zrębowe są ważne dla rozwoju i utrzymania SLO (Mebius, 2003). Tutaj skupiam się na niedawno zidentyfikowanej podgrupie zrębowej, marginalnych komórkach siateczkowych (MRC)i podsumowuję ich cechy. Omawiam również związek między MRC a strukturą tkanek, innymi podgrupami zrębowymi i funkcjami immunologicznymi.
przedziały komórek T I B oraz dwa konwencjonalne podzbiory komórek zrębowych
jak opisano powyżej, komórki B i komórki T lokalizują się w różnych regionach w obrębie SLOs. Komórki B gromadzą się tworząc pęcherzyki (Strefa B) w korze zewnętrznej pod kapsułką w LNs lub w zewnętrznej okołostawowej osłonie limfatycznej (PALS) w śledzionie. Skupisko dużych pęcherzyków jest tkanką rdzeniową PPs. Podczas odpowiedzi immunologicznych, aktywowane komórki B w pęcherzykach tworzą Ośrodki germinalne, gdzie różnicują się do producentów przeciwciał o wysokim powinowactwie (Cyster et al., 2000). W przeciwieństwie do tego, komórki T lokalizują się w oddzielnym obszarze (strefie T) przylegającym do pęcherzyków, tj. parakorcie w LNs, wewnętrznych PALS w śledzionie lub regionie międzylitajowym (IFR) w PPs. DCs również kumulują się w strefie T do prezentowania antygenu i pierwszorzędowych komórek T (Steinman et al., 1997).
istnieją dwa różne typy mezenchymalnych podzbiorów stromalnych w strefach B I T (rysunek 1A). Pęcherzykowe komórki dendrytyczne (FDC) tworzą gęstą sieć w centrum pęcherzyków i otrzymały znaczną uwagę ze względu na ich znaczenie w produkcji przeciwciał przez komórki B (Tew i wsp., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). Fdcs express CR1 / CD35, CD23 i czasami MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Natomiast rozbudowana sieć fibroblastycznych komórek siateczkowych (FRCs) obejmuje rusztowanie strefy T, które wytwarza podoplaninę/gp38 i różne składniki macierzy pozakomórkowej (ECM) (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Ogólnie rzecz biorąc, migracja i lokalizacja komórek immunologicznych są regulowane przez różne chemokiny (Mackay, 2001). Spoczynkowe limfocyty i dojrzałe DCs są bardzo wrażliwe na” homeostatyczne chemokiny ” (Cyster, 1999; Müller et al 2003). Zgodnie z tym, istnieją wyraźne korelacje między chemokinami wytwarzanymi przez podgrupy komórek zrębowych A lokalizacją komórek odpornościowych wyrażających odpowiednie receptory; cxcl13 wytwarzany przez FDCs jest atraktantem komórek B wyrażających CXCR5, podczas gdy CCL19 i CCL21 ze strefy T FRCs przyciągają komórki T i dojrzałe DCs poprzez wspólny receptor CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Ponadto uważa się, że limfocyty, które silnie migrują w miąższu tkanek w celu skanowania antygenów, wykorzystują sieci stromalne jako oparcie (Bajénoff i wsp.2006). Różnorodne czynniki wytwarzane przez podgrupy stromal są również wymagane do aktywacji i przeżycia komórek odpornościowych (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). W związku z tym struktura i funkcja sieci zrębowej w każdym przedziale jest prawdopodobnie zoptymalizowana pod kątem aktywności podzbiorów komórek odpornościowych.
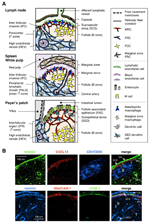
rysunek 1. Podgrupy komórek zrębowych i struktury tkankowe SLOs. A) Schematyczne przedstawienie struktur tkankowych u myszy, z naciskiem na komórki zrębowe i aparat transportujący antygen. Elementy zrębowe, w tym komórki mezenchymalne, śródbłonkowe i nabłonkowe, a także komórki mieloidalne, takie jak makrofagi i komórki dendrytyczne (wymienione w prawym panelu), są rysowane dla podkreślenia. (B) górna: struktura tkankowa zbudowana przez trzy różne typy komórek zrębowych w zewnętrznym obszarze kory LN. Fluorescencyjna immunostacja sekcji myszy LN. W górnym mikrografie znajduje się mały spoczynkowy pęcherzyk (B) bez Centrum germinalnego, który jest obsługiwany przez fdcs wyrażające CR1/CD35, ale niewykrywalne poziomy CXCL13. Zamiast tego MRC tworzą siateczkową sieć laminina + CXCL13 + w zewnętrznej krawędzi pęcherzyka pod kapsułką (CA) i SCS. Sieć skonstruowana przez FRCs w parakorteksie (T) to laminina+CXCL13-CR1/CD35-. Dolna: warstwa MRC-1 + jest ściśle związana z warstwą śródbłonka limfatycznego LYVE-1+ w SCS. Należy pamiętać, że warstwa MRC jest rozszerzona na obszar IFC.
sieć zrębowa w strefie T składa się z FRCs i wiązki ECM znanej jako włókno siatkowe, które tworzy „przewód”, który ułatwia przejście substancji o niskiej masie cząsteczkowej (Gretz et al., 1997, 2000; Nolte et al., 2003). Przewód ten transportuje różne czynniki i rozpuszczalne antygeny głęboko w tkance, podczas gdy cząstki i duże cząsteczki są przeważnie wykluczane z przedziałów limfocytów. Rzeczywiście, chemokiny limfatyczne z tkanek obwodowych są szybko transportowane do żyłki śródbłonka wysokiego przez przewód, aby kontrolować mobilizację krążących komórek do LNs (Palframan et al., 2001). Ponadto, niektóre rezydentne DCs bezpośrednio kontaktują się z przewodem i wychwytują antygeny przenoszone przez limfę (Sixt et al., 2005).
nowo zidentyfikowany podzbiór zrębowy, krańcowe komórki siateczkowe
zewnętrzny margines kory LN, tuż pod kapsułką, jest otoczony zatoką subkapsularną (SCS; Fig.1a). Powierzchnia luminalna SCS jest pokryta limfatycznymi komórkami śródbłonka, a ich strona korowa jest wspierana przez błonę podstawną, zwaną „podłogą”(Szakal et al., 1983). Szczególnie w MSSF włókna siateczkowe rozprzestrzeniają się z podłogi do kory parakorteksowej (Gretz et al., 1997). Co ważne, cienka warstwa struktury siateczkowej obserwuje się również w najbardziej oddalonym obszarze pęcherzyków. Komórki zrębowe podobne do FRC w retikulum pęcherzykowym wyrażają CXCL13 i MAdCAM-1, ale nie CCL21, co wskazuje, że komórki te różnią się od strefy T FRC, podczas gdy marker FDC CR1/CD35 był niewykryty lub tylko słabo wyrażony w tych komórkach (Katakai i in., 2008; rys. 1B i 2a). FDC nie wytwarzają włókien siateczkowych, a zatem marker siateczkowy ER-TR7 jest praktycznie nieobecny w środku pęcherzyków (Katakai et al., 2004a, b). Ponadto, komórki siateczkowe w regionie subcapsular wyraźnie wyrażają RANKL / TRANCE, który jest cytokiną z rodziny TNF, która jest niezbędna do rozwoju LN(Dougall et al., 1999; Kong et al., 1999). Dlatego te komórki zrębowe uważano za nowy podzbiór zrębowy i wyznaczono marginalne komórki siateczkowe (MRCs; Katakai et al., 2008). Należy zauważyć, że znaczna ilość CXCL13 jest konstytutywnie wyrażana w MRCs w spoczynkowych małych pęcherzykach, nawet jeśli FDCs wyrażają niewykrywalne poziomy CXCL13 (Fig. 1B). Ustalono, że zewnętrzna krawędź PALS w śledzionie, zwłaszcza ta, która leży nad pęcherzykami, graniczy z warstwą zrębową MAdCAM-1+. Komórki, które stanowią wyściółkę błony podstawnej pod zatoką brzeżną (MS) również wyrażają CXCL13 i RANKL, wskazując, że komórki te są rodzajem MRC (Katakai et al., 2008). W słodach komórki siateczkowe podobne do MRC tworzą sieć w regionie subepithelial dome (SED) tuż pod błoną Piwniczną nabłonka związanego z pęcherzykami (NIMFA; Katakai et al., 2008; Knoop et al., 2009). Łącznie MRCs uważa się za podgrupę zrębową wspólną dla SLOs, ale odrębną od FDCs i FRCs.
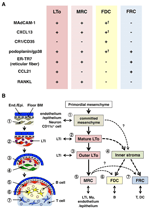
rysunek 2. Związek między MRC a innymi podgrupami komórek zrębowych w SLOs. A) wzór ekspresji markera w podzbiorach komórek zrębowych. Poziomy ekspresji MAdCAM-1, CXCL13 i podoplanin / gp38 w FDC są często słabe lub niewykrywalne przez immunohistochemię (†). (B) schemat uogólnionego modelu rozwoju SLO z lokalizacjami podzbiorów komórek zrębowych (z lewej) i przypuszczalną genealogią podzbiorów komórek zrębowych (z prawej). Liczby wskazujące elementy komórek na lewym rysunku reprezentują podzbiory komórek zrębowych pokazane w prawym schemacie. BM, membrana Piwniczna; koniec./ Epi., warstwa śródbłonka lub nabłonka.
MRCs i Droga wejścia antygenu w SLOs
wtórne narządy limfatyczne charakteryzują się specyficznymi strukturami, które filtrują i transportują antygeny do przedziałów limfocytów (Fig.1a). LNs są połączone z naczyniami limfatycznymi w celu badania antygenów przenoszonych przez limfę. Ponieważ limfatyka aferentna jest otwarta na SCS, śródbłonek limfatyczny zatok i membrana DNA są niejako przednią powierzchnią filtra LN. Śledziona filtruje krew, w której gałęzie tętnicy środkowej otwarte do MS i strefy brzeżnej (MZ), gdzie komórki odpornościowe badanie zawartości krwi. W tych wyspecjalizowanych struktur zatok, bariery graniczne są śródbłonek limfatyczny w SCS LN i śródbłonek krwi w MS śledziony, z których oba są obsługiwane przez retikulum MRC. Co ciekawe, metalofilne makrofagi CD169+ są selektywnie rozprowadzane w pobliżu błony śluzowej zatok nad pęcherzykami, z których niektóre osadzają się w barierze śródbłonka i przenoszą antygeny cząsteczkowe ze światła zatoki do przedziału limfocytów (Szakal et al., 1983; Taylor et al., 2005; Carrasco and Batista, 2007; Phan et al., 2009). DCs, które przenoszą antygeny z tkanek za pośrednictwem naczyń limfatycznych, docierają do SCS, a następnie przenoszą się do kory parakorteksowej przez podłogę kanału międzybłonowego (IFC; Steinman i in., 1997; Katakai et al., 2004b; Braun et al., 2011). W słodach nimfy działają jako bariera, w której wyspecjalizowana komórka nabłonkowa zwana komórkami M przenosi bakterie lub cząstki ze światła jelita do leżących u podstaw DCs lub makrofagów (Kraehenbuhl i Neutra, 2000). Dlatego MRC wspierają aparaturę transportującą antygen na pierwszej linii w każdym SLO. Podstawowa konstrukcja SLOs polega na tym, że pęcherzyki są ułożone głównie w kierunku miejsca wejścia antygenu i towarzyszą im strefy T. Tak więc, z punktu widzenia zrębu, cała architektura tkanki wydaje się być zorganizowana w kierunku warstwy MRC.
chociaż funkcje immunologiczne MRCs pozostają nieuchwytne, wcześniej wykazano, że Sieć przewodowa skonstruowana przez MRCs w zewnętrznym pęcherzyku transportuje małe rozpuszczalne antygeny do pęcherzykowych komórek B i FDC (Bajénoff and Germain, 2009; Roozendaal et al., 2009). Większość makrofagów CD169+ znajduje się po stronie korowej podłogi SCS i wystaje przedłużeniem do światła zatoki w celu wychwycenia cząstek (Phan et al., 2009). Tak więc MRC może być zaangażowany w lokalizację, morfologię i funkcję tych makrofagów. Rozwój komórek M w PPs wymaga sygnalizacji RANKL-RANK, która jest prawdopodobnie kontrolowana przez sieć MRC wyrażającą RANKL tuż pod nimfami (Knoop et al., 2009). Hamowanie szlaku LT, który znosi sygnatury MRC w białej miąższu śledziony, zaburza strukturę MS (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl i in., 2009). Co więcej, podwyższona ekspresja ICAM-1, VCAM-1 i CXCL13 oznacza, że MRC biorą udział w dynamicznej migracji śródmiąższowej pęcherzykowych komórek B jako funkcjonalnego rusztowania. Wykazano, że makrofagi CD169+ bezpośrednio dostarczają antygenów cząsteczkowych do specyficznych dla antygenu komórek B w tym obszarze (Carrasco and Batista, 2007; Phan et al., 2009), co sugeruje, że kontrola migracji komórek B za pośrednictwem sieci MRC może mieć wpływ na ten proces. Ponieważ MRC są również obecne w regionie IFC, mogą regulować wędrówkę DCs z SCS w kierunku strefy T.
MRCs i Organizer Stromal Cells in slo Development
wtórne narządy limfoidalne rozwijają się z anlagenu, które są agregatami komórek mezenchymalnych i hematopoetycznych związanych z naczyniami lub nabłonkiem, w określonym miejscu i okresie u płodu lub niemowlęcia (Mebius, 2003). Krytycznym wydarzeniem w rozwoju slo anlagenu jest nagromadzenie komórek krwiotwórczych CD45+CD4+CD3, które są również znane jako komórki indukujące tkankę limfatyczną (LTI), które oddziałują z mezenchymalnymi komórkami zrębowymi zwanymi komórkami organizatora tkanki limfatycznej (LTO) (Mebius i wsp., 1997). Cytokina z rodziny TNF, limfotoksyna (LT)-α1β2, która ulega ekspresji przez komórki LTi, przesyła sygnały do komórek LTO za pośrednictwem receptora LT-β. Komórki LTo następnie indukują ekspresję cząsteczek adhezyjnych, w tym ICAM-1, VCAM-1 i MAdCAM-1 oraz chemokin CXCL13, CCL19 i CCL21 (Honda i wsp., 2001; Cupedo et al., 2004a; Bénézech et al 2010). W szczególności, CXCL13 jest szczególnie ważne w przyciąganiu komórek LTi do anlagenu poprzez jego receptor CXCR5 (Finke i wsp ., 2002; Luther et al., 2003; Ohl et al., 2003). Przyjmuje się, że pętla sprzężenia zwrotnego pozytywnego, tj. nowo wymieszane komórki LTi, które produkują LT, aktywują komórki LTO stromal, promując organizację anlagenu. Gdy limfocyty zaczęły gromadzić się po urodzeniu, tkanka rozszerza się i indukowane są przedziały obsługiwane przez różne podgrupy komórek zrębowych(Cupedo et al., 2004b; Bajénoff and Germain 2009).
marginalne komórki siateczkowe i komórki LTo wyrażają bardzo podobny wzór różnych markerów (Fig.2A), co sugeruje, że istnieje pewna zależność między tymi dwoma komórkami zrębowymi. Komórki LTo wydają się być bardziej skoncentrowane w marginalnym obszarze anlagenu LN przylegającym do Zatoki limfatycznej przypuszczalnego SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Ta warstwa komórek LTo wydaje się rozszerzać na zewnątrz wraz ze wzrostem anlagenu, który ostatecznie wydaje się stać warstwą MRC (Katakai et al., 2008). Podobnie, gdy limfocyty gromadzą się wokół tętnicy centralnej w śledzionie poporodowej, komórki LTO wyrażające MAdCAM-1 i RANKL rozszerzają się wraz z warstwą i stają się MRCs w białej miąższu. Wyniki te zdecydowanie sugerują, że MRC są bezpośrednim potomkiem stromy LTo, która zachowuje cechy komórek LTo w wyspecjalizowanych miejscach w obrębie Slo. Nawet myszy z niedoborem szmat wykazują subkapsularną warstwę MRC w zanikowych LNs i kurczą się okołostawowe powłoki MRC w śledzionie, co wskazuje, że rozwój MRC zachodzi niezależnie od komórek B I T i jest programowany przed ich kolonizacją (Katakai et al., 2008). Ponieważ Slo skutecznie pobiera antygeny w celu wywołania odpowiedzi immunologicznej, struktury zbierające antygen, które są konstruowane podczas rozwoju, muszą być utrzymywane później. W związku z tym uzasadnione jest, że te struktury tkankowe są utrzymywane przez organizer-jak zrębowe komórki przez cały okres dorosłości.
związek między MRC a innymi podzbiorami Stromal
rysunek 2b pokazuje możliwą genealogię podzbiorów stromal w SLOs. W zarodku pierwotna mezenchyma, która znajduje się w pobliżu naczyń lub nabłonka, tworzy rdzeń anlage i przyciąga komórki LTi. Komórki nerwowe lub inne mniej scharakteryzowane komórki są również zaangażowane w proces początkowy (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). Akumulacja komórek LTi ułatwia dojrzewanie komórek mezenchymalnych do komórek LTo, co ostatecznie ułatwia budowę podstawowej architektury. Zazwyczaj komórki LTo mają tendencję do koncentracji na obwodzie odbytu i rozszerzają się na zewnątrz wraz ze wzrostem tkanki, podczas gdy komórki zrębowe wykazujące słabe lub żadne sygnatury LTo odwrotnie zwiększają się w wewnętrznej części odbytu. Postnatalna kolonizacja limfocytów B I T prowadzi do przedziałów z indukcją konwencjonalnych podgrup zrębowych.
Jeśli ten schemat jest poprawny, wynika z tego, że wszystkie podgrupy stromalne w dorosłych SLOs pochodzą pierwotnie z komórek LTo. Tak więc, czy MRC, które zachowują cechy komórek LTo, mają zdolność do różnicowania się w FDC lub FRC? MRC dzielą wiele podpisów z innymi podzbiorami (rysunek 2A), co sugeruje, że jest to możliwe. Spekuluje się, że MRC działają jako zrębowe komórki macierzyste, które stale dostarczają wszystkie podgrupy zrębowe przez cały okres dorosłości. Chociaż ten pomysł jest intrygujący, będzie wymagał ostrożnego rozważenia i dalszej walidacji w przyszłości. Komórki mezenchymalne są na ogół bardzo elastyczne w przyrodzie w zależności od otaczającego środowiska, a zatem specyficzne cechy można łatwo zmienić. Rozszerzona hodowla komórek zrębowych wyizolowanych z LNs powoduje utratę ekspresji dla wielu genów, szczególnie homeostatycznych chemokin (Katakai et al., 2004a; Tomei et al., 2009). Sugeruje to, że fenotypy in vivo podgrup komórek zrębowych są optymalnie utrzymywane przez okoliczności tkankowe, które są odwracalne i nie są spowodowane końcowym różnicowaniem. Ponadto bodźce zapalne indukują silną proliferację komórek zrębowych i dramatyczną przebudowę SLOs(Katakai et al., 2004a; Chyou et al., 2011). W związku z tym, chociaż MRC można przekształcić w inne podzbiory, konwencjonalne podzbiory stromalne mogą również samoodnawiać się i być wymienne w dorosłych Slo.
przebudowa SLOs i trzeciorzędowych struktur limfatycznych
podczas odpowiedzi immunologicznych, struktury zrębowe wewnątrz SLOs są dramatycznie przebudowane (Gretz et al., 1997; Katakai et al., 2004a). Niektóre infekcje powodują poważne zakłócenia struktur tkankowych w obrębie LNs i śledziony białej miazgi w ciągu kilku dni, które są przywracane w miarę eliminowania patogenów (Mueller et al., 2007a, b; Scandella et al., 2008; św. Jan i Abraham, 2009). Ten proces przywracania prawdopodobnie rekapituluje proces samoorganizacji poprzez reakcję sprzężenia zwrotnego podobną do rozwoju SLO. Co ważne, komórki podobne do LTi są również obecne w tkankach dorosłych i regulują związaną z infekcją przebudowę SLOs(Kim et al., 2003; Scandella et al., 2008). Chociaż rola MRC w takich procesach nie jest znana, prawdopodobnie mają one rolę organizacyjną we współpracy z komórkami podobnymi do LTi i określają zewnętrzną ramę Slo podczas rekonstrukcji.
w przewlekłym zapaleniu związanym z różnymi patologiami narządów, duża liczba limfocytów infiltracyjnych często prowadzi do organizacji podobnych do SLOs, znanych jako trzeciorzędowe tkanki limfatyczne (TLTs; Drayton et al., 2006). Komórki B I T są segregowane i indukowane są odpowiednie sieci podgrup komórek zrębowych. Interesujące byłoby ustalenie, czy MRC są obecne w tych ektopowych strukturach limfatycznych; jednak komórki podobne do MRC i związane z nimi struktury tkankowe nie są obserwowane w TLT, które rozwinęły się podczas autoimmunologicznego zapalenia żołądka u myszy (Katakai et al., 2006, 2008). Należy podkreślić, że TLT zasadniczo nie są zaprogramowanymi organizacjami limfoidalnymi i naturalnie nie wiążą się ze strukturami transportującymi antygen. W związku z tym MRC są prawdopodobnie nieobecne w TLT. Nawet jeśli komórki zrębowe fenotypowo podobne do MRCs mogą być indukowane w niektórych zmianach, nie można ich zidentyfikować jako MRCs, chyba że ściśle wiążą się ze specyficzną strukturą śródbłonka lub nabłonka i tworzą warstwową siateczkę na zewnętrznych pęcherzykach.
wniosek
komórki siateczkowe brzegowe są unikalną podgrupą komórek zrębowych wspólną dla SLOs. MRC wyraźnie różnią się od konwencjonalnych podgrup, które są indukowane lub dojrzewają w wyniku interakcji z limfocytami po urodzeniu i pochodzą bezpośrednio z komórek LTO zrębowych w anlagenie i są niezależne od limfocytów. Sieć MRCs jest ściśle związana z aparatem transportującym antygen SLOs i uważa się, że bezpośrednio lub pośrednio kontroluje dostarczanie antygenu do przedziałów limfocytów, jak również lokalizację i migrację komórek odpornościowych. MRC prawdopodobnie odgrywają kluczową rolę w utrzymaniu struktur SLO jako zewnętrznej ramy i mogą być przekształcane w inne podgrupy zrębowe w stanie stacjonarnym lub podczas przebudowy tkanek. Ważne będzie zbiorowe rozważenie wszystkich podgrup zrębowych, struktur tkankowych i mikrośrodowisk immunologicznych w celu kompleksowego zrozumienia systemu SLO.
Oświadczenie o konflikcie interesów
autor oświadcza, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
prace te były częściowo wspierane przez granty dla Młodych Naukowców i na badania naukowe w obszarach innowacyjnych Ministerstwa Edukacji, Kultury, Sportu, Nauki i technologii Japonii.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., and Germain, R. N. (2006). Sieci komórkowe zrębu regulują wejście, migrację i terytorialność limfocytów w węzłach chłonnych. Immunitet 25, 989-1001.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Bajénoff, M., and Germain, R. N. (2009). Rozwój pęcherzyków z komórek B przebudowuje system kanałów i umożliwia dostarczanie rozpuszczalnego antygenu do pęcherzykowych komórek dendrytycznych. Blood 114, 4989-4997.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H., and Weih, F. (2007). Wyraźne role sygnalizacji limfotoksyny-beta i homeodomeny czynnika transkrypcyjnego Nkx2, 3 w ontogenezie przedziałów śródbłonka w śledzionie. Cell Tissue Res. 328, 473-486.
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Ontogeneza komórek zrębowych organizatora podczas rozwoju węzłów chłonnych. J. Immunol. 184, 4521–4530.
PubMed Streszczenie | PubMed Pełny tekst
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., and Förster, R. (2011). Aferentne limfocyty T i DCs wykorzystują różne drogi zależne od receptora chemokin CCR7 do wejścia do węzła chłonnego i migracji wewnątrzmodalnej. Nat. Immunol. 12, 879–887.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Carrasco, Y. R., and Batista, F. D. (2007). Komórki B pozyskują antygen cząsteczkowy w obszarze bogatym w makrofagi na granicy między pęcherzykiem a zatoką subkapsularną węzła chłonnego. Immunitet 27, 160-171.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., and Lu, T. T. (2011). Skoordynowana Regulacja wzrostu naczyniowo-zrębowego węzłów chłonnych najpierw przez komórki CD11c+, a następnie przez komórki T I B. J. Immunol. 187, 5558–5567.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). Przypuszczalne organizatory węzłów chłonnych są różnie reprezentowane w rozwoju węzłów krezkowych i obwodowych. J. Immunol. 173, 2968–2975.
PubMed Streszczenie | PubMed Pełny tekst
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., and Mebius, R. E. (2004b). Inicjacja organizacji komórkowej w węzłach chłonnych jest regulowana przez sygnały pochodzące z komórek innych niż B i nie jest zależna od ligandu chemokiny CXC 13. J. Immunol. 173, 4889–4896.
PubMed Streszczenie | PubMed Pełny tekst
Cyster, J. G. (1999). Chemokiny i migracja komórek w drugorzędowych narządach limfatycznych. Nauka 286, 2098-2102.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A., and Ngo, V. N. (2000). Pęcherzykowe komórki zrębowe i limfocyty prowadzące do pęcherzyków. Immunol. Obj. 176: 181-193.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., and Schuh, J. (1999). Ranga jest niezbędna do rozwoju osteoklastów i węzłów chłonnych. Genes Dev. 13, 2412–2424.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Rozwój narządów limfatycznych: od ontogenezy do neogenezy. Nat. Immunol. 7, 344–353.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). Niezbędna funkcja receptora jądrowego (t) w wytwarzaniu komórek indukujących tkankę limfatyczną płodu. Nat. Immunol. 5, 64–73.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). Komórki CD4 + CD3 indukują rozwój plastra Peyera: rola aktywacji integryny α4β1 przez CXCR5. Immunitet 17, 363-373.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A.(2010) Komórki siateczkowe fibroblastyczne węzłów chłonnych bezpośrednio prezentują antygen tkanki obwodowej w stanie stacjonarnym i stanach zapalnych. J. Exp. Med. 207, 689–697.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Sznury, kanały, korytarze i przewody: krytyczne elementy architektoniczne ułatwiające interakcje komórkowe w korze węzłów chłonnych. Immunol. Rev. 156, 11-24.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). Chemokiny limfatyczne i inne cząsteczki o niskiej masie cząsteczkowej docierają do żylaków śródbłonka poprzez wyspecjalizowane przewody, podczas gdy funkcjonalna bariera ogranicza dostęp do mikrośrodowisk limfocytów w korze węzłów chłonnych. J. Exp. Med. 192, 1425–1440.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., and Nishikawa, S.-I. (2001). Molekularne podstawy interakcji hematopoetycznej / mezenchymalnej podczas inicjacji organogenezy plastra Peyera. J. Exp. Med. 193, 621–630.
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., and Aguzi, A. (2005). Limfotoksyna-geny zależne od receptora β w transkryptomach komórek dendrytycznych węzłów chłonnych i pęcherzykowych. J. Immunol. 174, 5526–5536.
PubMed Streszczenie | PubMed Pełny tekst
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). Przestrzenna i molekularna organizacja kory limfatycznej T: labiryntowa Jama ograniczona przez nabłonkową jednowarstwę fibroblastycznych komórek siateczkowych zakotwiczonych w macierzy pozakomórkowej przypominającej błonę podstawną. Int. Immunol. 13, 1243–1253.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Katakai, T., Hara, T., Sugai, M., Gonda, H., and Shimizu, A. (2004a). Węzły chłonne fibroblastyczne komórki siateczkowe budują retikulum zrębowe poprzez kontakt z limfocytami. J. Exp. Med. 200, 783–795.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M., and Shimizu, A. (2004b). A novel reticular stromal structure in lymph node cortex: an immuno-platform for interactions among dendritic cells, T cells and B cells. Int. Immunol. 16, 1133–1142.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., and Shimizu, A. (2006). Spontaniczna neogeneza limfoidalna na dużą skalę i zrównoważona autoimmunizacja a tolerancja w żołądku myszy transgenicznej H+/K+-reagującej na Atpazę TCR. J. Immunol. 177, 7858–7867.
PubMed Streszczenie | PubMed Pełny tekst
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., and Shimizu, A. (2008). Organizer – podobna siateczkowata warstwa komórek zrębowych wspólna dla dorosłych drugorzędowych narządów limfatycznych. J. Immunol. 181, 6189–6200.
PubMed Streszczenie | PubMed Pełny tekst
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, M. D., And Lane, P. J. (2003). Komórki CD4 + CD3 – akcesoria stymulują zagruntowane komórki T CD4 przez OX40 i CD30 w miejscach, w których komórki T współpracują z komórkami B. Immunitet 18, 643-654.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., and Williams, I. R. (2009). RANKL jest niezbędny i wystarczający do zainicjowania rozwoju komórek m pobierających antygen w nabłonku jelita. J. Immunol. 183, 5738–5747.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S., and Miyasaka, M. (1996). Strefa brzeżna śledziony jest nieobecna u zmutowanych myszy alymphoplastic Aly. Eur. J. Immunol. 26, 669–675.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., and Penninger, J. M. (1999). OPGL jest kluczowym regulatorem osteoklastogenezy, rozwoju limfocytów i organogenezy węzłów chłonnych. Nature 397, 315-323.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Komórki nabłonkowe m: różnicowanie i funkcja. Annu. Rev. Cell Dev. Biol. 16, 301–332.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., and Luther, S. A. (2007). Fibroblastyczne komórki siateczkowe w węzłach chłonnych regulują homeostazę naiwnych komórek T. Nat. Immunol. 8, 1255–1265.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). Regulowane uwalnianie tlenku azotu przez zrębę niehematopoetyczną kontroluje ekspansję aktywowanej puli limfocytów T w węzłach chłonnych. Nat. Immunol. 12, 1096–1104.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., and Cyster, J. G. (2000). Koekspresja chemokin ELC i SLC przez komórki zrębowe strefy T i delecja genu ELC u myszy PLT/plt. Proc. Natl. Acad. Sci. U. S. A. 97, 12694-12699.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Luther, S. A., Ansel, K. M., and Cyster, J. G. (2003). Nakładające się role CXCL13, receptora α interleukiny 7 i ligandów CCR7 w rozwoju węzłów chłonnych. J. Exp. Med. 197, 1191–1198.
PubMed Abstract | PubMed Full Text | CrossRef Full Text
Chemokiny: czynniki wpływające na immunologię. Nat. Immunol. 2, 95–101.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., And The Immunological Genome Project Consortium. (2012). Transkrypcyjne profilowanie zrębu z węzłów chłonnych zapalnych i spoczynkowych definiuje cechy immunologiczne. Nat. Immunol. 13, 499–510.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). Rozwijające się węzły chłonne zbierają komórki CD4 + CD3-LTß+, które mogą różnicować się do komórek APC, NK i pęcherzyków, ale nie do komórek T lub B. Immunitet 7, 493-504.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mebius, R. E. (2003). Organogeneza tkanek limfatycznych. Nat. Rev.Immunol. 3, 292–303.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., and Matloubian, M. (2007a). Regulacja ekspresji homeostatycznej chemokin i handlu komórkami podczas odpowiedzi immunologicznych. Nauka 317, 670-674.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., and Ahmed, R. (2007b). Wirusowe ukierunkowanie fibroblastycznych komórek siateczkowych przyczynia się do immunosupresji i utrzymywania się podczas przewlekłego zakażenia. Proc. Natl. Acad. Sci. U. S. A. 104, 15430-15435.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mueller, S. N., and Germain, R. N. (2009). Komórka zrębowa przyczynia się do homeostazy i funkcjonalności układu odpornościowego. Nat. Rev.Immunol. 9, 618–629.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Müller, G., Höpken, U. E., and Lipp, M. (2003). Wpływ CCR7 i CXCR5 na rozwój narządów limfatycznych i układową odporność. Immunol. Rev. 195, 117-135.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). System Przewodowy rozprowadza chemokiny i małe cząsteczki krwiopochodne przez białą miąższ śledziony. J. Exp. Med. 198, 505–512.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., and Förster, R. (2003). Mechanizmy współpracy CXCR5 i CCR7 w rozwoju i organizacji wtórnych narządów limfatycznych. J. Exp. Med. 197, 1199–1204.
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., and von Andrian, U. H. (2001). Transport i prezentacja chemokin zapalnych w HEV: mechanizm zdalnego sterowania rekrutacją monocytów do węzłów chłonnych w tkankach zapalnych. J. Exp. Med. 194, 1361–1373.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y., and Cyster, J. G. (2009). Przekaźnik kompleksu immunologicznego przez makrofagi subcapsular sinus i nierozpoznane komórki B napędza dojrzewanie powinowactwa przeciwciała. Nat. Immunol. 10, 786–793.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Roozendaal, R., Mempel, T. R., Dzbanek, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., and Carroll, M. C. (2009). Przewody pośredniczą w transporcie antygenu o niskiej masie cząsteczkowej do pęcherzyków węzłów chłonnych. Immunitet 30, 264-276.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Roozendaal, R., and Mebius, R. E. (2011). Interakcja między komórką stromalną a komórką odpornościową. Annu. Rev.Immunol. 29, 23–43.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T., and Ludewig, B. (2008). Przywrócenie integralności narządu limfatycznego poprzez interakcję komórek tkanki limfatycznej-induktora z zrębem strefy limfatycznej T. Nat. Immunol. 9, 667–675.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., and Sorokin, L. (2005). System Przewodowy transportuje rozpuszczalne antygeny z limfocytów aferentnych do komórek dendrytycznych rezydujących w obszarze limfocytów T węzła chłonnego. Immunitet 22, 19-29.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Steinman, R. M., Pack, M., and Inaba, K. (1997). Komórki dendrytyczne w obszarach limfocytów T narządów limfatycznych. Immunol. Rev. 156, 25-37.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
St John, A. L., and Abraham, S. N. (2009). Salmonella zaburza architekturę węzłów chłonnych poprzez tłumienie chemokin homeostatycznych za pośrednictwem TLR4. Nat. Med. 15, 1259–1265.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W., and Fagarasan, S. (2010). Wykrywanie bodźców środowiskowych przez pęcherzykowe komórki dendrytyczne promuje wytwarzanie immunoglobuliny w jelitach. Immunitet 33, 71-83.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Specjalizacja komórek dendrytycznych błon śluzowych pęcherzykowych ujawniona przez adhezję cząsteczki błon śluzowych-1. J. Immunol. 158, 5584–5588.
PubMed Streszczenie | PubMed Pełny tekst
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Transport kompleksów immunologicznych z zatoki subkapsularnej do pęcherzyków węzłów chłonnych na powierzchni komórek niefagocytarnych, w tym komórek o morfologii dendrytycznej. J. Immunol. 131, 1714–1727.
PubMed Streszczenie/PubMed Pełny tekst
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Receptory makrofagowe i rozpoznawanie odporności. Annu. Rev.Immunol. 23, 901–944.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., And Szakal, A. K. (1997). Pęcherzykowe komórki dendrytyczne i prezentacja antygenu i sygnałów kostymulujących do komórek B. Immunol. Rev. 156, 39-52.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., and Swartz, M. A. (2009). Przepływ płynu reguluje organizację komórek zrębowych i ekspresję CCL21 w mikrośrodowisku węzłów chłonnych inżynierii tkankowej. J. Immunol. 183, 4273–4283.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J., and Mebius, R. E. (2009). Chemokina CXCL13 jest niezbędna do inicjacji węzłów chłonnych i jest indukowana przez kwas retinowy i stymulację neuronalną. Nat. Immunol. 10, 1193–1199.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., and Kioussis, D. (2007). Receptor kinazy tyrozynowej Ret jest kluczowym regulatorem organogenezy plastra Peyera. Nature 446, 547-551.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., and Kollias, G. (2006). Specyficzne dla FDC funkcje p55TNFR i IKK2 w rozwoju sieci FDC i odpowiedzi przeciwciał. Immunitet 24, 65-77.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., and Chaplin, D. D. (2009). Lymphotoxin LTa1ß2 kontroluje postnatalną i dorosłą śledzionę brzegową zatok naczyniowych struktury i funkcji. Immunitet 30, 408-420.
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst