Fronteiras na Imunologia
- introdução
- compartimentos das células T e B e dois subconjuntos convencionais de células estromais
- um subconjunto estromal recentemente identificado, células reticulares marginais
- MRCs e células estromais organizadoras no desenvolvimento de SLO
- a relação entre as RCM e outros subconjuntos estromais
- remodelação das abrunhos e estruturas linfóides terciárias
- conclusão
- Declaração de conflito de interesses
- Agradecimentos
introdução
órgãos/tecidos linfóides secundários (SLOs) são essenciais para a indução eficiente de respostas imunitárias adaptativas. Vários tipos de abrunhos, incluindo os gânglios linfáticos (LNs), baço e tecidos linfóides associados às mucosas (MALTs), tais como manchas de Peyer (PPs), estão estrategicamente posicionados em vários lugares dentro do corpo. As abrunhas são um filtro elaborado que recolhe antigénios e está equipado com sensores imunológicos altamente sensíveis. A fim de coletar e filtrar antigénios estranhos, Os abrunhos contêm estruturas tecidulares especializadas que estão associadas com o endotélio ou epitélio. Células imunes como linfócitos, células dendríticas (DCs), e macrófagos se acumulam para altas densidades e formam compartimentos. Uma característica notável comum a todos os SLOs é a localização segregada de células B e células T. A arquitetura do SLOs é suportada por vários tipos de células estromais não hematopoiéticas de origem mesenquímica, que constroem redes e definem compartimentos (Mueller e Germain, 2009; Roozendaal e Mebius, 2011). As redes estromais fornecem não apenas um ponto de apoio funcional, mas também um espaço para as atividades das células imunes, bem como uma estrutura física para o tecido. Além disso, evidências crescentes indicam que as células estromais também desempenham papéis críticos na função das células imunitárias e homeostase (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Os abrunhos são programados para desenvolver-se a partir do anlagénio que ocorre em certos locais e durante períodos restritos no feto e na criança. Além disso, as células estromais são conhecidas por serem importantes para o desenvolvimento e manutenção do SLO (Mebius, 2003). Aqui, concentro-me num subconjunto estromal recentemente identificado, células reticulares marginais (MRCs), e resume as suas características. Também discuto a relação entre os RCM e a estrutura dos tecidos, outros subconjuntos estromais e funções imunológicas.
compartimentos das células T e B e dois subconjuntos convencionais de células estromais
conforme descrito acima, as células B E T localizam-se em regiões distintas dentro de SLOs. As células B acumulam-se para formar folículos (zona B) no córtex exterior por baixo da cápsula em LNs ou na bainha externa do linfóide periarteriolar (PALS) no baço. Um aglomerado de folículos grandes é o tecido central da PPs. Durante as respostas imunitárias, as células B activadas nos folículos formam centros germinais, onde se diferenciam em produtores de anticorpos de elevada afinidade (Cyster et al., 2000). Em contraste, as células T localizam-se em uma área separada (zona T) adjacente aos folículos, ou seja, o paracórtex em LNs, PALS internas no baço, ou região interfolicular (IFR) em PPs. DCs também se acumulam na zona T para apresentar células T de antígeno e prime (Steinman et al., 1997).existem dois tipos diferentes de subconjuntos estromais mesenquimais nas zonas B E T (figura 1A). As células dendríticas foliculares (FDCs) formam uma rede densa no centro dos folículos e receberam atenção considerável devido à sua importância na produção de anticorpos por células B (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs express CR1 / CD35, CD23, e ocasionalmente MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Em contraste, uma rede elaborada de células reticulares fibroblásticas (FRCs) compreende o suporte da zona T, que produz podoplanina/gp38 e vários componentes de matriz extracelular (ECM) (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Em geral, a migração e localização de células imunitárias são reguladas por uma variedade de quimioquinas (Mackay, 2001). Os linfócitos em repouso e os DCs maduros são altamente sensíveis às “quimioquinas homeostáticas” (Cyster, 1999; Müller et al 2003). De acordo com isso, há uma clara correlação entre as quimiocinas produzidas pela célula do estroma subconjuntos e a localização das células do sistema imunológico, expressando os receptores correspondentes; CXCL13 produzido pelo Cdfs é um atrativo de células B expressando CXCR5, enquanto CCL19 e CCL21 de T zona FRCs atrair células T e maduro DCs através comum receptor CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Além disso, acredita-se que linfócitos que migram robustamente no parênquima tecidular para escanear antígenos usam redes estromais como base (Bajénoff et al 2006). Uma variedade de fatores produzidos por subconjuntos estromais também são necessários para a ativação e sobrevivência de células imunes (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Portanto, a estrutura e função da rede estromal em cada compartimento é provavelmente otimizada para a atividade dos subconjuntos de células imunes.
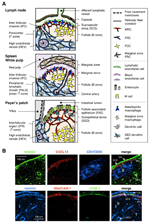
a FIGURA 1. Subconjuntos de células estromais e estruturas de tecidos de abrunhos. A) representação esquemática das estruturas tecidulares em abrunhos de rato, com ênfase nas células estromais e no aparelho de transporte de antigénios. Elementos estromais, incluindo células mesenquimais, endoteliais e epiteliais, bem como células mielóides, tais como macrófagos e células dendríticas (listadas no painel direito), são desenhados para ênfase. B) superior: a estrutura tecidular construída por três tipos diferentes de células estromais na região cortical exterior de LN. Imunodeficiência fluorescente de uma secção de Ln do rato. No micrografo superior, há um pequeno folículo em repouso (B) sem um centro germinal, que é suportado por FDCs expressando CR1/CD35 mas níveis indetectáveis de CXCL13. Em vez disso, MRCs formam uma rede reticular + laminina+CXCL13+ na borda externa do folículo por baixo da cápsula (CA) e SCS. A rede construída pela FRCs no paracortex (T) é laminina+CXCL13-CR1/CD35-. Inferior: a camada MAdCAM-1+ MRC está estreitamente associada com a camada endotelial LYVE-1+ linfática no SCS. Note que a camada MRC é estendida para a área IFC.
a rede estromal na zona T é composta por CCR e um feixe ECM conhecido como uma fibra reticular, que forma um “conduíte” que facilita a passagem de substâncias de baixo peso molecular (Gretz et al., 1997, 2000; Nolte et al., 2003). Esta conduta transporta vários factores e antigénios solúveis profundamente no tecido, enquanto as partículas e as grandes moléculas são predominantemente excluídas dos compartimentos dos linfócitos. Na verdade, quimioquinas linfáticas de tecidos periféricos são rapidamente transportadas para a venula endotelial elevada através da conduta para controlar a mobilização de células circulantes para o LNs (Palframan et al., 2001). Além disso, alguns DCs residentes contactam directamente o conduíte e capturam antigénios linfáticos (Sixt et al., 2005).
um subconjunto estromal recentemente identificado, células reticulares marginais
a margem externa do córtex LN, logo abaixo da cápsula, é cercada pelo seio subcapsular (SCS; figura 1A). A superfície luminal do SCS é coberta com células endoteliais linfáticas e seu lado cortical é apoiado pela membrana basilar, chamada de “floor” (Szakal et al., 1983). Particularmente dentro da IFRs, as fibras reticulares se espalham do chão para o paracórtex (Gretz et al., 1997). Importante, uma fina camada de estrutura reticular também é observada na região ultraperiférica dos folículos. CRF-como células do estroma em folicular reticulum express CXCL13 e MAdCAM-1, mas não CCL21, o que indica que estas células são distintos de T zona FRCs, enquanto a FDC marcador CR1/CD35 foi detectado ou apenas fracamente expressos nestas células (Katakai et al., 2008; figuras 1B e 2A). FDCs não geram fibras reticulares, e consequentemente, o marcador reticular ER-TR7 está virtualmente ausente no centro dos folículos (Katakai et al., 2004a, b). Além disso, células reticulares na região subcapsular expressam especificamente RANKL/TRANCE, que é uma citocina da família TNF que é essencial para o desenvolvimento LN (Dougall et al., 1999; Kong et al., 1999). Por conseguinte, estas células estromais foram consideradas como um novo subconjunto estromal e foram designadas células reticulares marginais (MRCs; Katakai et al., 2008). Note-se que uma quantidade substancial de Cxcl13 é constitucionalmente expressa em MRCs em pequenos folículos em repouso, mesmo que FDCs expressem níveis indetectáveis de CXCL13 (figura 1B). É bem estabelecido que a borda externa de PALS no baço, especialmente o que se encontra sobre os folículos, é limitado por uma camada MAdCAM-1+ estromal. As células que constituem o revestimento da membrana basilar sob o sinusal marginal (MS) também expressam CXCL13 e RANKL, indicando que estas células são um tipo de MRCs (Katakai et al., 2008). Em Maltes, células reticulares semelhantes a MRCs formam uma rede na região subepitelial dome (SED) logo abaixo da membrana basilar do epitélio associado ao folículo (FAE; Katakai et al., 2008; Knoop et al., 2009). Em conjunto, pensa-se que os MRCs são um subconjunto estromal comum aos SLOs, mas distinto dos FDCs e FRCs.
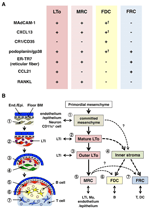
FIGURA 2. Relação entre MRCs e outros subconjuntos de células estromais em abrunhos. A) Padrão de expressão de marcadores nos subconjuntos de células estromais. Os níveis de expressão de MAdCAM-1, CXCL13 e podoplanina/gp38 nos FDCs são frequentemente fracos ou indetectáveis pela imunohistoquímica (†). (B) Esquematic of a generalized model of SLO development with the locations of stromal cell subsets (left) and a putative genealogy of stromal cell subsets (right). Os números que indicam os elementos das células no desenho à esquerda representam subconjuntos de células estromais apresentados no esquema à direita. Bm, membrana da cave; fim./IMA., camada endotelial ou epitelial.os órgãos linfóides secundários são caracterizados por estruturas peculiares que filtram e transportam antigénios para os compartimentos dos linfócitos (figura 1A). Os LNs estão ligados aos vasos linfáticos para examinar os antigénios linfáticos. Como as linfáticas afferentes estão abertas para o SCS, o endotélio linfático do seio e a membrana da cave do chão são, por assim dizer, a superfície frontal do filtro LN. O baço filtra o sangue, em que os ramos da artéria central se abrem para a em e a zona marginal (MZ), onde as células imunitárias examinam o conteúdo sanguíneo. Nestas estruturas sinusais especializadas, as barreiras fronteiriças são o endotélio linfático no SCS do LN e o endotélio sanguíneo no MS do baço, ambos apoiados pelo MRC reticulum. Curiosamente, os macrófagos CD169+ metallófilos são distribuídos selectivamente perto do revestimento sinusal sobre os folículos, alguns dos quais se estabelecem através da barreira endotelial e transmitem antigénios de partículas do lúmen sinusal para o compartimento de linfócitos (Szakal et al., 1983; Taylor et al., 2005; Carrasco and Batista, 2007; Phan et al., 2009). Os DCs que transportam antigénios dos tecidos através dos vasos linfáticos chegam ao SCS e, subsequentemente, movem-se para o paracórtex através do piso do canal interfolicular (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). Em MALTs, a FAE funciona como a barreira na qual uma célula epitelial especializada chamada células M transfere bactérias ou partículas do lúmen do intestino para DCs ou macrófagos subjacentes (Kraehenbuhl e Neutra, 2000). Por conseguinte, o MRCs suporta o aparelho de transporte de antigénios na linha da frente em cada SLO. O desenho básico dos abrunhos é que os folículos são principalmente dispostos em direção ao local de entrada do antigénio e são acompanhados por zonas T. Assim, de um ponto de vista estromal, toda a arquitetura de tecido parece ser organizada em direção à camada MRC.
embora as funções imunológicas do MRCs permaneçam evasivas, foi anteriormente demonstrado que a rede de condutas construída pelo MRCs no folículo exterior transporta pequenos antigénios solúveis para células foliculares B e FDCs (Bajénoff e Germain, 2009; Roozendaal et al., 2009). A maioria dos macrófagos CD169 + são posicionados no lado cortical do piso SCS e projetam uma extensão para o lúmen sinusal para capturar partículas (Phan et al., 2009). Assim, MRCs pode estar envolvido na localização, morfologia e função destes macrófagos. M cell development in PPs requires RANKL-RANK signaling, which is likely controlled by a RANKL-expressing MRC network just beneath the FAE (Knoop et al., 2009). A inibição da via LT, que elimina as assinaturas MRC na polpa branca esplénica, perturba a estrutura MS (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Além disso, a expressão elevada ICAM-1, VCAM-1 e CXCL13 implica que os MRCs estão envolvidos na migração intersticial dinâmica das células foliculares B como um andaime funcional. Foi demonstrado que os macrófagos CD169+ produzem directamente antigénios de partículas em células B específicas dos antigénios nesta área (Carrasco e Batista, 2007; Phan et al., 2009), sugerindo que o controlo mediado pela rede MRC da migração de células B pode ter impacto neste processo. Uma vez que os MRCs também estão presentes na região do IFC, eles possivelmente regulam a transmigração de DCs do SCS para a zona T.
MRCs e células estromais organizadoras no desenvolvimento de SLO
os órgãos linfóides secundários desenvolvem-se a partir do anlagen, que são agregados de células mesenquimais e hematopoiéticas associadas a vasos ou epitélio, num local e período definidos no feto ou bebé (Mebius, 2003). Um evento crítico no desenvolvimento do Anlagen SLO é a acumulação de células CD45+CD4+CD3 – hematopoiéticas, que também são conhecidas como células indutoras do tecido linfóide (LTi) que interagem com células estromais mesenquimais chamadas células organizadoras do tecido linfóide (LTo) (Mebius et al., 1997). Uma família de TNF citocina, linfotoxina (LT)-α1β2 que é expressa pelas células LTi transmite sinais para as células LTo através do receptor LT-β. LTo células, posteriormente, induzir a expressão de moléculas de adesão, incluindo ICAM-1, VCAM-1, e MAdCAM-1, e quimiocinas CXCL13, CCL19, e CCL21 (Honda et al., 2001; Cupedo et al., 2004a;Bénézech et al 2010). Em particular, o CXCL13 é especialmente importante para atrair as células LTi para o anlagénio através do seu receptor CXCR5 (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). É assumido que um laço de feedback positivo, i.e. recém-imigrando células LTi que produzem it ainda mais ativar células LTo stromal, promovendo a organização do anlagen. À medida que os linfócitos começaram a acumular-se após o nascimento, o tecido expande-se e os compartimentos suportados por diferentes subconjuntos celulares estromais são induzidos (Cupedo et al., 2004b; Bajénoff and Germain 2009).
células reticulares marginais e células LTo expressam um padrão muito semelhante de vários marcadores (figura 2A), sugerindo que existe alguma relação entre estas duas células estromais. As células LTo parecem estar mais concentradas na região marginal do LN anlagen adjacente ao seio linfático do presumível SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Esta camada de células LTo parece expandir-se externamente com o crescimento do anlagen, que finalmente parece se tornar a camada MRC (Katakai et al., 2008). Da mesma forma, como os linfócitos se acumulam em torno da artéria central no baço pós-natal, as células LTo expressando MAdCAM-1 e RANKL se expandem com a camada e se tornam MRCs na polpa branca. Estes achados sugerem fortemente que os MRCs são um descendente direto do estroma do LTo, que preservam as características das células do LTo em locais especializados dentro do SLOs. Mesmo ratos RAG-deficientes exibem uma camada subcapsular de MRC em LNs atróficos e encolhem as bainhas periarteriais de MRC no baço, indicando que o desenvolvimento de MRC ocorre independentemente das células B E T e é programado antes de sua colonização (Katakai et al., 2008). Uma vez que os SLOs colhem eficazmente antigénios para desencadear respostas imunitárias, as estruturas de recolha de antigénios construídas durante o desenvolvimento têm de ser mantidas a partir daí. Consequentemente, é razoável que estas estruturas de tecidos sejam mantidas por células estromais organizadoras durante toda a idade adulta.
a relação entre as RCM e outros subconjuntos estromais
a figura 2B mostra a possível genealogia dos subconjuntos estromais em abrunhos. No embrião, o mesenchyme primordial que está em estreita proximidade com a vasculatura ou epitélio está comprometido a formar o núcleo anlage e atrai as células LTi. As células nervosas ou outras células menos caracterizadas também estão envolvidas no processo inicial (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). A acumulação de células LTi facilita a maturação de células mesenquimais em células LTo, o que, em última análise, facilita a construção da arquitetura básica. Tipicamente, as células LTo tendem a concentrar-se na periferia da anlage e expandir-se para fora com o crescimento do tecido, enquanto as células estromais exibindo sinais LTO fracos ou sem sinais inversamente aumentam na porção interna da anlage. A colonização pós-natal das células B E T leva a compartimentos com a indução de subconjuntos estromais convencionais.
Se este esquema estiver correto, segue-se que todos os subconjuntos estromais em abrunhos adultos são originalmente derivados de células LTo. Assim, os MRCs que preservam as características das células LTo têm a capacidade de se diferenciar em FDCs ou FRCs? As CCR partilham muitas assinaturas com outros subconjuntos (figura 2A), o que sugere que isso é possível. Uma especulação é que os RCM funcionam como células estaminais estromais que continuamente fornecem todos os subconjuntos estromais durante a idade adulta. Embora esta ideia seja intrigante, exigirá uma ponderação cautelosa e uma maior validação no futuro. Células mesenquimais são geralmente altamente flexíveis na natureza, dependendo do ambiente circundante, e assim características específicas podem ser facilmente alteradas. A cultura prolongada de células estromais isoladas do LNs resulta em perda de expressão para muitos genes, particularmente quimioquinas homeostáticas (Katakai et al., 2004a; Tomei et al., 2009). Isto sugere que os fenótipos in vivo de subconjuntos celulares estromais são mantidos de forma otimizada pelas circunstâncias tecidulares, que são reversíveis e não devido à diferenciação terminal. Além disso, estímulos inflamatórios induzem a proliferação robusta de células estromais e a remodelação dramática de abrunhos (Katakai et al., 2004a; Chyou et al., 2011). Por conseguinte, embora os RCM pudessem ser convertidos para outros subconjuntos, os subconjuntos estromais convencionais poderiam também ser auto-renovados e intercambiáveis em abrunhos adultos.
remodelação das abrunhos e estruturas linfóides terciárias
durante as respostas imunitárias, as estruturas estromais dentro das abrunhos são drasticamente remodeladas (Gretz et al., 1997; Katakai et al., 2004a). Algumas infecções causam uma ruptura grave das estruturas dos tecidos dentro do LNs e da polpa branca esplênica em poucos dias, que é restaurada à medida que os patógenos são erradicados (Mueller et al., 2007a, b; Scandella et al., 2008; São João E Abraão, 2009). Este processo de restauração provavelmente recapitula um processo de auto-organização através de uma reação de feedback semelhante ao desenvolvimento do SLO. O importante é que as células Tipo LTi também estão presentes nos tecidos adultos e regulam a remodelação associada à infecção de abrunhos (Kim et al., 2003; Scandella et al., 2008). Embora o papel dos SCR em tais processos seja desconhecido, eles possivelmente têm um papel de organização em colaboração com células LTi-like e determinam o quadro exterior dos SLOs durante a reconstrução.
na inflamação crónica associada a várias patologias orgânicas, um grande número de linfócitos infiltrados frequentemente leva a organizações que são semelhantes a abrunhos, conhecidos como tecidos linfóides terciários (TLTs; Drayton et al., 2006). As células B E T são segregadas e as redes correspondentes de subconjuntos de células estromais são induzidas. Seria interessante determinar se os MRCs estão presentes nestas estruturas linfóides ectópicas; no entanto, as células do tipo MRC e as estruturas tecidulares relacionadas não são observadas nos TLTs que se desenvolveram durante a gastrite auto-imune do rato (Katakai et al., 2006, 2008). Deve-se enfatizar que os TLTs não são fundamentalmente organizações linfóides programadas e, naturalmente, não se associam com as estruturas de transporte de antigénios. Por conseguinte, é provável que os RCM estejam ausentes nos TLTs. Embora as células estromais fenotipicamente semelhantes aos RCM possam ser induzidas em algumas lesões, não seriam identificadas como RCM a menos que se associem estreitamente à estrutura endotelial ou epitelial específica e formem um retículo em camadas nos folículos exteriores.
conclusão
as células reticulares marginais são um subconjunto de células estromais único comum a SLOs. Os RCM são claramente diferentes dos subconjuntos convencionais induzidos ou maturados através de interacções com linfócitos após o nascimento, e são directamente derivados de células estromais do LTo no anlagénio e independentes dos linfócitos. A rede de MRCs está estreitamente associada com o aparelho de transporte de antigénios de SLOs e pensa-se que controla directa ou indirectamente a entrega de antigénios aos compartimentos de linfócitos, bem como a localização e migração de células imunitárias. As RCM podem desempenhar papéis fundamentais na manutenção das estruturas SLO como quadro exterior e podem ser convertidas em outros subconjuntos estromais em estado estacionário ou durante a remodelação tecidular. Será importante considerar coletivamente todos os subconjuntos estromais, estruturas de tecidos e microambientes imunológicos, a fim de compreender de forma abrangente o sistema SLO.
Declaração de conflito de interesses
o autor declara que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi apoiado em parte por Subvenção para Jovens cientistas e para a Investigação Científica em Áreas Inovadoras do Ministério da Educação, Cultura, Esportes, Ciência e Tecnologia do Japão.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., e Germain, R. N. (2006). Redes de células estromais regulam a entrada de linfócitos, migração e territorialidade nos gânglios linfáticos. Imunidade 25, 989-1001.
Pubmed Abstract | Pubmed texto completo / CrossRef texto completo
Bajénoff, M., and Germain, R. N. (2009). O desenvolvimento folicular das células B remodela o sistema de conduta e permite a entrega do antigénio solúvel às células dendríticas foliculares. Sangue 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H., and Weih, F. (2007). Papéis distintos da sinalização linfotoxina-beta e do factor de transcrição homeodomain Nkx2.3 na ontogenia dos compartimentos endoteliais no baço. Cell Tissue Res. 328, 473-486.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Ontogeny of stromal organizer cells during lymph node development. J. Immunol. 184, 4521–4530.
Pubmed Resumo | Pubmed Texto Completo
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Kaelble, A., e Förster, R. (2011). As células T e os CCS derivados de linfócitos afferentes utilizam diferentes vias dependentes do receptor da quimiocina CCR7 para a entrada no gânglio linfático e na migração intranodal. Conversao. Imunol. 12, 879–887.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Carrasco, Y. R., and Batista, F. D. (2007). As células B adquirem antigénio de partículas numa área rica em macrófagos, na fronteira entre o folículo e o seio subcapsular do gânglio linfático. Imunidade 27, 160-171.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., and Lu, T. T. (2011). Regulação coordenada do crescimento vascular-estromal dos gânglios linfáticos primeiro pelas células CD11c+ e depois pelas células T e B. J. Immunol. 187, 5558–5567.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Curral, G., e Mebius, R. c. (2004a). Os organizadores presumíveis de gânglios linfáticos são representados diferencialmente no desenvolvimento de gânglios mesentéricos e Periféricos. J. Immunol. 173, 2968–2975.
Pubmed Resumo | Pubmed Texto Completo
Cupedo, T., Lund, F. E., Ong, V. N., Ribeiro, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Curral, G., Cyster, J. G., e Mebius, R. E. (2004b). O início da organização celular nos gânglios linfáticos é regulado por sinais não derivados de células B e não depende do CXC chemokine ligand 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract / Pubmed Full Text
Cyster, J. G. (1999). Quimioquinas e migração celular em órgãos linfóides secundários. Science 286, 2098-2102.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A., and Ngo, V. N. (2000). Células foliculares do estroma e linfócitos em direcção aos folículos. Imunol. Rev. 176: 181-193.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Silva, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Almeida, D., Morrissey, P. J., Peschon, J. J., and Schuh, J. (1999). O RANK é essencial para o desenvolvimento de osteoclastos e gânglios linfáticos. Genes Dev. 13, 2412–2424.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Desenvolvimento de órgãos linfóides: da ontogenia à neogénese. Conversao. Imunol. 7, 344–353.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). Uma função essencial para o receptor nuclear RORy(t) na geração de células indutoras do tecido linfóide fetal. Conversao. Imunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., ache-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). As células CD4+CD3 induzem o desenvolvimento do patch de Peyer: papel da ativação da integrina α4β1 pelo CXCR5. Imunidade 17, 363-373.Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L., e Turley, S. J. (2010). As células reticulares fibroblásticas dos gânglios linfáticos apresentam directamente o antigénio do tecido periférico em estado estacionário e em condições inflamatórias. J. Exp. Med. 207, 689–697.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Cordões, canais, corredores e condutas: elementos arquitectónicos críticos que facilitam as interacções celulares no córtex dos gânglios linfáticos. Imunol. Rev. 156, 11-24.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). As quimioquinas linfáticas e outras moléculas de baixo peso molecular atingem venulas endoteliais elevadas através de condutas especializadas, enquanto uma barreira funcional limita o acesso ao microambiente linfócito no córtex dos gânglios linfáticos. J. Exp. Med. 192, 1425–1440.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., and Nishikawa, S.-I. (2001). Base Molecular para a interacção hematopoiética / mesenquimal durante o início da organogénese patch de Peyer. J. Exp. Med. 193, 621–630.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., e Aguzzi, A. (2005). Genes dependentes do receptor linfotoxina-β nos gânglios linfáticos e transcriptomas das células dendríticas foliculares. J. Immunol. 174, 5526–5536.
Pubmed Abstract / Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). Spatial and molecular organization of lymph node T cell cortex: a labyrinthine cavity bounded by an epithelium-like monolayer of fibroblastic reticular cells ancored to basement membrane-like extracelular matrix. T. Imunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Ronda, H., and Shimizu, A. (2004a). As células reticulares fibroblásticas dos gânglios linfáticos constroem o retículo estromal através do contacto com linfócitos. J. Exp. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, J. H., Ronda, H., Sugai, M., and Shimizu, A. (2004b). A novel reticular stromal structure in lymph node cortex: an immuno-platform for interactions among dendritic cells, T cells and B cells. T. Imunol. 16, 1133–1142.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Ágata, Y., Nishio, A., Masuda, T., Sakaguchi, S., and Shimizu, A. (2006). Neogénese linfóide espontânea de grande escala e autoimunidade equilibrada versus tolerância no estômago do Ratinho transgénico TCR transgénico reativo à H+/K+-ATPase. J. Immunol. 177, 7858–7867.
Pubmed Resumo | Pubmed Texto Completo
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., e Shimizu, A. (2008). Célula reticular organizadora comum aos órgãos linfóides secundários adultos. J. Immunol. 181, 6189–6200.
Pubmed Resumo | Pubmed Texto Completo
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Juiz, A., Raykundalia, C., Walker, L. S., Goodall, M. D., da Faixa de rodagem, P. J. (2003). As células CD4+ CD3 – acessórios coestimulam as células T CD4 carregadas através de OX40 e CD30 nos locais onde as células T colaboram com as células B. Imunidade 18, 643-654.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Knoop, K. A., Kumar, N. Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., e Williams, I. R. (2009). O RANKL é necessário e suficiente para iniciar o desenvolvimento de células M de amostragem de antigénios no epitélio intestinal. J. Immunol. 183, 5738–5747.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Watanabe, T., Miyawaki, S., and Miyasaka, M. (1996). A zona marginal esplénica está ausente em ratinhos alinfoplásicos aly mutantes. Euro. J. Immunol. 26, 669–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., e Penninger, J. M. (1999). O OPGL é um regulador chave da osteoclastogénese, do desenvolvimento linfocitário e da organogénese dos gânglios linfáticos. Nature 397, 315-323.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Células m epiteliais: diferenciação e função. Annu. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., e Luther, S. A. (2007). As células reticulares fibroblásticas nos gânglios linfáticos regulam a homeostase das células T. Conversao. Imunol. 8, 1255–1265.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Lukacs-Kornek, V., Malhotra, D., Fletcher, R. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., e Turley, S. J. (2011). A libertação regulamentada de óxido nítrico por estroma não hematopoiético controla a expansão do conjunto de células T activadas nos gânglios linfáticos. Conversao. Imunol. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., and Cyster, J. G. (2000). Coexpression of the chemokines ELC and SLC by T zone stromal cells and deletation of the ELC gene in the plt/plt mouse. Procedimento. Natl. Acad. Ciência. U. S. A. 97, 12694-12699.
Pubmed Abstract | Pubmed texto completo/CrossRef texto completo
Luther, S. A., Ansel, K. M., and Cyster, J. G. (2003). Funções sobrepostas do CXCL13, interleucina 7 receptor α, e ligantes CCR7 no desenvolvimento de gânglios linfáticos. J. Exp. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, C. R. (2001). Chemokines: immunology’s high impact factors. Conversao. Imunol. 2, 95–101.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Malhotra, D., Fletcher, R. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B.* Carroll, M. C., Mooney, D. J., Turley, S. J., and the Immunological Genome Project Consortium. (2012). O perfil transcritional do estroma dos gânglios linfáticos inflamados e em repouso define sinais imunológicos. Conversao. Imunol. 13, 499–510.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). Os gânglios linfáticos em desenvolvimento recolhem células CD4+ CD3-LTß+ que podem diferenciar-se das células APC, NK e folicular, mas não das células T ou B. Imunidade 7, 493-504.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E. (2003). Organogénese dos tecidos linfóides. Conversao. Rev. Immunol. 3, 292–303.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Alves, R., e Matloubian, M. (2007a). Regulação da expressão homeostática da quimioquina e do tráfico de células durante as respostas imunitárias. Science 317, 670-674.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., e Ahmed, R. (2007b). A focalização Viral das células reticulares fibroblásticas contribui para a imunossupressão e persistência durante a infecção crónica. Procedimento. Natl. Acad. Ciência. U. S. A. 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., and Germain, R. N. (2009). A célula estromal contribui para a homeostase e funcionalidade do sistema imunológico. Conversao. Rev. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Müller, G., Höpken, U. E., and Lipp, M. (2003). O impacto da CCR7 e CXCR5 no desenvolvimento de órgãos linfóides e na imunidade sistémica. Imunol. Rev. 195, 117-135.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Curral, G., e Mebius, R. E. (2003). Um sistema de Conduta distribui quimioquinas e pequenas moléculas de sangue através da polpa branca esplênica. J. Exp. Med. 198, 505–512.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., Förster, R. (2003). Mecanismos cooperantes de CXCR5 e CCR7 no desenvolvimento e Organização de órgãos linfóides secundários. J. Exp. Med. 197, 1199–1204.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., henry Rollins, B. J., Zweerink, H., Rot, A. von Andrian, U. H. (2001). Inflammatory chemokine transport and presentation in HEV: a remote control mechanism for monocyte recruitment to lymph nods in inflamed tissues. J. Exp. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y., and Cyster, J. G. (2009). Imunomplex relé por macrófagos subapsulares sinusais e células B não-cognatas impulsionam a maturação da afinidade dos anticorpos. Conversao. Imunol. 10, 786–793.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Roozendaal, R., Mempel, T. R., Jarro, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., e Carroll, M. C. (2009). As condutas mediam o transporte do antigénio de baixo peso molecular para folículos dos gânglios linfáticos. Imunidade 30, 264-276.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Roozendaal, R., and Mebius, R. E. (2011). Interacções entre células estromais e células imunitárias. Annu. Rev. Immunol. 29, 23–43.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D.), Luther, S. A., Junt, T., and Ludewig, B. (2008). Restauração da integridade dos órgãos linfóides através da interacção das células indutoras do tecido linfóide com o estroma da zona das células T. Conversao. Imunol. 9, 667–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., and Sorokin, L. (2005). O sistema de Conduta transporta antigénios solúveis da linfa aferente para células dendríticas residentes na área das células T do gânglio linfático. Imunidade 22, 19-29.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M., and Inaba, K. (1997). Células dendríticas nas áreas das células T dos órgãos linfóides. Imunol. Rev. 156, 25-37.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
St John, A. L., and Abraham, S. N. (2009). A Salmonella perturba a arquitectura dos gânglios linfáticos através da supressão mediada pelo TLR4 das quimioquinas homeostáticas. Conversao. Med. 15, 1259–1265.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Suzuki, K., Maruya, M., Kawamoto, S.), Sitnik, K., Kitamura, H., Agace, W. W., and Fagarasan, S. (2010). A detecção de estímulos ambientais por células dendríticas foliculares promove a imunoglobulina A geração no intestino. Imunidade 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Especialização das células dendríticas foliculares das mucosas reveladas pela molécula de adesão das células-1 das mucosas. J. Immunol. 158, 5584–5588.
Pubmed Abstract/Pubmed Full Text
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Transporte de complexos imunes do seio subcapsular para folículos linfáticos na superfície de células não-fagocíticas, incluindo células com morfologia dendrítica. J. Immunol. 131, 1714–1727.
Pubmed Abstract / Pubmed Full Text
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Receptores macrófagos e reconhecimento imunológico. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., And Szakal, A. K. (1997). Células dendríticas foliculares e apresentação de antigénios e sinais costimulatórios às células B. Imunol. Rev. 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., and Swartz, M. A. (2009). Fluid flow regulates stromal cell organization and CCL21 expression in a tissue-engineered lymph node microambientment. J. Immunol. 183, 4273–4283.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Ribeiro, T. D., de Jonge, W. J., e Mebius, R. E. (2009). A quimiocina CXCL13 é essencial para a iniciação dos gânglios linfáticos e é induzida pelo ácido retinóico e pela estimulação neuronal. Conversao. Imunol. 10, 1193–1199.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Veiga-Fernandes, H., Coles, M. C., Ferraz, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., e Kioussis, D. (2007). O ret do receptor de tirosina cinase é um regulador chave da organogénese patch de Peyer. Nature 446, 547-551.
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., e Kollias, G. (2006). Funções específicas da FDC de p55TNFR e IKK2 no desenvolvimento de redes de FDC e de respostas a anticorpos. Imunidade 24, 65-77.
Pubmed Abstract | Pubmed Full Text / CrossRef Full Text
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K.( 2009). A linfotoxina LTa1ß2 controla a estrutura e a função vasculares sinusais marginais pós-natal e do baço adulto. Imunidade 30, 408-420.
Pubmed Abstract / Pubmed texto completo / CrossRef texto completo