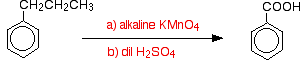quelques réactions supplémentaires du benzène et du méthylbenzène
La sulfonation du méthylbenzène
Le méthylbenzène est plus réactif que le benzène en raison de la tendance du groupe méthyle à « pousser » les électrons vers le cycle. Exactement comment cela augmente la vitesse de réaction est au-delà du niveau UK A – c’est un peu plus compliqué qu’une simple augmentation de la densité électronique du cycle.
L’effet de cette plus grande réactivité est que le méthylbenzène réagira avec l’acide sulfurique fumant à 0°C, et avec l’acide sulfurique concentré s’ils sont chauffés au reflux pendant environ 5 minutes.
En plus de l’effet sur la vitesse de réaction, avec le méthylbenzène, vous devez également penser à l’endroit où le groupe acide sulfonique se retrouve sur le cycle par rapport au groupe méthyle.
Les groupes méthyle ont tendance à « diriger & vers de nouveaux groupes dans les positions 2 et 4 du cycle (en supposant que le groupe méthyle est en position 1). On dit que les groupes méthyle sont 2,4-directeurs. L’origine de cet effet de direction est également au-delà du niveau A du Royaume-Uni.
Vous obtenez donc un mélange composé principalement de deux isomères. Seulement environ 5 à 10% de l’isomère 3 est formé.
Les réactions principales sont :
![]()
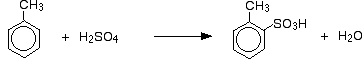
et:
![]()
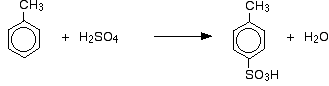
En cas de sulfonation, la proportion exacte des isomères formés dépend de la température de la réaction. À mesure que la température augmente, vous obtenez des proportions croissantes de l’isomère 4 et moins de l’isomère 2.
En effet, la sulfonation est réversible. Le groupe acide sulfonique peut à nouveau tomber de l’anneau et se rattacher ailleurs. Cela tend à favoriser la formation de l’isomère le plus stable thermodynamiquement. Cet échange se produit davantage à des températures plus élevées.
L’isomère 4 est plus stable car il n’y a pas d’encombrement dans la molécule comme il y en aurait si le groupe méthyle et le groupe acide sulfonique étaient voisins l’un de l’autre.
Oxydation de la chaîne latérale dans les alkylbenzènes
Un alkylbenzène est simplement un cycle benzénique auquel est attaché un groupe alkyle. Le méthylbenzène est l’alkylbenzène le plus simple.
Les groupes alkyles sont généralement assez résistants à l’oxydation. Cependant, lorsqu’ils sont attachés à un cycle benzénique, ils sont facilement oxydés par une solution alcaline de manganate de potassium (VII) (permanganate de potassium).
Le méthylbenzène est chauffé au reflux avec une solution de manganate de potassium (VII) alcalinisée avec du carbonate de sodium. La couleur pourpre du manganate de potassium (VII) est finalement remplacée par un précipité brun foncé d’oxyde de manganèse (IV).
Le mélange est finalement acidifié avec de l’acide sulfurique dilué.
Globalement, le méthylbenzène est oxydé en acide benzoïque.
![]()
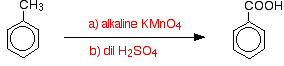
Il est intéressant de noter que tout groupe alkyle est oxydé en groupe a-COOH sur le cycle dans ces conditions. Ainsi, par exemple, le propylbenzène est également oxydé en acide benzoïque.
![]()