Qual è la causa di questa panuveite?
Una donna ispanica di 37 anni è arrivata al Los Angeles County Hospital / University of Southern California Emergency department lamentando una sensazione dolorosa, bruciore e arrossamento nell’occhio destro con visione sfocata. I sintomi sono iniziati due settimane prima e sono peggiorati fino a quando non ha sviluppato un mal di testa simile alla pressione.
Si lamentava della sensibilità alla luce e stava vivendo sudorazioni notturne, febbri e tosse. Ha negato la recente perdita di peso, cambiamenti nelle abitudini intestinali, dolore toracico, difficoltà respiratorie, eruzioni cutanee o cambiamenti nel sensorio. Ha detto che aveva una visione normale in entrambi gli occhi fin dall’infanzia fino a tre anni prima, quando aveva un episodio simile di dolorosa perdita della vista nell’occhio sinistro. Ricordava vagamente di usare un collirio all’epoca e aveva un’eventuale risoluzione dell’irritazione e del dolore, ma la conseguente scarsa visione in quell’occhio.
Storia
Oltre al dolore all’occhio destro, il paziente ha riportato dolore lungo tutta la gamba sinistra e la parte bassa della schiena per circa un anno. Ha riportato una storia di ipotiroidismo, dislipidemia e depressione, e ha anche notato periodi mestruali particolarmente pesanti. Non aveva alcun uso sistemico o attuale di farmaci oftalmici. La sua storia familiare era negativa. Ha negato l’uso di tabacco, alcol o droghe illecite. Era allergica all’iprofene.
Esame
Il paziente era leggermente sovrappeso e senza apparente sofferenza. BCVA era 20/200 + 1 OD e 20/200 + 1 OS. La pressione intraoculare era entro i limiti normali OU. Gli alunni erano 4 mm OD e 2,5 mm OS e la quantità di anisocoria era uguale sia nella luce che nel buio. Aveva una pupilla lentamente reattiva e un difetto pupillare afferente relativo (APD) OD, e una pupilla normalmente rotonda e reattiva OS. Luminosità senso OD era il 40 per cento del sistema operativo, e lei ha riferito rosso desaturazione OD. Non riusciva a vedere la piastra di colore Ishihara OD, ma ha identificato correttamente sei delle otto piastre OS. Non aveva dolore con il movimento degli occhi.
L’esame della lampada a fessura OD era significativo per l’iniezione congiuntivale diffusa accompagnata da precipitati cheratici diffusi e fini e 3+ cellule della camera anteriore. L’iride aveva sviluppato un filo fibrinoso lungo il margine pupillare, ma la lente era chiara. L’OS del segmento anteriore era insignificante senza evidenza di infiammazione precedente.
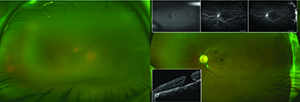
Un esame dilatato ha rivelato una visione nebulosa secondaria a cellule vitree pesanti, a volte in ciuffi, ma il nervo ottico è apparso rosa, acuto e ben perfuso. La macula appariva grossolanamente piatta, i vasi apparivano perfusi, ma non potevamo visualizzare adeguatamente la periferia. L’occhio sinistro non aveva cellule vitree, una testa del nervo ottico normalmente delimitata con un ciuffo fibroso che si estendeva nel vitreo e un foro maculare a tutto spessore che appariva cronico. I vasi OS erano leggermente attenuati e lontano nella periferia erano visibili bande contigue di fibrosi retinica (Figura 1).
Diagnosi, Workup, trattamento
Questa panuveite ha coinvolto un’ampia diagnosi differenziale e raccolta di sierologie autoimmuni e infettive (Riquadro, pagina 17). L’ecografia B-scan dell’occhio destro ha dimostrato opacità del vitreo e un profilo retinico piatto in tutti i quadranti. Angiogramma fluoresceina, mentre di scarsa qualità nell’occhio destro a causa di opacità media, ha mostrato colorazione periferica senza perdita progressiva dalla galleria venosa inferotemporale,
diminuita lontano temporale e nasale perfusione capillare e progressiva colorazione della ridgeline fibrotica temporalmente nell’occhio sinistro. La tomografia a coerenza ottica (OCT) non è stata in grado di catturare immagini nell’occhio interessato a causa dell’opacità del supporto, ma ha confermato un foro maculare a tutto spessore dello stadio 4 con una membrana epiretinica nell’occhio sinistro (Figura 2).
Abbiamo iniziato il suo topico prednisolone q1h e atropina OFFERTA per prevenire sinechia e trattare fotofobia. Accettò di tornare la mattina seguente, ma invece tornò due giorni dopo.
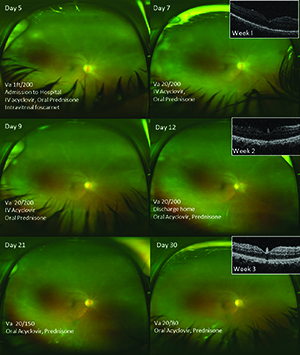
Alla seconda visita, la sua visione è rimasta stabile, ma la cellula anteriore era diminuita a 1+ con precipitati cheratici persistenti e diffusi. L’esame dilatato era abbastanza chiaro da rivelare piccole macchie bianche periferiche nelle periferie inferiori e temporali, suggestive di toxoplasmosi o sarcoidosi come possibile eziologia granulomatosa per la sua panuveite. L’esame emocromocitometrico completo precedentemente raccolto con differenziale era normale tranne che per una lieve anemia microcitica (in seguito elaborata e ritenuta dovuta a menorragia). La tubercolina PPD, la RPR sierica e gli anticorpi treponemici erano negativi e una radiografia del torace era normale.
Dopo aver discusso la possibile eziologia virale e i rischi del trattamento solo con la terapia steroidea, abbiamo prescritto acyclovir 800 mg PO cinque volte al giorno, iniziato prednisone orale (1 mg/kg) al giorno dopo 24 ore e seguito da vicino in attesa dei risultati di laboratorio rimanenti. Al follow-up tre giorni dopo, l’ANA (1: 80 maculato) e HSV-2 IgG sono stati significativamente elevati, mentre tutte le altre sierologie, tra cui Lyme, VZV IgM, HSV IgM e HSV-1 IgG, erano normali.
Abbiamo ordinato serologie VZV, ma i risultati sono stati ritardati. Il nostro sospetto di un’eziologia erpetica basata sui risultati del laboratorio stava crescendo. La migliore visione del fondo ha dimostrato uno sbiancamento retinico più evidente e una storia di un evento probabilmente simile ma risolto nell’occhio del compagno che ha portato alla diminuzione permanente della vista. L’abbiamo ricoverata per aciclovir per via endovenosa e abbiamo continuato il prednisone orale 40 mg al giorno. Abbiamo anche somministrato un’iniezione intravitreale di foscarnet.
La reazione a catena della polimerasi (PCR) di una paracentesi della camera anteriore eseguita il giorno del ricovero è risultata positiva al virus herpes simplex-2 (HSV-2). Abbiamo diagnosticato la panuveite secondaria a HSV-2 nell’occhio destro e una storia compatibile nell’occhio sinistro con conseguente foro maculare cronico secondario alla degenerazione vitrea.
Il paziente è stato tenuto in ospedale per una settimana di aciclovir per via endovenosa e ha ricevuto un’ulteriore iniezione di foscarnet il giorno 12. Il follow-up ha incluso la normale fotografia del fondo a 50° e widefield e l’imaging OCT (Figura 2) per il monitoraggio. Continua il follow-up in modo da poterla monitorare per lo sviluppo di necrosi retinica e distacco della retina.
Discussion
Differential Diagnosis of Panuveitis
Infectious
Viral
• HSV-1, HSV-2, CMV, VZV
Bacterial
• M. tuberculosis, B. hensleae, T. palladium
Parasitic
• Toxoplasmosis
Autoimmune/Inflammatory
Systemic lupus erythematosus
Granulomatous polyangitis
Vogt-Koyanagi-Harada
Panuveitis has many potential etiologies. In the absence of medical risk factors for immune system compromise, one must maintain a broad differential throughout the workup.
La panuveite virale e la retinite associata possono essere devastanti, specialmente se non trattate. Questa presentazione è unica data la storia del paziente di un episodio simile nell’occhio del compagno che si è risolto senza interventi ma ha provocato un foro maculare e una fibrosi retinica periferica.
Poiché la nostra paziente si presentava circa due settimane dopo l’insorgenza dei sintomi, aveva sviluppato un’impressionante panuveite granulomatosa. Qui, preferiamo descriverlo come una panuveite virale piuttosto che necrosi retinica acuta (ARN).
Tuttavia, queste entità probabilmente esistono su uno spettro.
I criteri diagnostici standard per ARN includono focolai multipli di necrosi retinica periferica, rapida progressione senza terapia, diffusione circonferenziale, vasculopatia arteriosa occlusiva con infiammazione prominente e, possibilmente, neuropatia ottica e sclerite dolorosa.1
Il nostro paziente ha dimostrato diversi focolai discreti di sbiancamento retinico con probabile diffusione circonferenziale precedente che non abbiamo potuto apprezzare appieno a causa di una significativa infiammazione nella camera anteriore e nel vitreo. Una volta che la vitrite si è liberata, la guaina arteriolare era ovvia.
Questo paziente ha anche dimostrato altri risultati caratteristici di ARN: un APD, ridotto senso di luminosità e desaturazione rossa. Sebbene abbia avuto sintomi per due settimane prima della sua visita, non ha avuto una rapida progressione di alcuna retinocoroidopatia, probabilmente grazie all’inizio della terapia.

Dr. Olmos, un assistente professore di oftalmologia presso l’Università della California del Sud Eye Institute e direttore del vitreo-borsa di studio presso la Keck School of Medicine della USC di Los Angeles.
Drs. Browne e Do sono residenti oftalmologia presso USC Eye Institute/Los Angeles County + programma USC. Dr. Rodger è un Heed e Ronald G. Michels Fellow in chirurgia vitreoretinica presso l’USC Eye Institute.
La valutazione PCR di fluidi intraoculari per HSV, VZV e CMV ha migliorato la nostra capacità di diagnosticare la panuveite virale e, in effetti, l’ARN, sebbene la mancanza di infiammazione possa anche aver contribuito a differenziare quest’ultima. Storicamente, l’ARN è stato associato a infezioni da VZV. Tuttavia, HSV-2 si verifica con una maggiore incidenza nei pazienti più giovani come il nostro, mentre VZV è più prominente nei pazienti più anziani.2
I processi uveitici richiedono un trattamento mirato. Nelle eziologie infettive, la terapia immunosoppressiva sistemica prematura può accelerare l’infezione, specialmente nella tubercolosi, nella sifilide o nelle entità virali. Un approccio sicuro prevede l’avvio di corticosteroidi topici per l’infiammazione della camera anteriore durante l’avvio di test di laboratorio con un follow-up ravvicinato.
Quando il sospetto clinico è elevato e un’eziologia virale è stata confermata, dovrebbe verificarsi un trattamento rapido e mirato costituito da antivirali sistemici e, di solito, intravitreali. Steroidi sistemici possono seguire subito dopo. La strategia di trattamento della panuveite HSV-2 è stata adottata da ARN.
I farmaci anti-erpetici includono agenti più vecchi come l’aciclovir e farmaci più recenti come il valaciclovir. L’aciclovir orale ha una biodisponibilità sistemica inferiore rispetto al valaciclovir, quindi il dosaggio di aciclovir per ARN è spesso di cinque-10 giorni IV prima di passare alla terapia orale cinque volte al giorno per un massimo di tre mesi, una pratica stabilita ben prima che fossero disponibili agenti orali ad alta biodisponibilità come valacyclovir.3 La terapia antivirale intravitreale e sistemica combinata è stata associata a migliori risultati visivi rispetto alla sola terapia sistemica.4,5 Anche dopo che un paziente inizia la terapia antivirale, il follow-up continuato è importante perché è nota l’esistenza di resistenza a più farmaci tra i virus dell’herpes.6
Conclusione
Una gestione efficace della panuveite richiede un’identificazione rapida e accurata dell’eziologia, perché il trattamento sbagliato può consentire alla malattia di progredire. La diagnosi differenziale deve essere ampia e includere eziologie infettive e autoimmuni, specialmente nei pazienti immunocompetenti. L’analisi fluida intraoculare notevolmente facilita la diagnosi ma può richiedere un certo tempo per produrre i risultati definitivi. Nelle prime fasi della valutazione, il contesto clinico e l’esame, con particolare attenzione allo stato immunitario e ai fattori di rischio, dovrebbero guidare la gestione. RS
2. Van Gelder RN, Willig JL, Holland JN, Kaplan HJ. Herpes simplex virus di tipo 2 come causa della sindrome da necrosi retinica acuta nei pazienti giovani. Oculistico. 2001;108:869–876.
3. I nostri servizi sono a vostra disposizione. Valaciclovir nel trattamento della necrosi retinica acuta. BMC Oftalmolo. 2012;12:48.
4. Flaxel CJ, Yeh S, Lauer AJ. Terapia antivirale sistemica e intravitreale combinata nella gestione della sindrome da necrosi retinica acuta (tesi della American Ophthalmological Society). Trans Am Ophthalmol Soc. 2013;111:133-144.
5. I nostri servizi Terapia antivirale sistemica e intravitreale combinata nella gestione della sindrome da necrosi retinica acuta. Ophthalm Surg Laser Imaging Retina. 2014;45:399-407.
6. Dokey AT, Haug SJ, McDonald HR, et al. Necrosi retinica acuta servizio militare della guyana a virus herpes semplice multiresistente 2 in un adolescente immunocompetente. Retin Cases Brief Rep, 2014;8:260-264.