Cellule Gliali della Retina di Helga Kolb
Helga Kolb
Tre tipi fondamentali di cellule gliali si trovano nella retina umana, cellule di Muller, astroglia e microglia. Tutti sono stati descritti per la retina da Cajal più di cento anni fa (1892).
1. Cellule Muller.
Le cellule di Muller sono la principale cellula gliale della retina. Formano strutture di supporto architettonico che si estendono radialmente attraverso lo spessore della retina e sono rispettivamente i limiti della retina alla membrana limitante esterna e interna. Una comprensione completa della forma di una cellula di Muller si vede meglio dopo la colorazione di Golgi come mostrato originariamente da Cajal (1892) di seguito.
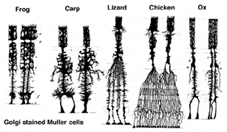
Fig. 1. Cellule di Muller macchiate di Golgi
I corpi cellulari di Muller siedono nello strato nucleare interno e proiettano processi irregolari spessi e sottili in entrambe le direzioni verso la membrana limitante esterna e verso la membrana limitante interna. I processi cellulari di Muller si insinuano tra i corpi cellulari dei neuroni negli strati nucleari e i gruppi di inviluppo dei processi neurali negli strati plessiformi (Fig. 1). Infatti i processi neurali retinici sono consentiti solo il contatto diretto, senza avvolgere i processi cellulari di Muller, alle loro sinapsi.
Una singola cellula progenitrice dà origine sia alle cellule di Muller che ai neuroni della retina(Turner e Cepko, 1987) sebbene apparentemente in due fasi. I primi neuroni di fase nati sul margine apicale del neuroepitelio adiacente all’epitelio pigmentato producono neuroni primari costituiti da cellule coniche, cellule orizzontali e cellule gangliari (Fig. 2, a destra). La seconda fase delle cellule nate anche ai margini apicali produce cellule di Muller e fotorecettori a bastoncello, cellule bipolari e cellule amacrine (Reichenbach e Robinson, 1995) (Fig. 2, a sinistra). Tutti i neuroni in via di sviluppo e le cellule di Muller devono migrare verso l’interno nella loro posizione finale e si pensa che i processi e i tronchi delle cellule di Muller guidino gran parte delle migrazioni dei neuroni e dirigano le differenziazioni dei neuriti.
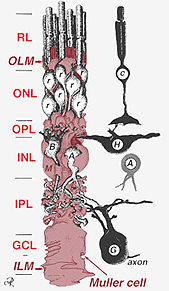
Fig. 2. 3-D disegno schematico della relazione tra la cellula di Muller e altri neuroni retinici
Le giunzioni che formano la membrana limitante esterna sono tra le cellule di Muller e altre cellule di Muller e le cellule fotorecettori come desmosomi robusti o zonula adherens. In alcune specie giunzioni gap (associazioni di membrane specializzate e canali che consentono il passaggio di piccole molecole e ioni) o giunzioni strette fanno parte di queste giunzioni di cellule Muller (Miller e Dowling, 1970) ma non così nelle specie di mammiferi in cui non è mai stato osservato alcun accoppiamento colorante (Robinson et al., 1993; Reichenbach e Robinson, 1995). La superficie della cellula di Muller rivolta verso l’epitelio pigmentato e lo spazio subretinale è espansa da molte proiezioni della membrana cellulare di Muller note come villi apicali. La membrana limitante interna, d’altra parte, è formata dall’estremità conica della cellula di Muller, ma qui non si vedono giunzioni specializzate. Le cellule di Muller formano anche endfeet sui grandi vasi sanguigni della retina sulla superficie interna della retina. La superficie della membrana cellulare di Muller rivolta verso il vitreo è ricoperta da un materiale mucopolisaccaridico e quindi forma una vera membrana basale.
Le cellule di Muller contengono glicogeno, mitocondri e filamenti intermedi che sono immunoreativi per la vimentina e in una certa misura per la proteina acidica fibrillare gliale (GFAP). Questi ultimi filamenti sono normalmente nella metà interna delle cellule di Muller retinico e il loro endfeet (Fig. 3, a sinistra), ma a seguito di traumi alla retina come il distacco della retina, sia la vimentina che il GFAP sono massicciamente sovraregolati e trovati in tutta la cellula (Fig. 3, a destra) (Guerin et al., 1990; Fisher e Lewis, 1995).
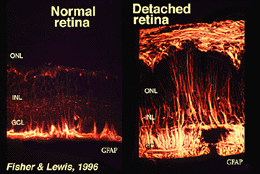
Fig. 3. Immunoreattività GFAP nelle cellule di Muller
Le cellule di Muller hanno una gamma di funzioni tutte vitali per la salute dei neuroni retinici. Le cellule di Muller funzionano in una relazione simbiotica con i neuroni (per una revisione eccellente vedi Reichenbach e Robinson, 1995). Così le funzioni delle cellule di Muller includono:
- Fornitura di prodotti finali del metabolismo anaerobico (ripartizione del glicogeno) per alimentare il metabolismo aerobico nelle cellule nervose.
- Assorbono i prodotti di scarto neurali come l’anidride carbonica e l’ammoniaca e riciclano i trasmettitori di aminoacidi spesi.
- Proteggono i neuroni dall’esposizione a neurotrasmettitori in eccesso come il glutammato usando meccanismi di assorbimento ben sviluppati per riciclare questo trasmettitore. Sono particolarmente caratterizzati dalla presenza di alte concentrazioni di glutammina sintasi.
- Possono essere coinvolti sia nella fagocitosi dei detriti neuronali che nel rilascio di sostanze neuroattive come GABA, taurina e dopamina.
- Si pensa che sintetizzino l’acido retinoico dal retinolo (l’acido retinoico è noto per essere importante nello sviluppo dell’occhio e del sistema nervoso) (Edwards, 1994)
- Controllano l’omeostasi e proteggono i neuroni dai cambiamenti deleteri nel loro ambiente ionico assorbendo il K+ extracellulare e ridistribuendolo.
- Contribuiscono alla generazione dell’elettroretinogramma (ERG) b-wave (Miller e Dowling, 1970; Newman e Odette, 1984), della componente P3 lenta dell’ERG (Karwoski e Proenza, 1977) e della risposta scotopica alla soglia (STR) (Frishman e Steinberg, 1989). Lo fanno regolando la distribuzione di K + attraverso il bordo vitreo della retina, attraverso l’intera retina e localmente nello strato plessiforme interno della retina (Fig. 4, da Reichenbach e Robinson, 1995, adattato da Newman, 1989).

Fig. 4. Regolazione di K + da parte delle cellule di Muller in cellule di Muller
2. Astrociti.
Gli astrociti non sono cellule gliali del neuroepitelio retinico ma entrano nella retina in via di sviluppo dal cervello lungo il nervo ottico in via di sviluppo (Stone e Dreher, 1987; Chan-Ling 1994). Hanno una morfologia caratteristica di un corpo cellulare appiattito e una serie fibrosa di processi radianti. I filamenti intermedi riempiono i loro processi e quindi si macchiano drammaticamente con anticorpi contro GFAP (Schnitzer, 1988). I corpi e i processi delle cellule dell’astrocita sono quasi interamente limitati allo strato della fibra nervosa della retina. La loro morfologia cambia dalla periferia alla testa del nervo ottico: da una forma simmetrica stellata nella retina periferica (Fig. 5a e b) (Schitzer, 1988) a estremamente allungato vicino al nervo ottico (Fig. 6 e 7).
 Fig. 5a. Astrociti nella retina periferica. Schnitzer, 1988 |
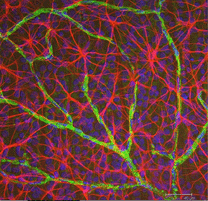 Fig. 5 ter. Astrociti (rosso) nella retina di ratto tra le cellule gangliari (blu) e associati ai vasi sanguigni (verde). Per gentile concessione di Laura Fernandez-Sanchez e Nicolas Cuenca |
Nella colorazione immunocitochimica (Fig. 5b) e nelle iniezioni intracellulari di HRP (Fig. 7) gli astrociti colorati mostrano chiaramente processi allineati lungo gli assoni delle cellule gangliari che attraversano lo strato di fibre nervose. Nella distribuzione, gli astrociti raggiungono il loro picco sulla testa del nervo ottico e hanno un declino abbastanza uniforme della densità negli anelli radianti dalla testa del nervo. Non sono presenti nella fovea avascolare o ora serrata.
 Fig. 6. Astrociti nella retina centrale. Schnitzer, 1988 |
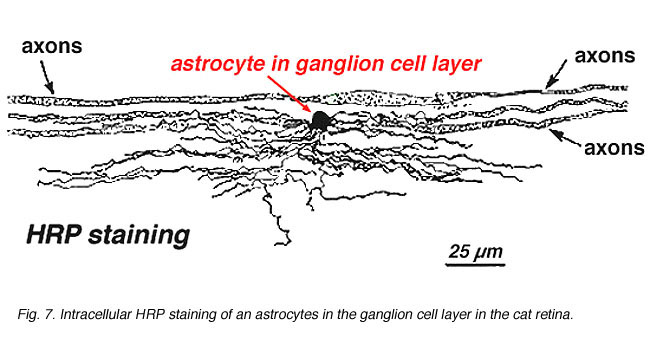 Fig. 7. Astrociti nella retina del gatto macchiati dall’iniezione intracellulare di HRP. Per gentile concessione di Ralph Nelson. |
Gli astrociti spessi e sottili sono stati distinti sulla base della colorazione con anticorpi contro GFAP (Trevino et al., 1996). Così gli astrociti sono disposti sulla superficie dei fasci di assoni delle cellule gangliari mentre scorrono nella testa del nervo ottico formando un tubo attraverso il quale corrono gli assoni (Fig. 8). Giunzioni gap e giunzioni zonula adherens sono state descritte tra processi astrocitici nella retina del gatto (Höllander et al., 1991).
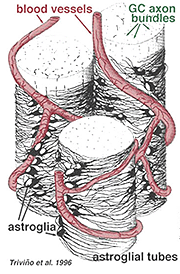
Fig. 8. Blocco 3-D di astrociti disposti sulla superficie dei fasci di assoni delle cellule gangliari
I vasi sanguigni che corrono dentro e tra i fasci di cellule gangliari sono anche coperti da entrambi i processi e persino da un corpo cellulare occasionale di un astrocita. La funzione degli astrociti che avvolgono gli assoni delle cellule gangliari e la relazione con i vasi sanguigni dello strato di fibre nervose suggerisce che sono guaine gliali assonali e vascolari e parte di una barriera emato-encefalica. Simili alle cellule di Muller, sono noti per contenere abbondante glicogeno e possono formare un servizio nutritivo nel fornire glucosio ai neuroni. Inoltre, probabilmente svolgono un ruolo nell’omeostasi ionica nella regolazione dei livelli di potassio extracellulare e del metabolismo dei neurotrasmettitori come il GABA.
3. Cellule microgliali.
Il terzo tipo di cellule gliali è presumibilmente di origine mesodermica e quindi, in senso stretto, non sono neurogliali come lo sono gli astrociti e le cellule di Muller. Entrano nella retina in coincidenza con i precursori mesenchimali dei vasi sanguigni retinici in sviluppo (Chan-Ling, 1994). Le cellule microgliali sono onnipresenti nella retina umana trovandosi in ogni strato della retina.
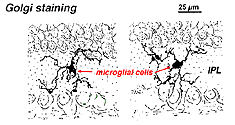
Nella retina macchiata di Golgi sembrano strane forme multipolari con piccoli corpi cellulari e processi brevi irregolari. In effetti, nei preparati di Golgi a volte sono stati scambiati per cellule nervose, in particolare quando si trovano in uno strato nucleare con un unico orientamento dei loro processi nello strato plessiforme.
Fig. 9. La colorazione di Golgi delle cellule microgliali
Le cellule microgliali possono essere di due tipi. Si pensa che una forma entri nella retina nelle prime fasi dello sviluppo dal mesenchima del nervo ottico e si trovi dormiente negli strati retinici per gran parte della vita della retina. L’altra forma di microglia sembra essere cellule trasmesse dal sangue, possibili originate da periciti vascolari (Boycott e Hopkins, 1981; Gallego, 1986). Entrambi i tipi possono essere stimolati in una funzione macrofagica dopo un trauma alla retina, e quindi si impegnano nella fagocitosi dei neuroni retinici degeneranti.

Fig. 10 bis. Cellula microgliale macchiata di lectina da Chan-Lin, 1994.
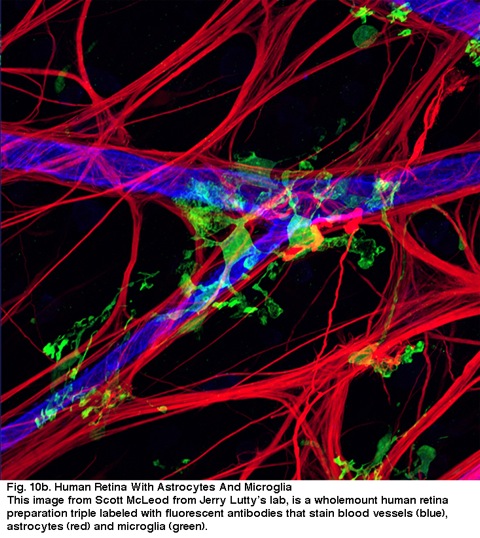
Fig. 10b. Retina umana con astrociti e Microglia. Questa immagine da Scott McLeod dal laboratorio di Jerry Lutty, è una preparazione retina umana wholemount tripla laneled con anticorpi fluorescenti che macchiano i vasi sanguigni (blu), astrociti (rosso) e microglia (verde).
4. Riferimento.
Boicottare BB, Hopkins JM. Microglia nella retina della scimmia e di altri mammiferi; la sua distinzione da altri tipi di cellule glia e orizzontali. Neuroscienza.1981;6:679–688.
Cajal SR. In: Thorpe SA, Glickstein M, traduttori. 1892. La struttura della retina. Springfield (IL): Thomas; 1972.
Interazioni gliali, neuronali e vascolari nella retina dei mammiferi. Prog. Ret. Occhio Res. 1994;13:357-389.
Edwards RB. Biosintesi dell’acido retinoico da parte delle cellule gliali di Müller: un modello per il sistema nervoso centrale? Prog. Ret. Occhio Res. 1994;13:231-242.
Fisher SK, Lewis GP. Fotorecettori e non solo: effetti cellulari e molecolari del distacco della retina.2 ° Great Basin Visual Science Symposium, II, University of Utah Press. 1995
Frishman LJ, Steinberg RH. Luce-evocato aumenta in o nella porzione prossimale della retina gatto scuro-adattato. J Neurofisiolo. 1989;61:1233–1243.
Gallego A. Studi comparativi sulle cellule orizzontali e una nota sulle cellule microgliali. Prog. Ret. Res. 1986;5:165-206.
Guerin CJ, Anderson DH, Fisher SK. Cambiamenti nell’immunolabeling del filamento intermedio si verificano in risposta al distacco e al riattacco della retina nei primati.Investire. Ophthal. Vis. Sic. 1990;31:1474–1482.
Karwoski CJ, Proenza LM. Relazione tra le risposte delle cellule di Muller, un potenziale transretinico locale e il flusso di potassio. J Neurofisiolo. 1977;40:244–259.
Miller RF, Dowling JE. Risposte intracellulari delle cellule Muller (gliali) della retina mudpuppy: la loro relazione con l’onda b dell’elettroretinogramma. J Neurofisiolo.1970;33:323–341.
Newman EA, Odette II. Modello di elettroretinogramma generazione di onde b: un test dell’ipotesi K+. J Neurofisiolo. 1984;51:164–182.
Newman EA. Elettrofisiologia delle cellule gliali retiniche. Prog. Ret. Res. 1989;8:153-172.
Reichenbach A, Robinson SR. Il coinvolgimento delle cellule di Müller nella retina esterna. In: Djamgoz MBA, Archer SN, Vallerga S, editori. Neurobiologia e aspetti clinici della retina esterna. Londra: Chapman& Hall; 1995. pag. 395-416.
Robinson SR, Hampson ECGM, Munro MN, Vaney DI. Accoppiamento unidirezionale di giunzioni gap tra neuroglia. Proc. Austr. Neurosci. Soc. 1993;3:167.
Schnitzer J. Astrociti nella retina dei mammiferi. Prog. Ret. Res. 1988;7:209-232.
Stone J, Makarov F, Hollander H. L’ensheathment gliale della collinetta soma e assone delle cellule gangliari retiniche. Vis Neurosci. 12:273–279.
Stone J, Dreher Z. Relazione tra astrociti, cellule gangliari e vascolarizzazione della retina. J Comp Neurol. 1987;255:35–49.
Trivino A, Ramirez JM, Salazar JJ, Ramirez AI, Garcia-Sanchez J. Studio immunoistochimico della testa del nervo ottico umano astroglia. Visione Res. 1996;36:2015-2028.
Turner DL, Cepko CL. Un progenitore comune per i neuroni e la glia persiste nella retina del ratto in ritardo nello sviluppo. Natura. 1987;328:131–136.