gliaceller af nethinden af Helga Kolb
Helga Kolb
tre grundlæggende typer gliaceller findes i den humane nethinden, Muller celler, astroglia og microglia. Alle blev beskrevet for nethinden af Cajal for mere end hundrede år siden (1892).
1. Muller celler.
Muller-celler er den vigtigste gliacelle i nethinden. De danner arkitektoniske støttestrukturer, der strækker sig radialt over tykkelsen af nethinden og er grænserne for nethinden ved henholdsvis den ydre og den indre begrænsende membran. En fuldstændig forståelse af formen på en Muller-celle ses bedst efter Golgi-farvning som vist oprindeligt af Cajal (1892) nedenfor.
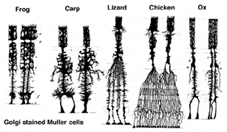
Fig. 1. Golgi farvede Muller celler
Muller cellelegemer sidder i det indre nukleare lag og projicerer uregelmæssigt tykke og tynde processer i begge retninger til den ydre begrænsende membran og til den indre begrænsende membran. Muller-celleprocesser insinuerer sig mellem cellelegemer i neuronerne i de nukleare lag og konvolutgrupper af neurale processer i de pleksiforme lag (Fig. 1). Faktisk er retinale neurale processer kun tilladt direkte kontakt, uden at omslutte Muller celleprocesser, ved deres synapser.
en enkelt stamcelle giver anledning til både Muller-celler og retinale neuroner(Turner og Cepko, 1987), selvom det tilsyneladende er i to faser. De tidligste fase neuroner født ved den apikale kant af neuroepitelet ved siden af pigmentepitelet producerer primære neuroner bestående af kegleceller, vandrette celler og ganglionceller (Fig. 2, højre). Den anden fase af celler, der også er født ved de apikale margener, producerer Mullerceller og stangfotoreceptorer, bipolære celler og amacrine celler (Reichenbach og Robinson, 1995) (Fig. 2, venstre). Alle de udviklende neuroner og Muller-cellerne skal migrere indad til deres endelige position, og det antages, at Muller-celleprocesserne og trunkerne styrer meget af neuronvandringerne og styrer neuritdifferentieringerne.
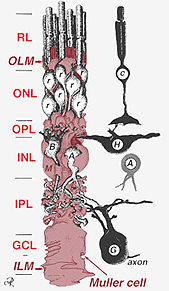
Fig. 2. 3 – D skematisk tegning af forholdet mellem Muller-celle og andre retinale neuroner
krydsene, der danner den ydre begrænsende membran, er mellem Muller-celler og andre Muller-celler og fotoreceptorceller som robuste desmosomer eller sonula adherens. I nogle arter er gap-kryds (specialiserede membranforeninger og kanaler, der tillader passage af små molekyler og ioner) eller stramme kryds en del af disse Muller-cellekryds (Miller og dyvling, 1970), men ikke så i pattedyrarter, hvor der aldrig er observeret nogen farvestofkobling (Robinson et al., 1993; Reichenbach og Robinson, 1995). Overfladen af Muller-cellen, der vender mod pigmentepitelet og det subretinale rum, udvides af mange fremspring af Muller-cellemembranen kendt som apikale villi. Den indre begrænsende membran er derimod dannet af Mullercellens koniske endefødder, men der ses ingen specialiserede Kryds her. Muller-celler danner også endefødder på de store nethindeblodkar på den indre overflade af nethinden. Overfladen af Muller-cellemembranen, der vender mod glaslegemet, er dækket med et mucopolysaccharidmateriale og danner således en ægte kældermembran.
Mullerceller indeholder glykogen, mitokondrier og mellemliggende filamenter, som er immunoreative for vimentin og til en vis grad til glialfibrillært syreholdigt protein (GFAP). Sidstnævnte filamenter er normalt i den indre halvdel af nethindemullercellerne og deres endefødder (Fig. 3, venstre), men efter traumer på nethinden, såsom nethindeløsning, opreguleres både vimentin og GFAP massivt og findes i hele cellen (Fig. 3, højre) (Guerin et al., 1990, 1995.
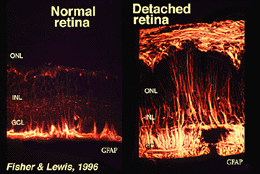
Fig. 3. GFAP-immunoreaktivitet i Muller-celler
Muller-celler har en række funktioner, som alle er afgørende for retinalneurons sundhed. Muller-celler fungerer i et symbiotisk forhold til neuronerne (for en fremragende gennemgang se Reichenbach og Robinson, 1995). Muller cellefunktioner omfatter således:
- levering af slutprodukter af anaerob metabolisme (nedbrydning af glykogen) til brændstof aerob metabolisme i nervecellerne.
- de Mopper op neurale affaldsprodukter som kulsyre og ammoniak og genbruger brugte aminosyresendere.
- de beskytter neuroner mod eksponering for overskydende neurotransmittere såsom glutamat ved hjælp af veludviklede optagelsesmekanismer til at genbruge denne sender. De er især kendetegnet ved tilstedeværelsen af høje koncentrationer af glutaminsyntase.
- de kan være involveret i både fagocytose af neuronalt affald og frigivelse af neuroaktive stoffer som GABA, taurin og dopamin.
- de menes at syntetisere retinsyre fra retinol (retinsyre er kendt for at være vigtig i udviklingen af øjet og nervesystemet) (Edvard, 1994)
- de kontrollerer homeostase og beskytter neuroner mod skadelige ændringer i deres ioniske miljø ved at optage ekstracellulær K+ og omfordele det.
- de bidrager til genereringen af elektroretinogrammet (erg) b-bølge (Miller og dyvling, 1970; Nyman og Odette, 1984), den langsomme P3-komponent i ERG (Karoski og Proensa, 1977) og scotopic threshold response (str) (Frishman og Steinberg, 1989). De gør det ved regulering af K+ – fordeling over den nethindeglasagtige grænse, over hele nethinden og lokalt i det indre pleksiforme lag af nethinden (Fig. 4, fra Reichenbach og Robinson, 1995, tilpasset fra Nymand, 1989).

Fig. 4. Regulering af K+ af Muller celler i Muller celler
2. Astrocytter.
astrocytter er ikke gliaceller i retinal neuroepithelium, men kommer ind i den udviklende nethinden fra hjernen langs den udviklende optiske nerve (Stone and Dreher, 1987; Chan-Ling 1994). De har en karakteristisk morfologi af en flad cellelegeme og en fibrøs række udstrålende processer. Mellemliggende filamenter fylder deres processer, og dermed pletter de dramatisk med antistoffer mod GFAP (Schnitser, 1988). Astrocytcellelegemer og processer er næsten udelukkende begrænset til nervefiberlaget i nethinden. Deres morfologi ændres fra periferien til det optiske nervehoved: fra en symmetrisk stellatform i perifer nethinden (Fig. 5a og b) (Schits, 1988) til ekstremt langstrakt nær synsnerven (Fig. 6 og 7).
 Fig. 5a. astrocytter i perifer nethinden. 1988 |
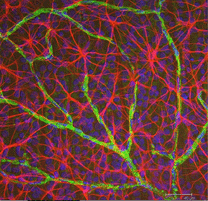 Fig. 5b. Astrocytter (rød) i rotte nethinden blandt ganglionceller (blå) og forbundet med blodkar (grøn). Og Nicolas Cuenca |
i immunocytokemisk farvning (Fig. 5b) og i HRP intracellulære injektioner (Fig. 7) farvede astrocytter udviser tydeligt processer, der er justeret langs ganglioncelleaksonerne, der løber gennem nervefiberlaget. Ved distribution når astrocytter deres højdepunkt på det optiske nervehoved og har et ret ensartet fald i densitet i udstrålende ringe fra nervehovedet. De er ikke til stede i avaskulær fovea eller ora serrata.
 Fig. 6. Astrocytter i det centrale nethinden. 1988 |
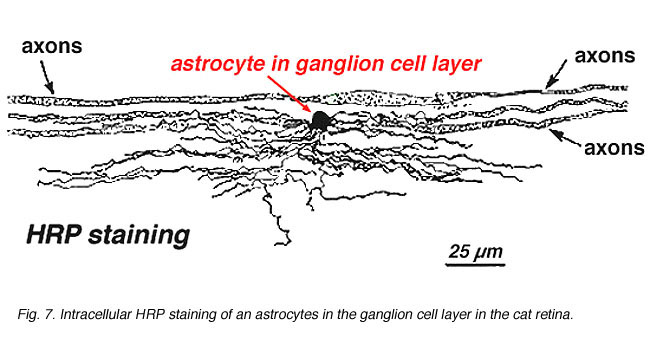 Fig. 7. Astrocytter i kattehinde farvet ved intracellulær injektion af HRP. Med tilladelse fra Ralph Nelson. |
tykke og tynde astrocytter er blevet kendetegnet på basis af farvning med antistoffer mod GFAP (Trevino et al., 1996). Således er astrocytter anbragt over overfladen af ganglioncelleaksonbundterne, når de går ind i synsnervehovedet og danner et rør, gennem hvilket aksonerne løber (Fig. 8). Der er blevet beskrevet mellem astrocytiske processer i cat retina(H., 1991).
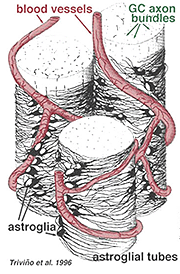
Fig. 8. 3-D-blok af astrocytter arrangeret over overfladen af ganglioncelleaksonbundter
blodkarrene, der løber ind og blandt ganglioncellebundterne, er også dækket af begge processer og endda en lejlighedsvis cellelegeme af en astrocyt. Funktionen af astrocytter, der omslutter ganglioncelleaksoner og forholdet til blodkar i nervefiberlaget antyder, at de er aksonale og vaskulære glialskeder og en del af en blod-hjerne-barriere. I lighed med Muller-celler er de kendt for at indeholde rigeligt glykogen, og de kan danne en næringstjeneste til at levere glukose til neuronerne. Derudover tjener de sandsynligvis en rolle i ionisk homeostase i regulering af ekstracellulære kaliumniveauer og metabolisme af neurotransmittere som GABA.
3. Mikrogliale celler.
den tredje gliacelletype er angiveligt af mesodermal oprindelse og er således strengt taget ikke neuroglial, ligesom astrocytter og Muller-celler. De kommer ind i nethinden sammenfaldende med de mesenkymale forstadier af retinale blodkar under udvikling (Chan-Ling, 1994). Mikroglialceller er allestedsnærværende i den menneskelige nethinde, der findes i hvert lag af nethinden.
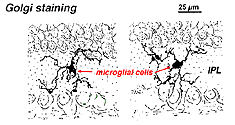
i Golgi-farvet nethinden ser de ud som mærkelige, multipolære former med småcellelegemer og uregelmæssige korte processer. Faktisk er de i Golgi-præparater undertiden blevet forvekslet med nerveceller, især når de ligger i et nukleart lag med en enkelt orientering af deres processer i det pleksiforme lag.
Fig. 9. Golgi-farvning af mikroglialceller
mikroglialceller kan være af to typer. En form menes at komme ind i nethinden i tidlige udviklingsstadier fra synsnerven mesenchyme og ligge i dvale i nethindelagene i store dele af nethindens liv. Den anden form for mikroglia ser ud til at være blodbårne celler, der muligvis stammer fra skibspericytter (boykot og Hopkins, 1981; Gallego, 1986). Begge typer kan stimuleres til en makrofagisk funktion efter traume til nethinden, og derefter deltager de i fagocytose af degenererende retinale neuroner.

Fig. 10a. Lectin-farvet mikroglialcelle fra Chan-Lin, 1994.
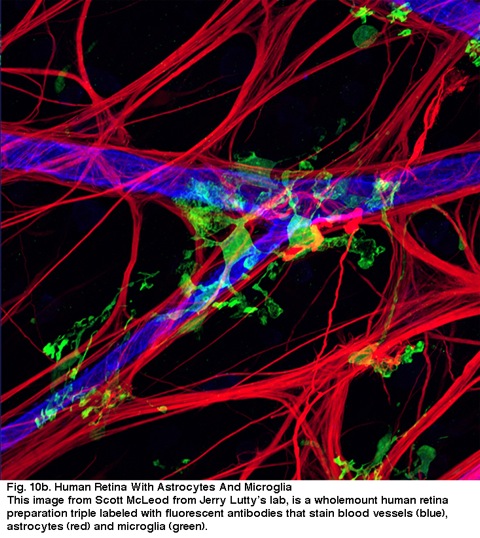
Fig. 10b. human nethinde med astrocytter og mikroglia. Dette billede fra Scott McLeod fra Jerry Lutty ‘ s lab, er et helstøbt humant nethindepræparat triple laneled med fluorescerende antistoffer, der pletter blodkar (blå), astrocytter (rød) og microglia (grøn).
4. Reference.
boykot BB, Hopkins JM. Microglia i nethinden hos abe og andre pattedyr; dens skelnen fra andre typer glia og vandrette celler. Neurovidenskab.1981;6:679–688.
Cajal SR. In: Thorpe SA, Glickstein M, oversættere. 1892. Strukturen af nethinden. Springfield (IL): Thomas; 1972.Chan-Ling T. Glial, neuronal og vaskulær interaktion i pattedyrs nethinde. Prog. Ret. Øje Res. 1994; 13:357-389.
RB. Biosyntese af retinsyre af M-Lartller gliaceller: en model for centralnervesystemet? Prog. Ret. Øje Res. 1994; 13:231-242.
Fisher SK. Fotoreceptorer og videre: cellulære og molekylære virkninger af nethindeløsning.2. Great Basin Visual Science Symposium, II, University of Utah Press. 1995
Frishman LJ, Steinberg RH. Lys-fremkaldte stigninger i o I proksimal del af den mørke-tilpasset kat nethinden. J Neurofysiol. 1989;61:1233–1243.
Gallego A. sammenlignende undersøgelser af vandrette celler og en note om mikroglialceller. Prog. Ret. Res. 1986; 5: 165-206.Guerin CJ, Anderson DH, Fisher SK. Ændringer i mellemliggende filamentimmunmærkning forekommer som reaktion på nethindeløsning og genmontering i primater.Investere. Ophthal. Vis. Sci. 1990;31:1474–1482.
CJ, lm. Forholdet mellem Muller celleresponser, et lokalt transretinalt potentiale og kaliumstrøm. J Neurofysiol. 1977;40:244–259.
Miller RF, dyvling JE. Intracellulære reaktioner af Muller (glial) celler i mudpuppy nethinden: deres forhold til B-bølge af elektroretinogrammet. J Neurofysiol.1970;33:323–341.
Nymand EA, Odette LL. Model af electroretinogram B-bølgegenerering: en test af K+ – hypotesen. J Neurofysiol. 1984;51:164–182.
Nymand EA. Elektrofysiologi af retinale gliaceller. Prog. Ret. Res. 1989; 8: 153-172.Reichenbach A, Robinson SR. Involveringen af M-Larrller-celler i den ydre nethinde. I: DJAMGO MBA, Archer SN, Vallerga S, redaktører. Neurobiologi og kliniske aspekter af den ydre nethinde. London: Chapman & Hal; 1995. s. 395-416.
Robinson SR, Hampson ECGM, Munro MN, Vaney di. Envejs kobling af mellemrumskryds mellem neuroglia. Proc. Austr. Neurosci. Soc. 1993;3:167.astrocytter i pattedyrs nethinde. Prog. Ret. Res. 1988; 7: 209-232.
sten J, Makarov F, Hollander H. glial ensheathment af Soma og akson hillock af retinale ganglionceller. Vis Neurosci. 12:273–279.
sten J, Dreher S. forholdet mellem astrocytter, ganglionceller og vaskulatur af nethinden. J Comp Neurol. 1987;255:35–49.
Trivino A, Ramires JM, Salasar JJ, Ramires AI, Garcia-Sanches J. immunhistokemisk undersøgelse af humant synsnervehoved astroglia. Vision Res. 1996; 36: 2015-2028. Turner DL, Cepko CL. En fælles stamfader til neuroner og glia fortsætter i rotte nethinden sent i udvikling. Natur. 1987;328:131–136.