Gliazellen der Netzhaut von Helga Kolb
Helga Kolb
In der menschlichen Netzhaut finden sich drei Grundtypen von Gliazellen, Müllerzellen, Astroglia und Mikroglia. Alle wurden vor mehr als hundert Jahren (1892) von Cajal für die Netzhaut beschrieben.
1. Muller-Zellen.
Muller-Zellen sind die wichtigsten Gliazellen der Netzhaut. Sie bilden architektonische Stützstrukturen, die sich radial über die Dicke der Netzhaut erstrecken und die Grenzen der Netzhaut an der äußeren bzw. inneren Begrenzungsmembran darstellen. Ein vollständiges Verständnis der Form einer Muller-Zelle ist am besten nach Golgi-Färbung zu sehen, wie ursprünglich von Cajal (1892) unten gezeigt.
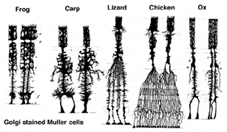
Abb. 1. Golgi-gefärbte Muller-Zellen
Muller-Zellkörper sitzen in der inneren Kernschicht und projizieren unregelmäßig dicke und dünne Prozesse in beide Richtungen zur äußeren Begrenzungsmembran und zur inneren Begrenzungsmembran. Muller-Zellprozesse unterstellen sich zwischen Zellkörpern der Neuronen in den Kernschichten und Hüllgruppen neuronaler Prozesse in den plexiformen Schichten (Abb. 1). Tatsächlich dürfen neuronale Prozesse der Netzhaut nur direkten Kontakt mit ihren Synapsen haben, ohne Muller-Zellprozesse zu umhüllen.
Eine einzelne Vorläuferzelle führt sowohl zu Muller-Zellen als auch zu Netzhautneuronen(Turner und Cepko, 1987), obwohl anscheinend in zwei Phasen. Die frühesten Phasenneuronen, die am apikalen Rand des Neuroepithels neben dem Pigmentepithel geboren wurden, produzieren primäre Neuronen, die aus Kegelzellen, horizontalen Zellen und Ganglienzellen bestehen (Abb. 2, rechts). Die zweite Phase von Zellen, die ebenfalls am apikalen Rand geboren wurden, produziert Müller-Zellen und Stab-Photorezeptoren, bipolare Zellen und amakrine Zellen (Reichenbach und Robinson, 1995) (Abb. 2, links). Alle sich entwickelnden Neuronen und die Muller-Zellen müssen nach innen in ihre endgültige Position wandern, und es wird angenommen, dass die Muller-Zellprozesse und -stämme einen Großteil der Neuronenmigrationen leiten und die Neuritendifferenzierungen lenken.
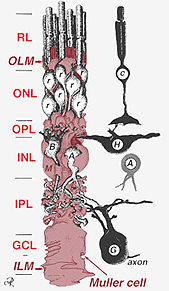
Abb. 2. 3-D schematische Darstellung der Beziehung zwischen Muller-Zelle und anderen Netzhautneuronen
Die Verbindungen, die die äußere Begrenzungsmembran bilden, befinden sich zwischen Muller-Zellen und anderen Muller-Zellen und Photorezeptorzellen als robuste Desmosomen oder Zonula-Adherens. Bei einigen Arten sind Gap Junctions (spezialisierte Membranassoziationen und Kanäle, die den Durchgang kleiner Moleküle und Ionen ermöglichen) oder Tight Junctions Teil dieser Muller-Zellübergänge (Miller und Dowling, 1970), nicht jedoch bei Säugetierarten, bei denen keine Farbstoffkopplung beobachtet wurde (Robinson et al., 1993; Reichenbach und Robinson, 1995). Die Oberfläche der Muller-Zelle, die dem Pigmentepithel und dem subretinalen Raum zugewandt ist, wird durch viele Projektionen der Muller-Zellmembran, die als apikale Zotten bekannt sind, erweitert. Die innere Begrenzungsmembran hingegen wird durch die konischen Endfüße der Muller-Zelle gebildet, aber hier sind keine spezialisierten Übergänge zu sehen. Muller-Zellen bilden auch Endfüße auf den großen Netzhautblutgefäßen an der inneren Oberfläche der Netzhaut. Die dem Glaskörper zugewandte Oberfläche der Mullerzellmembran ist mit einem Mucopolysaccharidmaterial bedeckt und bildet somit eine echte Basalmembran.
Muller-Zellen enthalten Glykogen, Mitochondrien und Zwischenfilamente, die für Vimentin und in gewissem Maße für gliales fibrilläres Säureprotein (GFAP) immunreativ sind. Letztere Filamente befinden sich normalerweise in der inneren Hälfte der retinalen Mullerzellen und deren Endfüßen (Abb. 3, links), aber nach einem Trauma der Netzhaut wie Netzhautablösung werden sowohl Vimentin als auch GFAP massiv hochreguliert und in der gesamten Zelle gefunden (Abb. 3, rechts) (Guerin et al., 1990; Fisher und Lewis, 1995).
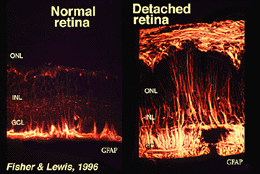
Abb. 3. GFAP-Immunreaktivität in Mullerzellen
Mullerzellen haben eine Reihe von Funktionen, die alle für die Gesundheit der Netzhautneuronen von entscheidender Bedeutung sind. Muller-Zellen funktionieren in einer symbiotischen Beziehung mit den Neuronen (für eine ausgezeichnete Übersicht siehe Reichenbach und Robinson, 1995). Zu den Muller-Zellfunktionen gehören daher:
- Bereitstellung von Endprodukten des anaeroben Stoffwechsels (Abbau von Glykogen) zur Förderung des aeroben Stoffwechsels in den Nervenzellen.
- Sie wischen neurale Abfallprodukte wie Kohlendioxid und Ammoniak auf und recyceln verbrauchte Aminosäurederivate.
- Sie schützen Neuronen vor der Exposition gegenüber überschüssigen Neurotransmittern wie Glutamat, indem sie gut entwickelte Aufnahmemechanismen verwenden, um diesen Sender zu recyceln. Sie zeichnen sich insbesondere durch das Vorhandensein hoher Konzentrationen von Glutaminsynthase aus.
- Sie können sowohl an der Phagozytose neuronaler Trümmer als auch an der Freisetzung neuroaktiver Substanzen wie GABA, Taurin und Dopamin beteiligt sein.Es wird angenommen, dass sie Retinsäure aus Retinol synthetisieren (Retinsäure ist bekanntermaßen wichtig für die Entwicklung des Auges und des Nervensystems) (Edwards, 1994)
- Sie kontrollieren die Homöostase und schützen Neuronen vor schädlichen Veränderungen in ihrer ionischen Umgebung, indem sie extrazelluläres K + aufnehmen und umverteilen.
- Sie tragen zur Erzeugung der Elektroretinogramm (ERG) b-Welle (Miller und Dowling, 1970; Newman und Odette, 1984), der langsamen P3-Komponente des ERG (Karwoski und Proenza, 1977) und der skotopen Schwellenantwort (STR) bei (Frishman und Steinberg, 1989). Sie tun dies durch Regulierung der K + -Verteilung über die Glaskörpergrenze der Netzhaut, über die gesamte Netzhaut und lokal in der inneren plexiformen Schicht der Netzhaut (Abb. 4, aus Reichenbach und Robinson, 1995, adaptiert aus Newman, 1989).

Abb. 4. Regulation von K+ durch Müller-Zellen in Müller-Zellen
2. Astrozyten.
Astrozyten sind keine Gliazellen des retinalen Neuroepithels, sondern gelangen vom Gehirn entlang des sich entwickelnden Sehnervs in die sich entwickelnde Netzhaut (Stone und Dreher, 1987; Chan-Ling 1994). Sie haben eine charakteristische Morphologie eines abgeflachten Zellkörpers und eine faserige Reihe von Strahlungsprozessen. Zwischenfilamente füllen ihre Prozesse und färben sich so dramatisch mit Antikörpern gegen GFAP (Schnitzer, 1988). Astrozytenzellkörper und -prozesse sind fast ausschließlich auf die Nervenfaserschicht der Netzhaut beschränkt. Ihre Morphologie ändert sich von der Peripherie zum Sehnervenkopf: von einer symmetrischen Sternform in der peripheren Netzhaut (Abb. 5a und b) (Schitzer, 1988) bis extrem länglich in der Nähe des Sehnervs (Abb. 6 und 7).
 Abb. 5a. Astrozyten in der peripheren Netzhaut. Schnitzer, 1988 |
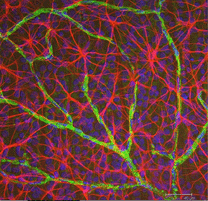 Abb. 5b. Astrozyten (rot) in der Netzhaut von Ratten unter Ganglienzellen (blau) und mit Blutgefäßen assoziiert (grün). Mit freundlicher Genehmigung von Laura Fernandez-Sanchez und Nicolas Cuenca |
Bei der immunzytochemischen Färbung (Abb. 5b) und bei intrazellulären HRP-Injektionen (Fig. 7) gefärbte Astrozyten zeigen deutlich Prozesse, die entlang der Ganglienzellen-Axone ausgerichtet sind, die durch die Nervenfaserschicht verlaufen. In der Verteilung erreichen Astrozyten ihren Höhepunkt auf dem Sehnervenkopf und haben eine ziemlich gleichmäßige Abnahme der Dichte in strahlenden Ringen vom Nervenkopf. Sie sind nicht in der avaskulären Fovea oder Ora serrata vorhanden.
 Abb. 6. Astrozyten in der zentralen Netzhaut. Schnitzer, 1988 |
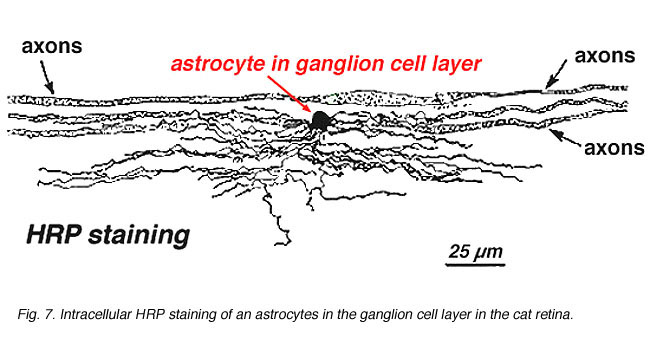 Abb. 7. Astrozyten in der Netzhaut von Katzen, gefärbt durch intrazelluläre Injektion von HRP. Mit freundlicher Genehmigung von Ralph Nelson. |
Dicke und dünne Astrozyten wurden anhand der Färbung mit Antikörpern gegen GFAP unterschieden (Trevino et al., 1996). So sind Astrozyten über der Oberfläche der Ganglienzellen-Axonbündel angeordnet, während sie in den Sehnervenkopf verlaufen und eine Röhre bilden, durch die die Axone verlaufen (Abb. 8). Gap Junctions und Zonula adherens Junctions wurden zwischen astrozytischen Prozessen in der Netzhaut beschrieben (Höllander et al., 1991).
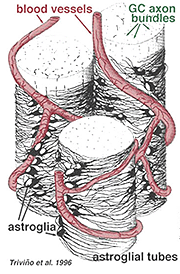
Abb. 8. 3-D-Block von Astrozyten, die über der Oberfläche von Ganglienzellen-Axonbündeln angeordnet sind
Die Blutgefäße, die in und zwischen den Ganglienzellbündeln verlaufen, werden auch von beiden Prozessen und sogar einem gelegentlichen Zellkörper eines Astrozyten bedeckt. Die Funktion von Astrozyten, die Ganglienzellaxone umhüllen, und die Beziehung zu Blutgefäßen der Nervenfaserschicht legen nahe, dass sie axonale und vaskuläre Gliascheiden und Teil einer Blut-Hirn-Schranke sind. Ähnlich wie Muller-Zellen sind sie dafür bekannt, reichlich Glykogen zu enthalten, und sie können einen nahrhaften Dienst bei der Bereitstellung von Glukose für die Neuronen bilden. Darüber hinaus spielen sie wahrscheinlich eine Rolle bei der ionischen Homöostase bei der Regulierung des extrazellulären Kaliumspiegels und des Metabolismus von Neurotransmittern wie GABA.
3. Mikrogliazellen.
Der dritte Gliazelltyp ist angeblich mesodermalen Ursprungs und somit streng genommen nicht neuroglial wie die Astrozyten und Muller-Zellen. Sie treten zeitgleich mit den mesenchymalen Vorläufern retinaler Blutgefäße in die Netzhaut ein (Chan-Ling, 1994). Mikrogliazellen sind in der menschlichen Netzhaut allgegenwärtig und finden sich in jeder Schicht der Netzhaut.
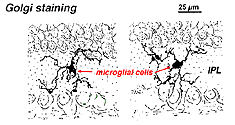
In der Golgi-gefärbten Netzhaut sehen sie aus wie seltsame, multipolare Formen mit kleinen Zellkörpern und unregelmäßigen kurzen Prozessen. Tatsächlich wurden sie in Golgi-Präparaten manchmal mit Nervenzellen verwechselt, insbesondere wenn sie in einer Kernschicht mit einer einzigen Orientierung ihrer Prozesse in der plexiformen Schicht liegen.
Abb. 9. Golgi-Färbung von Mikrogliazellen
Mikrogliazellen können von zwei Arten sein. Es wird angenommen, dass eine Form in frühen Entwicklungsstadien vom Sehnervenmesenchym in die Netzhaut gelangt und für einen Großteil des Lebens der Netzhaut in den Netzhautschichten schlummert. Die andere Form von Mikroglia scheinen durch Blut übertragene Zellen zu sein, die möglicherweise aus Gefäßperizyten stammen (Boycott und Hopkins, 1981; Gallego, 1986). Beide Typen können nach einem Trauma der Netzhaut zu einer makrophagischen Funktion stimuliert werden, und dann nehmen sie an einer Phagozytose degenerierender Netzhautneuronen teil.

Abb. 10a. Lektin-gefärbte Mikrogliazelle aus Chan-Lin, 1994.

Abb. 10b. Menschliche Netzhaut mit Astrozyten und Mikroglia. Dieses Bild von Scott McLeod aus Jerry Luttys Labor ist ein Wholemount-Präparat für die menschliche Netzhaut, das dreifach mit fluoreszierenden Antikörpern modelliert wurde, die Blutgefäße (blau), Astrozyten (rot) und Mikroglia (grün) färben.
4. Verweis.
Boykott BB, Hopkins JM. Mikroglia in der Netzhaut von Affen und anderen Säugetieren; seine Unterscheidung von anderen Arten von Glia und horizontalen Zellen. Neurowissenschaften.1981;6:679–688.
Cajal SR. In: Thorpe SA, Glickstein M, Übersetzer. 1892. Die Struktur der Netzhaut. Springfield (IL): Thomas; 1972.
Chan-Ling T. Gliale, neuronale und vaskuläre Interaktionen in der Netzhaut von Säugetieren. Progrock. Ret. Eye Res. 1994;13:357-389.
Edwards RB. Biosynthese von Retinsäure durch Müller-Gliazellen: ein Modell für das zentrale Nervensystem? Progrock. Ret. Eye Res. 1994;13:231-242.
Fisher SK, Lewis GP. Photorezeptoren und darüber hinaus: zelluläre und molekulare Effekte der Netzhautablösung.2. Great Basin Visual Science Symposium, II, Universität von Utah Press. 1995
Frishman LJ, Steinberg RH. Licht-evozierte Erhöhungen der o im proximalen Teil der dunkel angepassten Katzenretina. In: J Neurophysiol. 1989;61:1233–1243.
Gallego A. Vergleichende Studien zu horizontalen Zellen und eine Anmerkung zu Mikrogliazellen. Progrock. Ret. Res. 1986;5:165-206.
Guerin CJ, Anderson DH, Fisher SK. Veränderungen der intermediären Filamentimmunmarkierung treten als Reaktion auf Netzhautablösung und Wiederanhaftung bei Primaten auf.Investieren. Ophthal. Vis. Sci. 1990;31:1474–1482.
Karwoski CJ, Proenza LM. Beziehung zwischen Muller-Zellantworten, einem lokalen transretinalen Potential und Kaliumfluss. In: J Neurophysiol. 1977;40:244–259.
Miller RF, Dowling JE. Intrazelluläre Reaktionen der Müller (Glia) Zellen der Mudpuppy Retina: ihre Beziehung zur b-Welle des Elektroretinogramms. In: J Neurophysiol.1970;33:323–341. In:Newman EA, Odette LL. Modell der Elektroretinogramm-B-Wellengenerierung: ein Test der K + -Hypothese. In: J Neurophysiol. 1984;51:164–182. In:Newman EA. Elektrophysiologie der Netzhautgliazellen. Progrock. Ret. Res. 1989;8:153-172.Reichenbach A, Robinson SR. Die Beteiligung von Müller-Zellen in der äußeren Netzhaut. In: Archer SN, Djamgoz MBA, Vallerga S, Herausgeber. Neurobiologie und klinische Aspekte der äußeren Netzhaut. London: Chapman & Halle; 1995. s. 395-416.
Robinson SR, Hampson ECGM, Munro MN, Vaney DI. Unidirektionale Kopplung von Gap Junctions zwischen Neuroglia. Prok. Austr. Neurowissenschaften. Soc. 1993;3:167.
Schnitzer J. Astrozyten in der Netzhaut von Säugetieren. Progrock. Ret. Res. 1988;7:209-232.
Stone J, Makarov F, Hollander H. Die gliale Hülle des Soma- und Axonhügels von retinalen Ganglienzellen. In: Vis Neurosci. 12:273–279.
Stone J, Dreher Z. Beziehung zwischen Astrozyten, Ganglienzellen und Gefäßsystem der Netzhaut. In: J Comp Neurol. 1987;255:35–49.
Trivino A, Ramirez JM, Salazar JJ, Ramirez AI, Garcia-Sanchez J. Immunhistochemische Untersuchung der menschlichen Sehnervenkopf-Astroglia. Vision Res. 1996;36:2015-2028. Turner DL, Cepko CL. Ein gemeinsamer Vorläufer für Neuronen und Glia bleibt in der Rattenretina spät in der Entwicklung bestehen. Natur. 1987;328:131–136.