etikett: MEGACE ES-megestrolacetatsuspension
klinisk farmakologi
det finns flera analysmetoder som används för att uppskatta plasmakoncentrationer av megestrolacetat, inklusive gaskromatografi-massfragmentografi (GC-MF), högtrycksvätskekromatografi (HPLC) och radioimmunoassay (RIA). GC-MF-och HPLC-metoderna är specifika för megestrolacetat och ger ekvivalenta koncentrationer. RIA-metoden reagerar på megestrolacetatmetaboliter och är därför ospecifik och indikerar högre koncentrationer än GC-MF-och HPLC-metoderna. Plasmakoncentrationer är beroende, inte bara av den använda metoden utan också av tarm-och leverinaktivering av läkemedlet, vilket kan påverkas av faktorer som tarmkanalens rörlighet, tarmbakterier, administrerade antibiotika, kroppsvikt, kost och leverfunktion.
verkningsmekanism
flera utredare har rapporterat om den aptitförstärkande egenskapen hos megestrolacetat och dess möjliga användning vid kakexi. Den exakta mekanismen genom vilken megestrolacetat ger effekter vid anorexi och kakexi är okänd för närvarande.
farmakokinetiska egenskaper:
plasmakoncentrationer av megestrolacetat efter administrering av 625 mg (125 mg/mL) av Megace bisexuell ES oral suspension är ekvivalenta under matade förhållanden till 800 mg (40 mg/mL) av megestrolacetat oral suspension (se figur nedan).
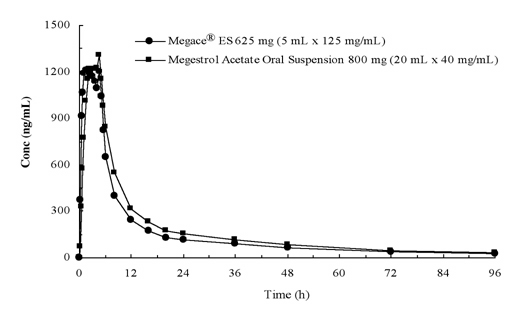
för att karakterisera dosproportionaliteten hos Megace Securitas es utfördes farmakokinetiska studier över ett antal doser vid administrering under fastande och matade förhållanden. Farmakokinetiken för megestrol var linjär i dosintervallet mellan 150 mg och 675 mg efter administrering av Megace Ukrainian ES oavsett måltidsförhållande. Cmax och AUC under en måltid med hög fetthalt ökade med 48% respektive 36% jämfört med dem under fastan efter 625 mg Megace sighburi ES-administrering (Tabell 1). En måltid med hög fetthalt ökade emellertid signifikant AUC och Cmax för megestrol till 2-faldigt respektive 7-faldigt jämfört med de under fastande tillstånd efter administrering av 800 mg i den ursprungliga formuleringen. Det fanns ingen skillnad i säkerhet efter administrering i fed-tillstånd, därför kunde Megace Kazaki ES tas utan hänsyn till måltider.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
plasma steady state farmakokinetik för megestrolacetat utvärderades hos 10 vuxna, kakektiska manliga patienter med förvärvat immunbristsyndrom (AIDS) och en ofrivillig viktminskning större än 10% av baslinjen. Patienterna fick orala engångsdoser på 800 mg / dag megestrolacetat oral suspension i 21 dagar. Plasmakoncentrationsdata erhållna dag 21 utvärderades i upp till 48 timmar efter den sista dosen.
medelvärde (1SD) för maximal plasmakoncentration (Cmax) av megestrolacetat var 753 (539) ng/mL. Medelarean under koncentrationstidskurvan (AUC) var 10476 (7788) ng x hr/mL (7788). Medianvärdet för Tmax var fem timmar. Sju av 10 patienter gick upp i vikt på tre veckor.
dessutom doserades 24 vuxna, asymptomatiska HIV – seropositiva manliga försökspersoner en gång dagligen med 750 mg megestrolacetat oral suspension. Behandlingen administrerades i 14 dagar. Genomsnittliga Cmax-och AUC-värden var 490 (238 238) ng/mL respektive 6779 (3048 3048) H x ng/mL. Medianvärdet för Tmax var tre timmar. Det genomsnittliga Cmax-värdet var 202 (101 GHz) ng / mL. Medelvärdet för % av fluktuationsvärdet var 107 (40 augusti).
Metabolism
megestrolacetatmetaboliter som identifierades i urinen utgjorde 5% till 8% av den administrerade dosen. Andningsutsöndring som märkt koldioxid och fettlagring kan ha stått för åtminstone en del av radioaktiviteten som inte finns i urin och avföring.
eliminering
den huvudsakliga vägen för eliminering av läkemedel hos människor är urin. När radioaktivt märkt megestrolacetat administrerades till människor i doser på 4 till 90 mg varierade urinutsöndringen inom 10 dagar från 56,5% till 78,4% (medelvärde 66,4%) och fekal utsöndring varierade från 7,7% till 30,3% (medelvärde 19,8%). Den totala Återvunna radioaktiviteten varierade mellan 83,1% och 94,7% (medelvärde 86,2%).
speciella populationer
farmakokinetiken för megestrolacetat har inte studerats i några speciella populationer.
DJURFARMAKOLOGI och / eller toxikologi
långtidsbehandling med Megace Securitas ES (megestrolacetat) kan öka risken för luftvägsinfektioner. En trend mot ökad frekvens av luftvägsinfektioner, minskat antal lymfocyter och ökat antal neutrofiler observerades i en tvåårig studie av kronisk toxicitet/karcinogenicitet av megestrolacetat som utfördes på råttor.
beskrivning av kliniska studier
megestrolacetat oral suspension i en dos av 800 mg/20 mL motsvarar 625 mg / 5 mL Megace Kazaki ES. Den kliniska effekten av megestrolacetat oral suspension utvärderades i två kliniska prövningar. En var en multicenter, randomiserad, dubbelblind, placebokontrollerad studie som jämförde megestrolacetat (MA) i doser på 100 mg, 400 mg och 800 mg per dag jämfört med placebo hos AIDS-patienter med anorexi/kakexi och signifikant viktminskning. Av de 270 patienter som ingick i studien uppfyllde 195 alla inklusions – /exklusionskriterier, hade minst två ytterligare viktmätningar efter baslinjen under en 12-veckorsperiod eller hade en viktmätning efter baslinjen men hoppade av för terapeutiskt misslyckande. Andelen patienter som fick fem eller fler pund vid maximal viktökning under 12 studieveckor var statistiskt signifikant större för de 800 mg (64%) och 400 mg (57%) ma-behandlade grupperna än för placebogruppen (24%). Genomsnittlig vikt ökade från baslinjen till den senaste utvärderingen under 12 studieveckor i den 800 mg MA-behandlade gruppen med 7.8 pund, 400 mg MA-gruppen med 4,2 pund, 100 mg MA-gruppen med 1,9 pund och minskade i placebogruppen med 1,6 Pund. Genomsnittliga viktförändringar vid 4, 8 och 12 veckor för patienter som kan utvärderas för effekt i de två kliniska studierna visas grafiskt. Förändringar i kroppssammansättning under de 12 studieveckorna mätt med bioelektrisk impedansanalys visade ökningar i kroppsvikt utan vatten i de MA-behandlade grupperna (se Tabell över kliniska studier). Dessutom utvecklades eller förvärrades ödem hos endast 3 patienter.
större procentandelar av Ma-behandlade patienter i 800 mg-gruppen (89%), 400 mg-gruppen (68%) och 100 mg-gruppen (72%), än i placebogruppen (50%), visade en förbättring av aptiten vid sista utvärderingen under de 12 studieveckorna. En statistiskt signifikant skillnad observerades mellan den 800 mg MA-behandlade gruppen och placebogruppen i förändringen av kaloriintaget från baslinjen till tiden för maximal viktförändring. Patienterna ombads att bedöma viktförändring, aptit, utseende och övergripande uppfattning om välbefinnande i en 9-frågeundersökning. Vid maximal viktförändring gav endast den 800 mg MA-behandlade gruppen svar som var statistiskt signifikant mer gynnsamma för alla frågor jämfört med den placebobehandlade gruppen. Ett dossvar noterades i undersökningen med positiva svar som korrelerade med högre dos för alla frågor.
den andra studien var en multicenter, randomiserad, dubbelblind, placebokontrollerad studie som jämförde megestrolacetat 800 mg/dag jämfört med placebo hos AIDS-patienter med anorexi/kakexi och signifikant viktminskning. Av de 100 patienter som ingick i studien uppfyllde 65 alla inklusions – /exklusionskriterier, hade minst två ytterligare viktmätningar efter baslinjen under en 12-veckorsperiod eller hade en viktmätning efter baslinjen men hoppade av på grund av terapeutiskt misslyckande. Patienter i den 800 mg MA-behandlade gruppen hade en statistiskt signifikant större ökning av genomsnittlig maximal viktförändring än patienter i placebogruppen. Från baslinjen till studievecka 12 ökade medelvikten med 11,2 pund i den MA-behandlade gruppen och minskade 2,1 pund i placebogruppen. Förändringar i kroppssammansättning mätt med bioelektrisk impedansanalys visade ökningar i icke-vattenvikt i den MA-behandlade gruppen (se Tabell över kliniska studier). Inget ödem rapporterades i den MA-behandlade gruppen. En större andel MA-behandlade patienter (67%) än placebobehandlade patienter (38%) visade en förbättring av aptiten vid den senaste utvärderingen under de 12 studieveckorna; denna skillnad var statistiskt signifikant. Det fanns inga statistiskt signifikanta skillnader mellan behandlingsgrupperna i genomsnittlig kaloriförändring eller i dagligt kaloriintag vid tiden till maximal viktförändring. I samma 9-frågeundersökning som refererades i den första studien visade patienternas bedömningar av viktförändring, aptit, utseende och övergripande uppfattning om välbefinnande ökningar i medelvärden hos MA-behandlade patienter jämfört med placebogruppen.
i båda studierna tolererade patienterna läkemedlet väl och inga statistiskt signifikanta skillnader sågs mellan behandlingsgrupperna med avseende på laboratorieavvikelser, nya opportunistiska infektioner, lymfocytantal, T4-tal, T8-tal eller hudreaktivitetstester (se avsnittet ADVERSEREACTIONS).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.