Label: MEGACE ES – megestrol acetát pozastavení
KLINICKÉ FARMAKOLOGIE
Existuje několik analytických metod používaných pro odhad megestrol acetátu v plazmě, včetně plynové chromatografie-hmotnostní fragmentography (GC-MF), vysokotlaké kapalinové chromatografie (HPLC) a radioimunoesejí (RIA). Metody GC-MF a HPLC jsou specifické pro megestrol acetát a výtěžek ekvivalentní koncentrace. Metoda RIA reaguje na metabolity megestrol acetátu, a proto je nespecifická a naznačuje vyšší koncentrace než metody GC-MF a HPLC. Plazmatické koncentrace jsou závislé nejen na použité metodě, ale také na střevní a jaterní inaktivaci léčiva, které mohou být ovlivněny faktory, jako je střevní motility traktu, střevní bakterie, antibiotika podávat, tělesná hmotnost, dieta a funkce jater.
Mechanismus účinku
Několik vyšetřovatelé hlášeny na chuť k jídlu, zvýšení majetku megestrol acetát a jeho možné využití v kachexii. Přesný mechanismus, kterým megestrol acetát vyvolává účinky na anorexii a kachexii, není v současné době znám.
Farmakokinetické Vlastnosti:
Plazmatické koncentrace megestrol-acetátu po podání 625 mg (125 mg/mL) Megace® ES perorální suspenze jsou rovnocenné v rámci fed podmínky na 800 mg (40 mg/mL) perorální suspenze megestrol-acetátu (viz obrázek níže).
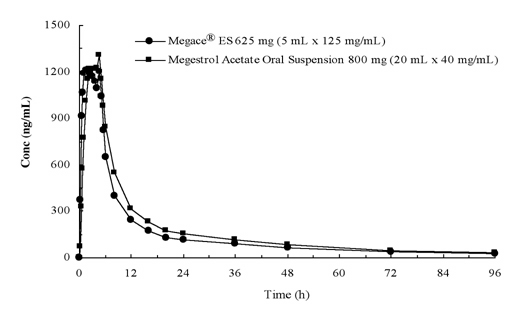
s cílem charakterizovat proporcionalita dávky z Megace® ES, farmakokinetické studie v různých dávkách byly provedeny při podávání pod půst a fed podmínky. Farmakokinetika přípravku megestrol byla lineární v dávkovacím rozmezí mezi 150 mg a 675 mg po podání přípravku Megace® ES bez ohledu na stav jídla. Cmax a AUC při jídle s vysokým obsahem tuku byly zvýšeny o 48% a 36% ve srovnání s hodnotami nalačno po podání 625 mg Megace® ES (Tabulka 1). Nicméně, jídlo s vysokým obsahem tuku výrazně zvýšil AUC a Cmax megestrol až 2-krát a 7-krát, respektive, ve srovnání s těmi, nalačno po podání 800 mg v původní formulaci. Nebyly zjištěny žádné rozdíly v bezpečnosti po podání ve stavu Fedu, proto Megace® ES mohl být užíván bez ohledu na jídlo.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
Plazmové ustáleného stavu farmakokinetika megestrol-acetátu byla hodnocena u 10 dospělých, kachektičtí pacienti se syndromem získané imunodeficience (AIDS) a nedobrovolná ztráta hmotnosti větší než 10% počáteční hodnoty. Pacienti dostávali jednorázovou perorální dávku 800 mg/den perorální suspenze megestrol acetátu po dobu 21 dnů. Údaje o plazmatických koncentracích získané 21. den byly hodnoceny po dobu až 48 hodin po poslední dávce.
Průměrná (±1SD) maximální plazmatická koncentrace (Cmax) megestrol acetátu byla 753 (±539) ng/ml. Průměrná plocha pod křivkou času koncentrace (AUC) byla 10476 (±7788) ng x hod/ml. Medián hodnoty Tmax byl pět hodin. Sedm z 10 pacientů přibralo na váze za tři týdny.
Navíc, 24 dospělých, asymptomatické HIV séropozitivních mužských pacientů byl podáván jednou denně, s 750 mg megestrol-acetátu perorální suspenze. Léčba byla podávána po dobu 14 dnů. Průměrné hodnoty Cmax a AUC byly 490 (±238) ng/mL a 6779 (±3048) H x ng / ml. Medián hodnoty Tmax byl tři hodiny. Průměrná hodnota Cmax byla 202 (±101) ng / ml. Průměrné % hodnoty fluktuace bylo 107 (±40).
metabolismus
metabolity Megestrol acetátu, které byly identifikovány v moči, představovaly 5% až 8% podané dávky. Respirační vylučování jako značeného oxidu uhličitého a ukládání tuků mohou mít představovaly alespoň část radioaktivity nebyl nalezen v moči a stolici.
eliminace
hlavní cestou eliminace léčiva u lidí je moč. Když značeného megestrol acetát byl podáván lidem v dávkách 4 až 90 mg, vylučování do 10 dnů v rozmezí od 56.5% 78.4% (průměr 66.4%) a fekální exkrece se pohyboval od 7,7% na 30.3% (v průměru o 19,8%). Celková získaná částka radioaktivity se pohybovala mezi 83.1% a 94.7% (průměr 86.2%).
zvláštní populace
farmakokinetika megestrol acetátu nebyla studována u žádné zvláštní populace.
farmakologie a / nebo toxikologie zvířat
dlouhodobá léčba přípravkem Megace ® ES (megestrol acetát) může zvýšit riziko respiračních infekcí. Trend k větší frekvenci respiračních infekcí, snižuje počet lymfocytů a zvýšení počtu neutrofilů u dvouleté studie chronické toxicity/karcinogenity megestrol-acetátu prováděné na potkanech.
popis klinických studií
Megestrol acetát perorální suspenze v dávce 800 mg / 20 mL odpovídá 625 mg / 5 mL Megace ® ES. Klinická účinnost perorální suspenze megestrol acetátu byla hodnocena ve dvou klinických studiích. Jeden byl multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii porovnávající megestrolacetát (MA) v dávkách 100 mg, 400 mg a 800 mg denně versus placebo u pacientů s AIDS s anorexie/kachexie a významné snížení hmotnosti. Z 270 pacientů vstoupil na studie, 195 splněny všechny kritéria zahrnutí/vyloučení, měl nejméně dvě další příspěvek základní měření hmotnosti přes 12 týden období, nebo měl jeden příspěvek základní měření hmotnosti, ale vypadl za terapeutické selhání. Procento pacientů, získává pět nebo více liber na maximální váhový přírůstek v 12 studijních týdnů, byl statisticky významně vyšší pro 800 mg (64%) a 400 mg (57%) MA léčených skupin než u placebo skupiny (24%). Průměrná hmotnost se zvýšila od výchozího stavu do posledního hodnocení za 12 týdnů studie ve skupině léčené 800 mg MA o 7.8 liber, 400 mg MA skupina o 4,2 kg, 100 mg MA skupina o 1,9 kilo a snížil ve skupině s placebem o 1,6 kg. Průměrné změny hmotnosti po 4, 8 a 12 týdnech u pacientů hodnotitelných z hlediska účinnosti ve dvou klinických studiích jsou graficky znázorněny. Změny ve složení těla během 12 týdnů studie měřené bioelektrickou impedanční analýzou prokázaly zvýšení tělesné hmotnosti bez vody ve skupinách léčených MA (viz tabulka klinických studií). Kromě toho se edém vyvinul nebo zhoršil pouze u 3 pacientů.
Větší procento MA léčených pacientů v 800 mg (89%), 400 mg (68%) a 100 mg skupina (72%), než v placebové skupině (50%), vykázaly zlepšení chuti k jídlu při posledním vyhodnocení v průběhu 12 studijních týdnů. Statisticky významný rozdíl byl pozorován mezi skupinou léčenou 800 mg MA a skupinou s placebem ve změně kalorického příjmu od výchozí hodnoty do doby maximální změny hmotnosti. Pacienti byli požádáni, aby posoudili změnu hmotnosti, chuť k jídlu, vzhled a celkové vnímání pohody v 9 dotazníkovém průzkumu. Na maximální změna hmotnosti jen 800 mg MA-experimentální skupina dala odpovědi, které byly statisticky významně příznivější na všechny otázky, když ve srovnání se skupinou léčenou placebem. V průzkumu byla zaznamenána odpověď na dávku s pozitivními odpověďmi korelujícími s vyšší dávkou pro všechny otázky.
druhý pokus byl multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii porovnávající megestrol acetát v dávce 800 mg/den versus placebo u pacientů s AIDS s anorexie/kachexie a významné snížení hmotnosti. 100 pacientů, kteří vstoupili na studium, 65 splněny všechny kritéria zahrnutí/vyloučení, měl nejméně dvě další příspěvek základní měření hmotnosti přes 12 týden období, nebo měl jeden příspěvek základní měření hmotnosti, ale vypadl za terapeutické selhání. Pacienti ve skupině léčené 800 mg MA měli statisticky významně větší nárůst průměrné maximální změny hmotnosti než pacienti ve skupině s placebem. Od výchozího stavu do 12. týdne studie se průměrná hmotnost zvýšila o 11,2 libry ve skupině léčené MA a snížila se o 2,1 libry ve skupině s placebem. Změny ve složení těla měřené bioelektrickou impedanční analýzou prokázaly zvýšení hmotnosti bez vody ve skupině léčené MA (viz tabulka klinických studií). Ve skupině léčené MA nebyl hlášen žádný edém. Vyšší procento pacientů léčených MA (67%) než pacientů léčených placebem (38%) vykázalo při posledním hodnocení během 12 týdnů studie zlepšení chuti k jídlu; tento rozdíl byl statisticky významný. Nebyly zjištěny statisticky významné rozdíly mezi léčebnými skupinami v průměrné kalorické změně nebo v denním kalorickém příjmu v době do maximální změny hmotnosti. Ve stejné 9. otázka průzkumu, na které se odkazuje v první studii pacientů posouzení změny hmotnosti, chuť k jídlu, vzhled a celkové vnímání pohody ukázala zvýšení průměrné skóre v MA-léčených pacientů ve srovnání s placebem.
V obou studiích pacientů tolerovat lék dobře a žádné statisticky významné rozdíly byly pozorovány mezi skupinami s ohledem na laboratorní abnormality, nové oportunní infekce, počet lymfocytů, T4 počítá, T8 počítá, nebo kožní reaktivita testů (viz ADVERSEREACTIONS oddíl).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.