Etikett: MEGACE ES- Megestrolacetat-Suspension
KLINISCHE PHARMAKOLOGIE
Es gibt verschiedene Analysemethoden zur Schätzung der Megestrolacetat-Plasmakonzentrationen, einschließlich Gaschromatographie-Massenfragmentographie (GC-MF), Hochdruckflüssigkeitschromatographie (HPLC) und Radioimmunoassay (RIA). Die GC-MF- und HPLC-Methoden sind spezifisch für Megestrolacetat und liefern äquivalente Konzentrationen. Die RIA-Methode reagiert auf Megestrolacetatmetaboliten und ist daher unspezifisch und zeigt höhere Konzentrationen an als die GC-MF- und HPLC-Methoden. Die Plasmakonzentrationen hängen nicht nur von der verwendeten Methode ab, sondern auch von der intestinalen und hepatischen Inaktivierung des Arzneimittels, die durch Faktoren wie Darmtraktmotilität, Darmbakterien, verabreichte Antibiotika, Körpergewicht, Ernährung und Leberfunktion beeinflusst werden kann.
Wirkmechanismus
Mehrere Forscher haben über die appetitsteigernde Eigenschaft von Megestrolacetat und seine mögliche Verwendung bei Kachexie berichtet. Der genaue Mechanismus, durch den Megestrolacetat Wirkungen bei Anorexie und Kachexie hervorruft, ist derzeit unbekannt.
Pharmakokinetische Eigenschaften:
Die Plasmakonzentrationen von Megestrolacetat nach Verabreichung von 625 mg (125 mg/ml) Megace® ES Suspension zum Einnehmen entsprechen unter Fütterungsbedingungen 800 mg (40 mg/ml) Megestrolacetat Suspension zum Einnehmen (siehe Abbildung unten).
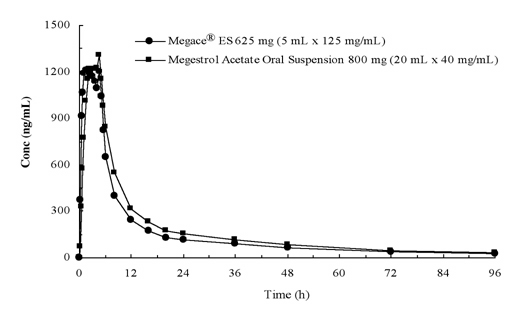
Um die Dosisproportionalität von Megace® ES zu charakterisieren, wurden pharmakokinetische Studien über einen Bereich von Dosen durchgeführt, wenn sie unter Nüchtern- und Fütterungsbedingungen verabreicht wurden. Die Pharmakokinetik von Megestrol war im Dosierungsbereich zwischen 150 mg und 675 mg nach Verabreichung von Megace® ES unabhängig vom Mahlzeitzustand linear. Die Cmax und die AUC unter einer fettreichen Mahlzeit waren um 48% bzw. 36% erhöht, verglichen mit denen unter Fasten nach 625 mg Megace® ES (Tabelle 1). Eine fettreiche Mahlzeit erhöhte jedoch die AUC und Cmax von Megestrol signifikant auf das 2-fache bzw. 7-fache im Vergleich zu denen unter Nüchternzustand nach Verabreichung von 800 mg in der ursprünglichen Formulierung. Es gab keinen Unterschied in der Sicherheit nach Verabreichung im gefütterten Zustand, daher konnte Megace® ES unabhängig von den Mahlzeiten eingenommen werden.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
Die Plasma-Steady-State-Pharmakokinetik von Megestrolacetat wurde bei 10 erwachsenen, kachektischen männlichen Patienten mit erworbenem Immunschwächesyndrom (AIDS) und einem unwillkürlichen Gewichtsverlust von mehr als 10% des Ausgangswerts untersucht. Die Patienten erhielten 21 Tage lang orale Einzeldosen von 800 mg / Tag Megestrolacetat-Suspension zum Einnehmen. Die am Tag 21 erhaltenen Plasmakonzentrationsdaten wurden bis zu 48 Stunden nach der letzten Dosis ausgewertet.
Die mittlere (±1SD) maximale Plasmakonzentration (Cmax) von Megestrolacetat betrug 753 (± 539) ng/ml. Die mittlere Fläche unter der Konzentrationszeitkurve (AUC) betrug 10476 (±7788) ng x h/ml. Der mediane Tmax-Wert betrug fünf Stunden. Sieben von 10 Patienten nahmen in drei Wochen zu.
Zusätzlich wurden 24 erwachsenen, asymptomatischen HIV-seropositiven männlichen Probanden einmal täglich 750 mg Megestrolacetat-Suspension zum Einnehmen verabreicht. Die Behandlung wurde 14 Tage lang verabreicht. Die mittleren Cmax- und AUC-Werte betrugen 490 (±238) ng/ml bzw. 6779 (±3048) hr x ng/ml. Der mediane Tmax-Wert betrug drei Stunden. Der mittlere Cmax-Wert betrug 202 (±101) ng/ml. Der mittlere Schwankungswert in % betrug 107 (±40).
Metabolismus
Die im Urin nachgewiesenen Metaboliten von Megestrolacetat machten 5% bis 8% der verabreichten Dosis aus. Die respiratorische Ausscheidung als markiertes Kohlendioxid und die Fettspeicherung können zumindest einen Teil der Radioaktivität ausmachen, die nicht in Urin und Kot gefunden wurde.
Elimination
Der Hauptweg der Arzneimittelelimination beim Menschen ist der Urin. Bei Verabreichung von radioaktiv markiertem Megestrolacetat an Menschen in Dosen von 4 bis 90 mg lag die Ausscheidung im Urin innerhalb von 10 Tagen zwischen 56,5% und 78,4% (Mittelwert 66,4%) und die Ausscheidung im Stuhl zwischen 7,7% und 30,3% (Mittelwert 19,8%). Die insgesamt wiedergewonnene Radioaktivität schwankte zwischen 83,1% und 94,7% (Mittelwert 86,2%).
Spezielle Populationen
Die Pharmakokinetik von Megestrolacetat wurde in keiner speziellen Population untersucht.
TIERPHARMAKOLOGIE UND/ODER TOXIKOLOGIE
Eine Langzeitbehandlung mit Megace ® ES (Megestrolacetat) kann das Risiko von Atemwegsinfektionen erhöhen. In einer zweijährigen Studie zur chronischen Toxizität / Kanzerogenität von Megestrolacetat an Ratten wurde ein Trend zu einer erhöhten Häufigkeit von Atemwegsinfektionen, verminderten Lymphozytenzahlen und erhöhten Neutrophilenzahlen beobachtet.
BESCHREIBUNG KLINISCHER STUDIEN
Megestrolacetat-Suspension zum Einnehmen in einer Dosis von 800 mg/20 ml entspricht 625 mg/5 ml Megace ® ES. Die klinische Wirksamkeit von Megestrolacetat Suspension zum Einnehmen wurde in zwei klinischen Studien untersucht. Eine war eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Studie, in der Megestrolacetat (MA) in Dosen von 100 mg, 400 mg und 800 mg pro Tag mit Placebo bei AIDS-Patienten mit Anorexie / Kachexie und signifikantem Gewichtsverlust verglichen wurde. Von den 270 Patienten, die in die Studie aufgenommen wurden, erfüllten 195 alle Einschluss- / Ausschlusskriterien, hatten mindestens zwei zusätzliche Gewichtsmessungen nach dem Ausgangswert über einen Zeitraum von 12 Wochen oder hatten eine Gewichtsmessung nach dem Ausgangswert, fielen jedoch wegen Therapieversagens aus. Der Prozentsatz der Patienten, die in 12 Studienwochen bei maximaler Gewichtszunahme fünf oder mehr Pfund zulegten, war statistisch signifikant höher für die 800 mg (64%) und 400 mg (57%) MA-behandelten Gruppen als für die Placebogruppe (24%). Das mittlere Gewicht stieg in der mit 800 mg MA behandelten Gruppe in 12 Studienwochen vom Ausgangswert bis zur letzten Auswertung um 7 an.8 Pfund, die 400 mg MA-Gruppe um 4,2 Pfund, die 100 mg MA-Gruppe um 1,9 Pfund und sank in der Placebo-Gruppe um 1,6 Pfund. Die mittleren Gewichtsveränderungen nach 4, 8 und 12 Wochen für Patienten, die in den beiden klinischen Studien auf Wirksamkeit evaluiert werden konnten, sind grafisch dargestellt. Veränderungen der Körperzusammensetzung während der 12 Studienwochen, gemessen durch bioelektrische Impedanzanalyse, zeigten eine Zunahme des Körpergewichts ohne Wasser in den mit MA behandelten Gruppen (siehe Tabelle der klinischen Studien). Darüber hinaus entwickelten oder verschlechterten sich Ödeme bei nur 3 Patienten.
Größere Prozentsätze der mit MA behandelten Patienten in der 800-mg-Gruppe (89%), der 400-mg-Gruppe (68%) und der 100-mg-Gruppe (72%) als in der Placebo-Gruppe (50%) zeigten eine Verbesserung des Appetits bei der letzten Auswertung während der 12 Studienwochen. Zwischen der mit 800 mg MA behandelten Gruppe und der Placebogruppe wurde ein statistisch signifikanter Unterschied in der Änderung der Kalorienaufnahme vom Ausgangswert bis zum Zeitpunkt der maximalen Gewichtsänderung beobachtet. Die Patienten wurden gebeten, die Gewichtsveränderung, den Appetit, das Aussehen und die allgemeine Wahrnehmung des Wohlbefindens in einer Umfrage mit 9 Fragen zu beurteilen. Bei maximaler Gewichtsänderung gab nur die mit 800 mg MA behandelte Gruppe statistisch signifikant günstigere Antworten auf alle Fragen als die mit Placebo behandelte Gruppe. In der Umfrage wurde eine Dosisantwort festgestellt, wobei positive Antworten bei allen Fragen mit einer höheren Dosis korrelierten.Die zweite Studie war eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Studie, in der Megestrolacetat 800 mg / Tag mit Placebo bei AIDS-Patienten mit Anorexie / Kachexie und signifikantem Gewichtsverlust verglichen wurde. Von den 100 Patienten, die in die Studie aufgenommen wurden, erfüllten 65 alle Einschluss- / Ausschlusskriterien, hatten mindestens zwei zusätzliche Gewichtsmessungen nach dem Ausgangswert über einen Zeitraum von 12 Wochen oder hatten eine Gewichtsmessung nach dem Ausgangswert, fielen jedoch wegen Therapieversagens aus. Patienten in der mit 800 mg MA behandelten Gruppe hatten einen statistisch signifikant größeren Anstieg der mittleren maximalen Gewichtsänderung als Patienten in der Placebogruppe. Vom Ausgangswert bis zur Studienwoche 12 stieg das mittlere Gewicht in der mit MA behandelten Gruppe um 11,2 Pfund und in der Placebogruppe um 2,1 Pfund. Veränderungen der Körperzusammensetzung, gemessen durch bioelektrische Impedanzanalyse, zeigten eine Zunahme des Nicht-Wassergewichts in der mit MA behandelten Gruppe (siehe Tabelle der klinischen Studien). In der mit MA behandelten Gruppe wurde kein Ödem berichtet. Ein größerer Prozentsatz der mit MA behandelten Patienten (67%) als die mit Placebo behandelten Patienten (38%) zeigten bei der letzten Auswertung während der 12 Studienwochen eine Verbesserung des Appetits; Dieser Unterschied war statistisch signifikant. Es gab keine statistisch signifikanten Unterschiede zwischen den Behandlungsgruppen hinsichtlich der mittleren Kalorienveränderung oder der täglichen Kalorienzufuhr zum Zeitpunkt der maximalen Gewichtsänderung. In derselben 9-Fragen-Umfrage, auf die in der ersten Studie Bezug genommen wurde, zeigten die Einschätzungen der Patienten zu Gewichtsveränderungen, Appetit, Aussehen und allgemeiner Wahrnehmung des Wohlbefindens einen Anstieg der mittleren Werte bei mit MA behandelten Patienten im Vergleich zur Placebogruppe.
In beiden Studien vertragen die Patienten das Medikament gut und es wurden keine statistisch signifikanten Unterschiede zwischen den Behandlungsgruppen in Bezug auf Laboranomalien, neue opportunistische Infektionen, Lymphozytenzahlen, T4-Zählungen, T8-Zählungen oder Hautreaktivitätstests beobachtet (siehe Abschnitt über NEBENWIRKUNGEN).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.