Frontiers in Chemistry
- Introduction
- materiaalit ja menetelmät
- Materiaalit
- soluviljelmä
- Prismapohjaiset SPR-kuvasarjat
- Anturisirujen valmistus
- virtausjärjestelmä
- Herkkyyskalibrointi
- tulokset ja keskustelu
- Alkuperäinen massatiheyden häviäminen Solunsitoutumisessa PFA: lla
- osmoottinen Painevaste Solunsidonnassa PFA: lla
- merkittävä massatiheyden menetys Tritonin aiheuttamassa solun Permeabilisaatiossa
- johtopäätös
- Tekijäosuudet
- Eturistiriitalausunto
- tunnustukset
Introduction
immunofluoresenssi on tehokas tekniikka tiettyjen biomolekyylien jakautumisen visualisoimiseksi biologisissa näytteissä, kuten soluissa ja kudoksissa (Joshi and Yu, 2017). Tyypillisissä solupohjaisissa immunofluoresenssimäärityksissä sitoutuneita soluja inkuboitiin fluoresoivalla vasta-aineella, jotta vasta-aineen ja kohdemolekyylin välinen spesifinen tunnistaminen ja sitoutuminen soluissa olisi mahdollista. Perusteellisen huuhtelun jälkeen näyte asetettiin fluoresenssimikroskoopille fluoresenssikuvan saamiseksi, josta kohdemolekyylien jakautumisesta raportoivat fluoresoivat tunnisteet. Jotta vasta-aineiden saatavuus kohdemolekyyleille olisi helpompaa ja solujen luontainen aktiivisuus estyisi, näytteet olivat usein kiinteitä ja permeabiloituneita ennen värjäysmenetelmiä. Niitä tarvittiin erityisesti silloin, kun kohdemolekyylit sijaitsivat sytoplasmassa. Monista reagenssityypeistä paraformaldehydi (PFA) ja Triton X-100 ovat todennäköisesti yleisimmin käytettyjä kiinnittymiseen ja permeabilisaatioon. PFA: n depolymerisaatio tuotti formaldehydimolekyylejä, jotka loivat näytteessä olevien proteiinien välille kovalenttisia kemiallisia sidoksia. Vaikutusmekanismi perustui yhden aminohappo jäännöslysiinin aktivoitumiseen. PFA myös liuotti solukalvoihin joitakin lipidejä, jotka hieman vaurioittivat solukalvon eheyttä (Fox ym., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100 pystyi tehokkaana ionittomana pesuaineena liuottamaan solukalvoista lipidejä, jolloin solukalvo muuttui läpäisevämmäksi fluoresoivalle vasta-aineelle. Permeabilisaatiovaihe poisti enemmän solukalvon lipidejä johtuen sen varaamattomista, hydrofiilisistä pääryhmistä, jotka koostuvat polyoksyetyleenistä, jotta suuret molekyylit, kuten vasta-aineet pääsevät solun sisään (Jamur and Oliver, 2010; Koley and Bard, 2010). Kaaviokuva solujen kiinnittymisestä ja permeabilisaatioprosessista esitetään kuvassa 1D. Huolimatta siitä, että kiinnittyminen ja permeabilisaatio ovat tulleet rutiininomaisiksi toimenpiteiksi immunofluoresenssissa ja immunohistokemiassa, melko harvoin on pyritty kvantitatiivisesti selventämään niiden vaikutuksia kalvon eheyteen ja solumassan tiheyteen yhden solun tasolla.
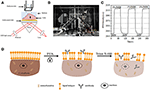
kuva 1. Prismapohjaisia SPR: n kuvausasetelmia. (A) kaavamainen kuva kokeellisesta järjestelystä. B) valokuva laitteesta. C) herkkyyden kalibrointikäyrä. D) kaavamainen kuvaus solujen kiinnittymisestä ja permeabilisaatiosta.
Pintaplasmoniresonanssi (SPR) on ollut suosittu ja tehokas menetelmä molekyyliparin välisen sitoutumiskinetiikan määrittämiseksi 1980-luvulta lähtien (Liedberg et al., 1983; Cullen et al., 1987). Tämä johtuu sen merkittävistä eduista, mukaan lukien reaaliaikainen kvantitatiivinen kineettinen mittaus korkeilla ajallisilla resoluutioilla, Yhteensopivuus laajennettujen laitteiden kanssa ja mikä tärkeintä, sen luontainen ominaisuus tarrattomuudesta (Rothenhäusler and Knoll, 1988; Phillips and Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su ja Wang, 2018). Varhaiset Sovellukset keskittyivät lähinnä biomolekulaaristen vuorovaikutusten karakterisointiin ja kvantifiointiin immobilisoimalla puhdistettuja molekyylejä SPR-tunnistusalustoille (kultapäällysteiset lasilevyt). Tällaiset ex situ-tutkimukset eivät ainoastaan vaatineet työvoimavaltaisia puhdistusmenetelmiä, vaan ne johtivat myös tuloksiin, jotka eivät välttämättä heijasta elävien olentojen luonnollista vuorovaikutusta (Phillips and Cheng, 2007; Homola, 2008). Sekä teknisen kehityksen eri SPR kuvantaminen (SPRi) järjestelmien ja tieteellisen motivaation yhden solun kuvantaminen ja analyysi, sekä Prisma ja objektiivinen SPRi tekniikoita on käytetty kuvaamaan massan jakautuminen yksittäisten elävien solujen ilman merkintää (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang ym., 2015; Zhang et al., 2015). Jokaisella on omat ansionsa. Jälkimmäisessä on korkeampi spatiaalinen resoluutio ja edellisessä parempi herkkyys. Seuraamalla yksittäisten elävien solujen ajallisesti kuluneita SPR-kuvia erilaisten fysiologisten ja biologisten stimulaatioiden aikana, tärkeää avaruudellista ja dynaamista tietoa solun ja substraatin vuorovaikutuksista (Giebel et al., 1999), cell migrations (Smith et al., 2004), osmoottiset vastaukset (Wang et al., 2012a), ligandireseptoria sitova kinetiikka (Wang et al., 2012b, 2014), signalointireitit (Deng et al., 2016), proteiinin aktivaatiodynamiikka (Peng et al., 2018), ja living cancer drug responses (Wang et al., 2018)on saatu. Tapauksissa olemassa olevat tutkimukset ovat selvästi osoittaneet, että SPRi-tekniikat kykenivät kartoittamaan massatiheyttä sekä kalvon eheyttä yksisolutasolla (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). SPRi: n kuvakontrasti tuli taitekertoimen subsellulaarijakaumasta, joka määräytyi karkeasti paikallisen massatiheyden mukaan. Spesifisten vasta-aineiden sitoutumisen solukalvoon, joka ilmaisi vastaavat antigeenit, tai elävien solujen stimuloimisen tietyillä kemikaaleilla havaittiin muuttavan yksittäisten solujen massatiheyttä heterogeenisesti ja dynaamisesti (Wang et al., 2012a, b). Yksittäisten elävien solujen altistuksen hypertonisille liuoksille havaittiin indusoivan solujen supistumista, mikä osoittaa solukalvojen erinomaisen eheyden (Wang et al., 2012a). On kuitenkin epäselvää, miten fiksaatio-ja permeabilisaatiohoidot vaikuttaisivat yksittäisten solujen SPR-kuviin.
tässä työssä käytimme kotona rakennettua SPRi-järjestelmää, jolla tallennettiin jatkuvasti kymmenien yksittäisten elävien solujen ajallisesti kuluneita SPR-kuvia, kun soluja käsiteltiin peräkkäin 4% PFA-liuoksella ja 1% Triton X-100-liuoksella. Yksittäisten solujen massatiheys määritettiin keskimääräisellä SPRi-signaalilla. Kalvojen eheyttä arvioitiin altistamalla solut hypertoniselle liuokselle. Havaittiin, että sen lisäksi, että <10% pienensi hieman massatiheyttä, PFA-hoito tuhosi merkittävästi solun eheyttä, mikä näkyi osmoottisen vasteen menetyksenä sokerimolekyylien altistuessa. Triton X-100: n myöhempi käsittely kuitenkin vähensi merkittävästi massatiheyttä vielä 20%, mikä viittaa kalvon eheyden vakavaan tuhoutumiseen.
materiaalit ja menetelmät
Materiaalit
dulbeccon fosfaattipuskuroitu suolaliuos (PBS, Gibco), sakkaroosi (Sinopharm Kemiallinen reagenssi Co., Ltd), Triton X-100 (Aladdin), Paraformaldehydi (Shanghai Lingfeng Chemical Reagent Co., Ltd). Kaikki reagenssit liuotettiin PBS: ään.
soluviljelmä
BT-474-soluja viljeltiin Dubelcon modifioidussa Kotkan elatusaineessa (Dmem, Invitrogen) 37°C: n lämpötilassa 5% CO2: lla ja 70%: n suhteellisella kosteudella 10%: lla sikiöiden seerumista (FBS, Invitrogen), 100 yksikköä/mL penisilliiniä ja 100 µg / mL streptomysiiniä (Invitrogen). Solut läpäistiin, kun ne olivat 70-80% konfluentteja käsittelemällä 0,25% trypsiiniliuoksella (Gibco).
Prismapohjaiset SPR-kuvasarjat
kaaviokuva ja kuva SPRi-järjestelmästä on esitetty kuvissa 1A ja B. SPRi-laite koostuu pääasiassa kolmesta osasta: valonlähteestä,optisista komponenteista ja kamerasta.
• Valonlähde: 670 nm: n valodiodi (L7868-01, Hamamatsu, Japani) ja lämpötilasäädelty asennuspistorasia (LDM21, Thorlabs, Newton, USA).
• optiset komponentit (Edmund Optics, USA): kolmion SF-11 prisma, jossa anturisiru päällä (No. 1 BK7-lasi Fisherbrandista), lähentyvä linssi, polarisaattori ja viritettävä linssi.
• Camera: Charge-coupled device camera (Pike F032B, Allied Vision Technology, Newburyport, USA).
p-polarisoitunut valo osuu kullalla päällystetyn lasilevyn pohjaan prisman läpi suoraan ja kamera kaappaa heijastuneen säteen tuottaakseen SPR-kuvia nopeudella 0,828 kuvaa sekunnissa (fps). Kun valittiin 4x suurennos viritettävällä linssillä, näkökenttä oli ~2 × 2 mm2.
Anturisirujen valmistus
jokainen siru pestiin 75-prosenttisella etanolilla ja deionisoidulla vedellä (DIW), minkä jälkeen se altistettiin UV-säteilylle 30 minuutin ajan pintakontaminaation poistamiseksi ja steriloimiseksi ennen jokaista koetta. Kultasirun päälle asetettiin Flexi-permis piikammio (Greiner Bio-One), joka toimi soluviljelmänä hyvin. Pinnan muokkaamiseksi ennen solujen kylvöä kammioon lisättiin 100 µg/mL 150 µL kollageeniliuosta, jota pidettiin inkubaattorissa 2 tunnin ajan.siru huuhdeltiin deionisoidulla vedellä kahdesti ja dmem kahdesti ennen solujen kylvöä. Jotta solut olisivat hyvässä kunnossa, siru inkuboitiin kasvualustassa 36 tunnin ajan.kasvualusta korvattiin sitten PBS-puskuriliuoksella 10 minuutin ajan, jotta solut saavuttaisivat tasapainon.
virtausjärjestelmä
injektointiin ja liuoksen vaihtamiseen käytettiin painovoimavetoista monikanavaista lääkeperfuusiojärjestelmää. Virtausnopeus on 300 µL/min ja liuoksen kytkentänopeus solujen ympärillä voi saavuttaa 1-2 s.
Herkkyyskalibrointi
anturisiru valmistettiin edellisen osan mukaisesti ilman pinnan muokkausta ja kennojen kylvöä. Ensin DIW virtasi sirun yli noin 60 s. sitten se korvattiin 1% (v/v) etanoliliuoksella toisen 60 s. yhtenä yleisimmin käytetyistä kalibrointiliuoksista 1% etanolin tiedetään lisäävän DIW: n SPR-kulmaa 60 mDeg: llä. Kokeelliset tulokset osoittivat, että SPR: n voimakkuus kasvoi vastaavasti 96 iu (Kuva 1c), mikä vastaa 1, 6 ΔI: n herkkyyttä.U/mDeg.
tulokset ja keskustelu
solukalvo (tunnetaan myös nimellä sytoplasmakalvosto), joka koostuu lipidikaksikosta, johon on upotettu proteiineja, on puoliläpäisevä kalvo, joka sulkee solun sytoplasman sisäänsä. Solujen ja kudosnäytteiden kiinnitys-ja permeabilisaatiovaiheet, jotka voivat muuttaa solukalvon läpäisevyyttä, ovat ratkaisevia menetelmiä, joilla voidaan määrittää immunofluoresenssien tai immunohistokemiallisten määritysten onnistumiset. Tämän lisäksi vasta-aineiden laatu ja immunoreaktiomenetelmä ovat muita keskeisiä taustatekijöitä tämäntyyppisissä kokeissa. SPR: ssä on se ominaisuus, että sekä resonanssikulma että taitekerroin (ri) lähellä anturipintaa ovat erittäin herkkiä pintakerroksen massatiheydelle keskimetallirajapinnassa. Siksi Cellin massatiheyden vaihtelut, jotka tapahtuvat metallikalvolla tai sen lähellä (~200 nm), voitiin tallentaa synkronisesti mittaamalla heijastuneen valon voimakkuus. Käyttämällä pinta plasmon resonanssi kuvantaminen tekniikka, tutkimme dynaaminen jakautuminen solumassatiheyden korkea spatiaalinen ja ajallinen resoluutiot ja luotettava herkkyys sekä kiinnitys-ja permeabilization prosesseja tässä tutkimuksessa.
Alkuperäinen massatiheyden häviäminen Solunsitoutumisessa PFA: lla
ensimmäinen vaihe biologisten näytteiden valmistamisessa immunofluoresenssiin tai immunohistokemialliseen analyysiin on yleensä kiinnittyminen. Ja yleisimmin käytetty fixatives tämäntyyppisissä määrityksissä ovat crosslinking fixatives kuten PFA, joka toimii tuottamalla kovalenttisia kemiallisia sidoksia proteiinien välillä soluissa tai kudoksissa. Siksi tutkimme PFA-hoidon vaikutusta solujen massatiheyteen. Eläviä BT-474-soluja viljeltiin kultakalvolla päällystetyillä coverslipeillä, joiden paksuus oli 50 nm. Kuvassa 2a on edustava yksittäisiä soluja sisältävä SPR-kuva. kunkin solun SPR-signaalit saadaan valitsemalla SPR-kuvaan kiinnostava alue, joka vastaa tutkitun solun morfologiaa. Tyypillisessä kokeessa, kun liuos virtasi solujen yli, solujen SPR sensorgrams saatiin analysoimalla jokainen solu kuten kuvassa 2b (musta käyrä). Edeltävien 242 sekunnin aikana solujen yllä virtasi PBS-puskuri ilman PFA: ta ja lähtötilanne määritettiin järjestelmän stabiiliuden (valonlähteen ja mekaanisen stabiilisuuden) ja elävien solujen tuottamien luontaisten mikromotiosignaalien perusteella. PFA-liuos otettiin käyttöön 242. sekunnilla, mikä nosti välittömästi SPR-signaalia suhteellisen suuren 4% PFA-liuoksen taitekertoimen (bulk effect) vuoksi. PFA-liuos kesti vielä 17 minuuttia riittävän kiinnityksen saavuttamiseksi. 1237. sekunnilla PFA-liuos vaihdettiin takaisin puhtaaseen PBS-liuokseen. Vähentyneen bulkkivaikutuksen lisäksi havaittiin yksittäisten solujen SPR-intensiteetin väheneminen verrattaessa signaaleja ennen (0-242) ja jälkeen (1237-1545) PFA-hoitoja ja massahäviöprosentti saatiin jakamalla vähennysarvo alkuarvoon. Taustan SPR-sensongramit (viereinen alue ilman solujen adheesiota, sininen käyrä) ja yksittäinen solu, jota on käsitelty PBS: llä 1 500 s: n aikana (harmaa käyrä) on esitetty myös Kuvassa 2b. tilastollinen analyysi 30 solusta paljastaa massatiheyden häviämisen olevan keskimäärin 10 ± 5%, kuten kuvassa 2C esitetään. Havaittiin myös, että PFA-hoidon jälkeen SPR-signaalin lähtötason vaihtelutaso pieneni merkittävästi puolella tai jopa kahdella kolmasosalla, mikä viittaa mikromotioiden häviämiseen ja käsiteltyjen solujen kiinnittymiseen, kuten kuvassa 2D esitetään. tällaiset mikromotiosignaalit syntyivät useista solun eri osista, kuten luurangosta, kalvoista ja organelleista, peräisin olevista dynaamisista solutoiminnoista. Kiinnittyminen lopetti tällaiset biologiset toiminnot ja poisti siten mikromotiosignaalit, minkä seurauksena yksittäisten solujen SPR-sensogrammien intensiteettivaihtelu väheni merkittävästi.
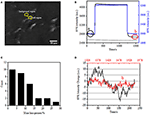
kuva 2. Solujen kiinnittymisprosessi. (A) SPRi-kuva BT-474-soluista. (B) yksittäisen solun (musta käyrä) ja taustan (sininen käyrä) SPR-signaalit, jotka ovat käynnissä liuoksen kytkentäprosessissa: PBS-puskuri 4%: iin PFA-PBS-puskuriin. SPR signaali yhden solun käsitelty PBS aikana 1500 s (harmaa käyrä). C) 30 yksittäisen solun Massahäviöjakauma. D) kennon Melutaso ennen (A) ja jälkeen (b) PFA-käsittelyn.
osmoottinen Painevaste Solunsidonnassa PFA: lla
solukalvon integroitu rakenne, puoliläpäisevä kalvo, säätelee solun homeostaasia saavuttaakseen tasapainon fysiologisessa osmoottisessa paineessa. PFA-hoidolla havaittiin myös olevan kyky tuhota kalvon eheys kuten kuvassa 3. Kun puskuri kohdesolun ympärillä muuttui 25 mM: n sakkaroosiliuokseksi <1 s lääkeperfuusiojärjestelmän kautta, syntyi hypertoninen soluviljelyympäristö. Eläville soluille altistuminen hypertoniselle liuokselle laukaisi sarjan fysiologisia reaktioita tasapainottamaan solunsisäistä ja solunulkoista osmoottista painetta, jota on tutkittu yksityiskohtaisesti aiemmassa työssämme (Wang et al., 2012a). Tässä tutkimuksessa kuviossa 3a esitetään tyypillinen yksittäisten fysiologisten BT-474-solujen SPR sensorgram. hypertoniselle sakkaroosiliuokselle altistumisen jälkeen käsitellyt solut ensin kutistuivat puristetusti, mikä johti SPR: n intensiteetin asteittaiseen kasvuun, kunnes tasanne saavutettiin. Se viittasi lisääntyneeseen massatiheyteen, joka johtuu solujen kutistumisesta ja solunosien kerääntymisestä kohti kultaviljelypeitteen pohjaa. SPR-intensiteetin asteittainen kasvu hypertonisella stimulaatiolla on eräänlainen solun osmoottisen paineen fysiologinen säätely, mikä osoittaa solukalvon fysiologista eheyttä. Kun kalvon eheys tuhoutui, hypertonisen sakkaroosiliuoksen käyttöönoton havaittiin välittömästi lisäävän SPR-intensiteettiä paljon lyhyemmässä ajassa, kuten kuvassa 3B esitetään. Se johtuu siitä, että sokerimolekyylit tunkeutuivat soluihin vapaasti ilman puoliläpäisevän kalvon resistenssiä ja lisäsivät paikallista taitekerrointa välittömästi (bulkkivaikutus). On selvää, että vaikka SPR: n voimakkuuden hidas kasvu heijasti fysiologista osmoottista säätelyä (Kuva 3A), nopea hyppy osoitti, että solukalvo oli vaurioitunut mahdollistamaan pienten sokerimolekyylien vapaan sisäänpääsyn (kuva 3B).

kuva 3. Solujen osmoottiset painevasteet. A) elävän solun vaste 25 mM: n sakkaroosille. (B) saman solun vaste kiinteä (10 min) 25 mM sakkaroosia.
merkittävä massatiheyden menetys Tritonin aiheuttamassa solun Permeabilisaatiossa
edellisessä kiinnitysvaiheessa solun alkuperäinen massatiheys laski vain ~10% (Kuva 2C). On kohtuullista spekuloida, että PFA-kiinnitys vain hieman tuhosi kalvon eheyttä ja lisäsi pienten molekyylien läpäisevyyttä. Suurin osa solunsisäisistä komponenteista tulee edelleen säilyttää sytoplasmakalvostossa. Myöhemmin tutkimme tyypillisen permeabiloitumispesuaineen, 1% Triton X-100, vaikutusta soluihin, jotka on kiinnitetty PFA: lla 17 minuuttia aiemmin. Kuvassa 4A esitetään edustava SPR sensorgram yksittäissoluista altistuksen aikana 1% Triton X-100: lle.Triton X-100: n käyttöönotto lisäsi SPR: n intensiteettiä, jota seurasi asteittainen lasku. Ensimmäinen lisäys on seurausta bulkkiliuoksen taitekertoimen kasvusta, ja sitä seurannut lasku osoitti massatiheyden vähittäistä häviämistä solun permeabilisaation vuoksi. Pienempi massatiheys oli runsaampi verrattaessa SPR: n intensiteetin muutosta ennen (0-300 s) ja pesuaineen käyttöönoton jälkeen (1 300-1 800 s). Analyysi 30 yksittäissolusta osoitti, että Triton X-100-käsittely aiheutti merkittävän massatiheyden alenemisen vielä 20 ± 5% PFA-kiinnityksen jälkeen, kuten kuvassa 4D ja taulukossa 1 esitetään. On selvää, että pesuaine Triton X-100 poisti paljon enemmän solukalvon lipidejä ja tuhosi vakavasti kalvon eheyden tässä läpäisyvaiheessa. Tämä johti siihen, että solunsisäisiä komponentteja, erityisesti makromolekyylejä, vapautui soluista enemmän. Tämä mahdollistaa myös sen, että isot molekyylit, kuten vasta-aineet, pääsevät solun sisään seuraavassa immunoreaktiovaiheessa. Vaikka pienten molekyylien huuhtoutumisen SPR-intensiteetti havaittiin PFA-kiinnityksen jälkeen, permeabilisaatio käyttämällä Triton X-100-pesuainetta liuotti lipidit selvästi ja teki soluista paljon läpäisevämpiä makromolekyylien liikkeille solurungossa ja ulos.
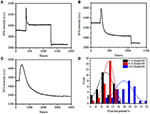
kuva 4. Erilaisilla konsentraatioliuoksilla käsiteltyjen solujen massahäviökäyrät (A) 1, 0%, (B) 0, 5%, (C) 0, 1%. (D) 30 yksittäisen solun Massahäviön jakautuminen eri olosuhteissa.

Taulukko 1. Yhteenveto tilastollisten solujen massatiheyden häviämisen vaihteluista eri olosuhteissa.
havaittiin, että massatiheyden häviäminen on melko nopea prosessi, joka tapahtui muutamassa minuutissa permeabilisaatiovaiheessa (Kuva 4A). Massatiheyden vähenemistä seurasi karkeasti monotoninen hajoaminen 126 s: n kuluessa. tyypilliset sensorgramit yksittäisistä soluista,jotka ovat alle 0,5 ja 0,1% Triton X-100, näkyvät kuvissa 4B, C. Permeabilisaatioprosessi muuttui huomattavasti hitaammaksi, kun pesuaineen pitoisuutta vähennettiin. Kesti 126, 510, 2600 s, ennen kuin käsitellyt kolme solulajia lopettivat massahäviön.
johtopäätös
yhteenvetona voidaan todeta, että solujen massatiheyden dynaamista uudelleenjakautumista sekä kiinnittymis-että permeabilisaatioprosesseissa on tutkittu herkästi käyttämällä prismapohjaisia SPRi-asetuksia, joilla on suuret spatiaaliset ja ajalliset resoluutiot. Kiinnittyvä PFA voisi aluksi lisätä jonkin verran sytoplasmakalvoston läpäisevyyttä, koska se pystyy kiinnittämään soluproteiineja sekä kalvoihin että solunsisäisiin proteiineihin. Sitä tuki (1) vähentynyt massatiheys ~10% 17-min kiinnityskäsittelyn jälkeen 4% PFA-liuoksessa ja (2) eliminoitu soluvaste hypertoniselle liuokselle, joka osoitti solun eheyden tuhoutumisen pienille molekyyleille, kuten sokereille. Pesuaine Triton X-100 on parempi kuin kiinnitysaine PFA liukoisessa lipideissä ja siten lisää solukalvon läpäisevyyttä, johon liittyy suurempi massatiheyden menetys, joka johtuu pienten molekyylien lisäksi myös suurten molekyylien ja mahdollisesti joidenkin organellien, kuten vesikkelien, vapautumisesta. Lisäksi massahäviön nopeus korreloi positiivisesti Triton X-100-konsentraation kanssa. Nämä tulokset antoivat kvantitatiivisia ja dynaamisia käsityksiä kiinnittymisen ja permeabilisaation vaikutuksesta solun massatiheyteen ja kalvon eheyteen, millä on vaikutuksia yksisoluisten biologisten kokeiden, kuten immunofluoresenssien ja immunohistokemiallisten määritysten, olosuhteiden optimointiin.
Tekijäosuudet
RC, Y-WS ja WW suunnittelivat kokeet. RC, FZ, ML ja XW suorittivat kokeet. RC, Y-WS, ja WW kirjoitti lehden. RC, FZ, Y-WS ja WW keskustelivat tuloksista ja analysoivat tiedot.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
käsittelevä editori julisti yhteisen kuulumisen, joskaan ei muuta yhteistyötä, tekijöiden WW, RC, ML ja XW kanssa tarkasteluhetkellä.
tunnustukset
kiitämme taloudellista tukea Kiinan National Natural Science Foundationilta (apuraha nro 21522503).
Abadian, P. N., Kelley, C. P., and Goluch, E. D. (2014). Cellular analysis and detection using surface plasmon resonance techniques. Anaali. Kemiaa. 86, 2799–2812. doi: 10.1021/ac500135s
PubMed Abstract | CrossRef Full Text/Google Scholar
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Immunokompleksien muodostumisen havaitseminen pintaplasmoniresonanssin avulla kultapäällysteisissä diffraktioritilöissä. Biosensorit 3, 211-225. doi: 10.1016 / 0265-928X (87) 85002-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., ja Wang, P. (2016). Kaksilokeroinen mikrofluidinen laite pitkäaikaiseen elävien solujen tunnistukseen, joka perustuu pintaplasmoniresonanssiin. Biomikrofluidiikka 10: 044109. doi: 10.1063/1.4960487
PubMed Abstract | CrossRef Full Text | Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Formaldehydifiksaatio. J. Histochem. Sytochem. 33, 845–853. doi: 10.1177 / 33.8.3894502
PubMed Abstract | CrossRef Full Text/Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Elävien solujen solu-ja substraattikontaktien kuvantaminen pintaplasmoniresonanssimikroskopialla. Biofyysejä. J. 76, 509-516. doi: 10.1016/S0006-3495(99)77219-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Homola, J. (2008). Pinta plasmon resonanssi anturit havaitsemiseen kemiallisten ja biologisten lajien. Kemiaa. Rev. 108, 462-493. doi: 10.1021/cr068107d
PubMed Abstract | CrossRef Full Text | Google Scholar
Jamur, M. C., and Oliver, C. (2010). ”Permeabilization of cell membranes,” in Immunocytochemical Methods and Protocols, eds C. Oliver and M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007/978-1-59745-324-0_9
CrossRef Full Text | Google Scholar
Joshi, S., and Yu, D. (2017). ”Chapter 8-Immunofluoresence,” teoksessa Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha, and M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Full Text/Google Scholar
Kiernan, J. A. (2018). Formaldehydi, formaliini, paraformaldehydi ja glutaarialdehydi: mitä ne ovat ja mitä ne tekevät. Micros. Tänään 8, 8-13. doi: 10.1017/S1551929500057060
CrossRef Full Text | Google Scholar
Koley, D., and Bard, A. J. (2010). Triton X-100 konsentraatio vaikuttaa yksittäisen HeLa-solun kalvonläpäisevyyteen skannaamalla sähkökemiallinen mikroskopia (SECM). Proc. Natl. Acad. Sci. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract | CrossRef Full Text/Google Scholar
Liedberg, B., Nylander, C., and Lunström, I. (1983). Pinta plasmon resonanssi kaasun havaitsemiseen ja biosensointi. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text/Google Scholar
Méjard, R., Griesser, H. J., and Thierry, B. (2014). Optinen biosensointi merkittömiin solututkimuksiin. TrAC Trends Anaali. Kemiaa. 53, 178–186. doi: 10.1016 / J. trac.2013.08.012
CrossRef Full Text/Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Orvaskeden kasvutekijän reseptorin aiheuttaman vasteen kuvaaminen yksittäisissä elävissä soluissa ilman leimaa. Analyytikko 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Abstract | CrossRef Full Text | Google Scholar
Phillips, K. S., and Cheng, Q. (2007). Viimeaikaiset edistysaskeleet pintaplasmonien resonanssiin perustuvissa bioanalyysitekniikoissa. Anaali. Bioanaali. Kemiaa. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text/Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Pintaplasmonimikroskopia. Luonto 332, 615-617. doi: 10.1038 / 332615a0
CrossRef Full Text / Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. M. (2004). Solujen siirtymän mittaaminen pintaan sitoutuneista fibronektiinigradienteista. Langmuir 20, 8279-8286. doi: 10.1021/la0489763
PubMed Abstract | CrossRef Full Text | Google Scholar
Su, Y. W., and Wang, W. (2018). Surface plasmon resonance sensing: puhdistetuista biomolekyyleistä ehjiin soluihin. Anaali. Bioanaali. Kemiaa. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Abstract / CrossRef Full Text/Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., and Ranganathan, K. (2012). Kemiallinen ja fysikaalinen perusasiat rutiini formaldehydin kiinnitys. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103 / 0973-029X. 102496
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Label-free Imaging, detection, and mass measurement of single viruses by surface plasmon resonance. Proc. Natl. Acad. Sci. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Yhden solun ja substraatin vuorovaikutuksen kartoitus pintaplasmoniresonanssimikroskopialla. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Kalvoproteiinien sitoutumiskinetiikan mittaaminen ja kartoittaminen yksittäisissä elävissä soluissa. Nat. Kemiaa. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ drug-receptor binding kinetics in single cells: a quantitative label-free study of anti-tumor drug resistance. Sci. 4:6609. doi: 10.1038 / srep06609
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Erittäin herkkä ja erittäin nopea kokonaisten leimaamattomien elävien syöpäsolujen vasteiden havaitseminen paklitakseliin grafeenipohjaisella biosensorilla. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / J.snb.2018.02.095
CrossRef Full Text / Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Surface plasmon resonance solupohjaiseen kliiniseen diagnoosiin. Sensorit 14, 4948-4959. doi: 10.3390 / s140304948
PubMed Abstract / CrossRef Full Text / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., and Hide, M. (2010). Refraktioindeksin muutosten havaitseminen yksittäisissä elävissä soluissa pintaplasmoniresonanssikuvauksen avulla. Bioseenit. Bioelektronia. 26, 674–681. doi: 10.1016 / J.bios.2010.06.065
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Label-free tracking of single organell transportation in cells with nanometri precision using a plasmonic imaging technique. Small 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Epidermaalisen kasvutekijän reseptorin ekspressiotason kvantifiointi ja solupintojen sitomiskinetiikka pintaplasmoniresonanssikuvauksella. Anaali. Kemiaa. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstract / CrossRef Full Text / Google Scholar