Hranic, v Chemii
- Úvod
- Materiály a Metody
- Materiály
- Buněčné Kultury
- Prism na Bázi SPR Zobrazování Nastavení
- Sensor Chip Příprava
- Flow Systém
- Citlivost Kalibrace
- Výsledky a Diskuse
- počáteční ztráta hmotnostní hustoty při fixaci buněk PFA
- Osmotického Tlaku v Buňce Fixaci PFA
- Značné Hustoty Hmoty Ztráty v Buňce Permeabilization Triton
- Závěr
- autorské příspěvky
- Prohlášení o střetu zájmů
- poděkování
Úvod
Imunofluorescence je silný technika pro vizualizaci distribuce specifických biomolekul v biologických vzorcích, jako jsou buňky a tkáně (Joshi a Yu, 2017). V typických buněčných imunofluorescenčních testech byly adherentní buňky inkubovány s fluorescenční protilátkou, aby se umožnilo specifické rozpoznání a vazba mezi protilátkou a cílovou molekulou v buňkách. Po důkladném opláchnutí byl vzorek umístěn pod fluorescenční mikroskop, aby se získal fluorescenční obraz, ze kterého byla distribuce cílových molekul hlášena fluorescenčními značkami. Aby se usnadnila dostupnost protilátky k cílovým molekulám a inhibovala inherentní buněčnou aktivitu, byly vzorky před barvením často fixovány a permeabilizovány. Byly zvláště nezbytné, když byly cílové molekuly umístěny v cytoplazmě. Mezi mnoha typy činidel jsou paraformaldehyd (PFA)a Triton X-100 pravděpodobně nejpoužívanější pro fixaci a permeabilizaci. Depolymerace PFA produkovala molekuly formaldehydu za vzniku kovalentních chemických vazeb mezi proteiny ve vzorku. Mechanismus účinku se spoléhal na aktivaci jednoho z aminokyselinových zbytků lysinu. PFA také rozpustil některé lipidy v buněčných membránách, které mírně poškodily integritu buněčné membrány (Fox et al ., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, jako účinný neiontový detergent, mohl rozpouštět lipidy z buněčných membrán, takže buněčná membrána se stala propustnější pro fluorescenční protilátku. Na permeabilization kroku odstraní více buněčné membrány lipidy díky své neutrální, hydrofilní hlava skupiny, které se skládají z polyetylénový složek, aby velké molekuly, jako protilátky se dostat dovnitř buněk (Jamur a Oliver, 2010; Koley a Bard, 2010). Schematické znázornění procesu fixace a permeabilizace buněk je znázorněno na obrázku 1D. Navzdory skutečnosti, že se fixace a permeabilization se staly rutinní postupy v imunofluorescence a imunohistochemie, docela vzácné bylo vyvinuto úsilí, aby kvantitativně objasnit jejich vliv na membránové integrity a buněčné hustoty hmoty na úrovni jediné buňky.
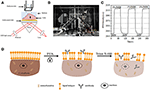
Obrázek 1. Prism-based spr zobrazovací nastavení. A) schematické znázornění experimentálního uspořádání. B) fotografii přístroje. C) kalibrační křivka citlivosti. (D) schematické znázornění fixace a permeabilizace buněk.
Surface plasmon resonance (SPR) byl populární a mocné techniky pro určení kinetiku vazby mezi dvojicí molekul od svého vynálezu v roce 1980 (Liedberg et al., 1983; Cullen et al., 1987). Toto je přičítáno jeho pozoruhodné výhody, včetně real-time kvantitativní kinetické měření s vysokou časové rozlišení, kompatibilita s rozšířenými zařízení, a co je nejdůležitější, její vnitřní funkce label-free (Rothenhäusler a Knoll, 1988; Phillips a Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard a kol., 2014; Yanase a kol., 2014; Su a Wang, 2018). Rané aplikace se většinou zaměřily na charakterizaci a kvantifikaci biomolekulárních interakcí imobilizací čištěných molekul na substráty snímající SPR (zlaté skleněné sklíčka). Takové studie ex situ vyžadovaly nejen postupy čištění náročné na práci, ale také vedly k výsledkům, které nemusí odrážet přirozenou interakci v živých bytostech (Phillips a Cheng, 2007; Homola, 2008). Řízený tím, jak technický pokrok v různých SPR zobrazování (Jaro) systémy a vědecké motivace v single cell imaging a analýza, jak prism a objektivní-založeno Na techniky byly využity na obraz rozložení hmotnosti jednotlivých živých buněk bez nutnosti značení (Wang et al., 2010, 2012a; Yanase a kol., 2010; Yang a kol., 2015; Zhang et al., 2015). Každý z nich má své vlastní zásluhy. Ten má vyšší prostorové rozlišení a první má lepší citlivost. Sledováním času uplynulo SPR obrázky jednotlivých živých buněk během různé typy fyziologické a biologické podněty, důležité prostorové a dynamické informace o buňka-substrát interakce (Giebel et al., 1999), buněčné migrace (Smith et al., 2004), osmotické odpovědi (Wang et al., 2012a), kinetika vazby ligand-receptor (Wang et al., 2012b, 2014), signální dráhy (Deng et al., 2016), dynamika aktivace proteinů (Peng et al., 2018) a živých buněk rakoviny drog odpovědi (Wang et al., 2018) byly získány. Stávající studie například jasně prokázaly, že techniky SPRi byly schopné mapovat hustotu hmoty i integritu membrány na úrovni jedné buňky (Yanase et al ., 2010; Wang a kol., 2012b; Yang a kol., 2015). Obrazový kontrast SPRi pocházel ze subcelulární distribuce indexu lomu, který byl zhruba určen místní hustotou hmotnosti. Vazba specifických protilátek na buněčné membrány, které vyjadřují odpovídající antigeny, nebo stimulaci živých buněk s konkrétní chemické látky, bylo zjištěno, že ke změně hustoty hmoty jednotlivých buněk v heterogenní a dynamicky (Wang et al., 2012a, b). Expozice jednotlivých živých buněk hypertonické roztoky bylo zjištěno, že vyvolávají kontrakci buněk, což naznačuje vynikající integritu buněčných membrán (Wang et al., 2012a). Jak by však fixační a permeabilizační ošetření ovlivnilo SPR obrazy jednotlivých buněk, zůstává nejasné.
V této práci jsme použili doma postavené Na systému průběžně zaznamenávat času uplynulo SPR obrázky z desítek jednotlivých živých buněk, kdy buňky byly postupně léčena 4% PFA roztok a 1% Triton X-100 roztok. Hmotnostní hustota jednotlivých buněk byla stanovena průměrným signálem SPRi. Integrita membrány byla hodnocena vystavením buněk hypertonickému roztoku. Bylo zjištěno, že kromě mírně snížené hmotnostní hustoty o <10%, léčba PFA významně zničila celistvost buněk, jak je naznačeno ztrátou osmotické odpovědi při expozici molekul cukru. Následné zpracování Tritonem X-100 však významně snížilo hmotnostní hustotu o dalších 20%, což naznačuje těžkou destrukci integrity membrány.
Materiály a Metody
Materiály
Dulbecco ‚ s phosphate buffered saline (PBS, Gibco), Sacharóza (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Chemical Reagent Co., Ltd). Všechna činidla byla rozpuštěna v PBS.
Buněčné Kultury
BT-474 buňky byly kultivovány při 37°C s 5% CO2 a 70% relativní vlhkosti v Dubelco ‚s Modified Eagle‘ s Medium (DMEM, Invitrogen) 10% fetální bovinní sérum (FBS, Invitrogen), 100 jednotek/mL penicilinu a 100 µg/mL streptomycinu (Invitrogen). Buňky byly předány, když byly 70-80% konfluentní léčbou 0,25% roztokem trypsinu (Gibco).
Prism na Bázi SPR Zobrazování Nastavení
schéma a fotografie Na systém jsou uvedeny na Obrázcích 1A,B. Na přístroj se skládá hlavně ze tří částí: zdroj světla, optické komponenty a kamery.
• světelný zdroj: 670 nm světelná dioda (L7868-01, Hamamatsu, Japonsko) a montážní zásuvka řízená teplotou (LDM21, Thorlabs, Newton, USA).
• Optické komponenty (Edmund Optics, USA): trojúhelník SF-11 hranol s senzor čip (Ne. 1 sklo BK7 od Fisherbrand), konvergující čočka, polarizátor a Laditelná čočka.
* Kamera: Kamera s nabíjecím zařízením (Pike F032B, Allied Vision Technology, Newburyport, USA).
p-polarizované světlo dopadne na dno zlata potažené sklíčko prizmatem přímo a fotoaparát zachycuje odražené světlo generovat SPR obrázky ve výši 0.828 snímků za sekundu (fps). Při výběru 4x zvětšení v laditelné čočce bylo zorné pole ~2 × 2 mm2.
Sensor Chip Příprava
Každý čip byla promyta 75% ethanolem a deionizovanou vodou (DIW), následuje expozice UV záření po dobu 30 min k odstranění povrchového znečištění a je sterilizovat před každým experimentem. Na Zlatý čip byla umístěna Flexi-Perm křemíková komora (Greiner Bio-One), která sloužila jako buněčná kultura. K dosažení povrchové úpravy před mobilní setí, 100 µg/mL 150 µL kolagenu roztok byl přidán do komory a uchovávány v inkubátoru po dobu 2 h. Čip byl poté opláchnuty deionizovanou vodou dvakrát a DMEM dvakrát před mobilní setí. Aby se buňky v dobré kondici, čip byl inkubován v růstové médium pro 36 h. Růst střední pak byla nahrazena PBS pufru po dobu 10 min pro buňky dosažení rovnováhy.
Flow Systém
gravitace řízený vícekanálový drog perfuzní systém byl aplikován na injekce a přepínat řešení. Průtok je 300 µL/min a řešení přepínání frekvence kolem buňky mohou dosáhnout 1-2 s.
Citlivost Kalibrace
senzor čip byl připraven jak je popsáno v předchozí části bez povrchové úpravy a mobilní setí. Nejprve DIW protékal čipem asi 60 s. Poté byl nahrazen 1% (v/v) roztokem ethanolu za dalších 60 s. Jako jeden z nejčastěji používaných kalibračních roztoků je známo, že 1% ethanol zvyšuje úhel SPR DIW o 60 mDeg. Experimentální výsledky ukázaly, že intenzita SPR se odpovídajícím způsobem zvýšila o 96 iu (obrázek 1C), což odpovídá citlivosti 1,6 ΔI.U/mDeg.
Výsledky a Diskuse
buněčnou membránou (také známý jako cytoplazmatická membrána), která se skládá z lipidové dvojvrstvy s vloženými bílkovin je polopropustná membrána, která obklopuje cytoplazmu buňky. Fixace a permeabilization kroky buněk a tkáňových vzorků, které by mohly změnit propustnost buněčných membrán, jsou důležité postupy, které by mohly určit, úspěchy immunofluorescent nebo imunohistochemické testy. Kromě toho jsou kvalita protilátek a imunoreakční postup dalšími klíčovými determinanty těchto druhů experimentů. SPR má funkci, že obě rezonanční úhel a index lomu (RI), v blízkosti snímací plochy jsou vysoce citlivé na hmotnost hustota povrchové vrstvy v střední-metal rozhraní. Proto by změny hustoty hmoty buňky probíhající na kovovém filmu nebo v jeho blízkosti (~200 nm) mohly být synchronně zaznamenány měřením intenzity odraženého světla. Použitím povrchové plazmonové rezonanční zobrazovací techniky, v této studii jsme zkoumali dynamickou distribuci hustoty buněčné hmoty s vysokým prostorovým a časovým rozlišením a spolehlivou citlivostí v procesech fixace i permeabilizace.
počáteční ztráta hmotnostní hustoty při fixaci buněk PFA
prvním krokem k přípravě biologických vzorků pro imunofluorescenční nebo imunohistochemickou analýzu je obvykle fixace. A nejčastěji používanými fixativy pro tyto druhy testů jsou zesíťovací fixativa, jako je PFA, která působí vytvářením kovalentních chemických vazeb mezi proteiny v buňkách nebo tkáních. Proto jsme zkoumali vliv léčby PFA na hustotu buněčné hmoty. Živé buňky BT-474 byly kultivovány na krytu potaženém zlatým filmem o tloušťce 50 nm. Reprezentativní obraz SPR obsahující jednotlivé buňky je uveden na obrázku 2A. signály SPR každé buňky lze získat výběrem oblasti zájmu v obrazu SPR, která odpovídá morfologii zkoumané buňky. V typickém experimentu, kdy roztok tekl přes buňky, byly získány spr senzorgramy buněk analýzou každé buňky, jak je znázorněno na obrázku 2B (Černá křivka). V předchozím 242 s, PBS pufru bez PFA byl teče přes buňky a základní byla stanovena na stabilitu systému (světelný zdroj a mechanickou stabilitu) a vlastní micromotion signály generované v živých buňkách. Roztok PFA byl poté zaveden ve 242. sekundě, což okamžitě zvýšilo signál SPR kvůli relativně velkému indexu lomu 4% roztoku PFA(bulk effect). Roztok PFA běžel dalších 17 minut, aby se dosáhlo dostatečné fixace. Ve 1237. vteřině byl roztok PFA přepnut zpět na čistý roztok PBS. Kromě snížení hromadné účinek, snížení SPR intenzita jednotlivých buněk byl nalezen při porovnání signálu před (0-242) a po (1237-1545) PFA ošetření a hmotnost ztráta procenta byla získána prostřednictvím dělení snížení hodnoty na původní hodnotu. SPR sensongrams pozadí (přilehlé oblasti bez buněk adheze, modrá křivka) a jedna buňka zachází s PBS během na 1500 s (šedá křivka) jsou také zobrazeny na Obrázku 2B. Statistické analýzy na 30 buněk odhaluje průměrná hustota hmoty ztrátu 10 ± 5%, jak je znázorněno na Obrázku 2C. Bylo také zjištěno, že po PFA léčby, základní kolísání hladiny v SPR signálu byla výrazně snížena o polovinu nebo i dvě třetiny, což naznačuje, že ztráta micromotions a fixaci ošetřených buněk, jak je znázorněno na Obrázku 2D. Takové micromotion signály byly generovány spoustu dynamických buněčných aktivit z různých buněčných komponent, včetně kostry, membrány a organely. Fixace ukončila takové biologické aktivity, a proto eliminovala mikromotační signály, doprovázené významně sníženou fluktuací intenzity senzogramů spr jednotlivých buněk.
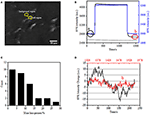
Obrázek 2. Proces fixace buněk. (A) SPRi obraz BT-474 buněk. (B) spr signály jedné buňky (Černá křivka) a pozadí (modrá křivka) podstupující proces přepínání řešení: PBS pufr na 4% PFA na PBS pufr. SPR signál jedné buňky ošetřené PBS během 1500 s (šedá křivka). C) rozložení hmotnostních ztrát 30 jednotlivých buněk. (D) Hladina hluku buňky před (a) a po (b) ošetření PFA.
Osmotického Tlaku v Buňce Fixaci PFA
integrované struktury buněčné membrány, semi-propustné membrány, reguluje homeostázu buňky dosáhnout rovnováhu ve fyziologických osmotický tlak. Bylo také zjištěno, že léčba PFA má schopnost ničit integritu membrány, jak je znázorněno na obrázku 3. Když buffer kolem cílové buňky změnil do 25 mM roztoku sacharózy v <1 s pomocí drog-perfuzní systém, hypertonický buněčné kultury prostředí byla vytvořena. Pro živé buňky, expozice hypertonický roztok vyvolalo řadu fyziologických reakcí na rovnováhu intracelulární a extracelulární osmotický tlak, který byl vyšetřován v detailech v naší předchozí práci (Wang et al., 2012a). V této studii, typický SPR sensorgram jednotlivých fyziologických BT-474 buněk je uveden na Obrázku 3A. Na expozici hypertonického roztoku sacharózy, ošetřené buňky nejprve podstoupil naléhavou zmenšovat, což vede k postupnému nárůstu SPR intenzitu až plató bylo dosaženo. Navrhl zvýšenou hustotu hmoty v důsledku smršťování buněk a subcelulárních složek shromažďujících se směrem ke dnu krytu zlaté kultury. Postupné zvyšování intenzity SPR hypertonickou stimulací je druh fyziologické regulace buněčného osmotického tlaku, což naznačuje fyziologickou integritu buněčné membrány. Když byla integrita membrány zničena, bylo zjištěno, že zavedení hypertonického roztoku sacharózy okamžitě zvyšuje intenzitu SPR v mnohem kratším čase, jak je znázorněno na obrázku 3B. Je to proto, že molekuly cukru volně pronikly do buněk bez odporu polopropustné membrány a okamžitě zvýšily lokální index lomu (objemový efekt). Je jasné, že, zatímco pomalý nárůst SPR intenzita odráží fyziologické osmotický nařízení (viz Obrázek 3A), rychlý skok prokázáno, buněčné membrány byly poškozené, aby umožnila volný vstup malých molekul cukru (Obrázek 3B).

obrázek 3. Osmotické tlakové reakce buněk. A) reakce živé buňky na 25 mM sacharózu. B) odpověď stejné buňky fixované (10 min) na 25 mM sacharózu.
Značné Hustoty Hmoty Ztráty v Buňce Permeabilization Triton
V předchozí fázi fixace, počáteční buněčné hmoty hustota snížil jen o asi 10% (Obrázek 2C). Je rozumné spekulovat, že fixace PFA pouze mírně zničila integritu membrány a zvýšila propustnost malých molekul. Většina intracelulárních složek by měla být stále uložena v cytoplazmatické membráně. Následně jsme studovali vliv typického permeabilizačního detergentu, 1% Triton X-100, na buňky, které byly fixovány PFA po dobu 17 minut dříve. Zástupce SPR sensorgram jednotlivých buněk během expozice 1% Triton X-100 je znázorněno na Obrázku 4A. Zavedení Triton X-100 zvýšena SPR intenzity následuje postupný pokles. První nárůst je důsledkem zvýšení indexu lomu hromadné řešení, a následoval pokles uvedeno postupné ztrátě hustoty hmoty v důsledku buněčné permeabilization. Snížená hmotnostní hustota byla hojnější při porovnání změny intenzity SPR před (0-300 s) a po zavedení detergentu(1 300-1 800 s). Analýza na 30 jednotlivé buňky prokázaly, že Triton X-100 léčby vytvořil značné hustoty hmoty snížit o dalších 20 ± 5% po fixaci PFA, jak je znázorněno na Obrázku 4D a Tabulce 1. Je zřejmé, že detergent Triton X-100 eliminoval mnohem více lipidů buněčné membrány a závažně zničil integritu membrány v tomto permeabilizačním stupni. To vedlo k uvolnění více intracelulárních složek, zejména makromolekul, z buněk. A také to umožňuje velkým molekulám, jako jsou protilátky, dostat se do buňky v další fázi imunoreakce. Ačkoli SPR intenzita malé molekuly vyplavování byl zjištěn po fixaci PFA, permeabilization pomocí Tritonu X-100 pracího prostředku jasně rozpuštěny lipidů a udělal z buňky mnohem více propustná pro pohyb makromolekul v a ven z buňky těla.
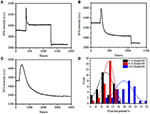
obrázek 4. Křivky hmotnostní ztráty buňky ošetřené různými koncentračními roztoky (A) 1,0%, (B) 0,5%, (C) 0,1%. D) rozložení hmotnostních ztrát 30 jednotlivých buněk za různých podmínek.

Tabulka 1. Souhrn variací ztráty hmotnostní hustoty statistických buněk v různých podmínkách.
bylo zjištěno, že ztráta hmotnostní hustoty je poměrně rychlý proces, ke kterému došlo během několika minut ve fázi permeabilizace (obrázek 4A). Pokles hustoty hmoty zhruba sledoval monotónní rozkladu ve lhůtě, 126 s. Typické sensorgrams jednotlivých buněk pod 0,5 a 0,1% Triton X-100 jsou zobrazeny na Obrázcích 4B,C, resp. Proces permeabilizace se při snižování koncentrace detergentu stal mnohem pomalejším. Trvalo 126, 510, 2 600 s pro tři druhy ošetřených buněk k dokončení ztráty hmotnosti.
Závěr
stručně řečeno, dynamické přerozdělování buněčné hustoty hmoty v obou fixace a permeabilization procesy byly prozkoumány citlivě pomocí hranolu-založeno Na nastavení vysoké prostorové a časové rozlišení. Fixační PFA může zpočátku do jisté míry zvýšit permeabilitu cytoplazmatické membrány, protože její schopnost fixovat buněčné proteiny v membránových i intracelulárních proteinech. To byl podporován (1) snížení hustoty hmoty o ~10% po 17-min fixace ošetření v 4% PFA řešení, a (2) eliminovat buněčné odpovědi na hypertonický roztok, který prokázal, zničení buněčné integrity, aby se malé molekuly jako cukry. Detergent Triton X-100 je lepší, aby fixační PFA v rozpouštění tuků a proto se zvyšuje propustnost buněčné membrány, doprovázející s výraznější ztráty hustoty hmoty v důsledku uvolnění nejen malé molekuly, ale také velké molekuly a možná i některých organel, jako jsou váčky. Kromě toho je rychlost ztráty hmotnosti pozitivně korelována s koncentrací Tritonu X-100. Tyto výsledky poskytly kvantitativní a dynamické chápání vlivu fixace a permeabilization na buněčné hustoty hmoty a membránové integrity, s důsledky pro optimalizaci podmínek pro jednotlivé buňky biologické experimenty, jako immunofluorescent a imunohistochemické testy.
autorské příspěvky
RC, Y-WS a WW navrhly experimenty. Experimenty provedly RC, FZ, ML a XW. RC, Y-WS, a WW napsal papír. RC, FZ, Y-WS a WW diskutovaly o výsledcích a analyzovaly data.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
manipulační editor deklaroval sdílenou příslušnost, i když žádná jiná spolupráce, s autory WW, RC, ML a XW v době kontroly.
poděkování
Děkujeme finanční podpoře Národní Přírodovědné nadace Číny (Grant č. 21522503).
Abadian, P. N., Kelley, C. P., and Goluch, E. D. (2014). Buněčná analýza a detekce pomocí povrchových plazmonových rezonančních technik. Anální. Cheme. 86, 2799–2812. doi: 10.1021/ac500135s
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Cullen, D. C., Brown, R. G. W., a Lowe, C. R. (1987). Detekce tvorby imunokomplexů pomocí povrchové plazmonové rezonance na zlacených difrakčních mřížkách. Biosenzory 3, 211-225. doi: 10.1016/0265-928X(87)85002-2
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Deng, S., Yu, X. Liu, R., Chen, W., a Wang, P. (2016). Dvoukomorové mikrofluidní zařízení pro dlouhodobou detekci živých buněk založené na rezonanci povrchového plasmonu. Biomikrofluidika 10: 044109. doi: 10.1063/1.4960487
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Fox, C. H., Johnson, F. B., tresky Bezvousé, J., Horská, P. P. (1985). Fixace formaldehydu. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Zobrazování kontaktů buněk / substrátů živých buněk pomocí povrchové plazmonové rezonanční mikroskopie. Biophys. J. 76, 509-516. doi: 10.1016/S0006-3495(99)77219-X
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Homola, J. (2008). Povrchové plazmonové rezonanční senzory pro detekci chemických a biologických druhů. Cheme. Rev. 108, 462-493. doi: 10.1021/cr068107d
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Jamur, M. C., a Oliver, C. (2010). „Permeabilization buněčných membrán,“ v Imunocytochemické Metody a Protokoly, eds C. Oliver a M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007/978-1-59745-324-0_9
CrossRef Plný Text | Google Scholar
Joshi, S., a Yu, D. (2017). „Kapitola 8-Imunofluorescence,“ v Základních vědeckých Metod pro Klinické Výzkumníky, eds M. Jalali, F. Y. L. Saldanha, a. M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016/B978-0-12-803077-6.00008-4
CrossRef Plný Text | Google Scholar
Kiernan, J. a. (2018). Formaldehyd, formalin, paraformaldehyd a glutaraldehyd: co jsou a co dělají. Mikroúroveň. Dnes 8, 8-13. doi: 10.1017/S1551929500057060
CrossRef Plný Text | Google Scholar
Koley, D., a Bard, a. J. (2010). Účinky koncentrace Triton X-100 na membránovou permeabilitu jedné HeLa buňky skenovací elektrochemickou mikroskopií (SECM). Proc. Natle. Acad. Věda. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract / CrossRef Full Text / Google Scholar
Liedberg, B., Nylander, C., and Lunström, i. (1983). Rezonance povrchového plazmonu pro detekci a biosenzování plynů. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Plný Text | Google Scholar
Méjard, R., Griesser, H. J., a Thierry, B. (2014). Optické biosenzování pro buněčné studie bez štítků. TrAC Trendy Anální. Cheme. 53, 178–186. doi: 10.1016 / j. trac.2013.08.012
CrossRef Plný Text | Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., Li, J. (2018). Zobrazování odpovědi vyvolané receptorem epidermálního růstového faktoru v jednotlivých živých buňkách bez označení. Analytik 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Phillips, K. S., a Cheng, Q. (2007). Nedávné pokroky v technikách založených na povrchové plazmonové rezonanci pro bioanalýzu. Anální. Bioanal. Cheme. 387, 1831–1840. doi: 10.1007/s00216-006-1052-7
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Rothenhäusler, B., Knoll, W. (1988). Povrch-plazmonová mikroskopie. Příroda 332, 615-617. doi: 10.1038 / 332615a0
CrossRef Full Text / Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. m. (2004). Měření buněčné migrace na povrchově vázaných fibronektinových gradientech. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
PubMed Abstract / CrossRef Full Text / Google Scholar
Su, Y.W., and Wang, W. (2018). Povrchové plazmonové rezonanční snímání: od vyčištěných biomolekul po intaktní buňky. Anální. Bioanal. Cheme. 410, 3943–3951. doi: 10.1007/s00216-018-1008-8
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., and Ranganathan, K. (2012). Chemické a fyzikální základy rutinní fixace formaldehydu. J. Ústní Maxilofac. Patol. 16, 400–405. doi: 10.4103/0973-029X.102496
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Zobrazování bez štítků, detekce, a měření hmotnosti jednotlivých virů pomocí povrchové plazmonové rezonance. Proc. Natle. Acad. Věda. USA 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Wang, W., Wang, a. S., Liu, Q., Wu, J., a Tao, N. (2012a). Mapování interakcí mezi jednotlivými buňkami a substrátem pomocí povrchové plazmonové rezonanční mikroskopie. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Wang, W., Yang, Y., Wang, a. S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Měření a mapování vazebné kinetiky membránových proteinů v jednotlivých živých buňkách bez označení. Adresa. Cheme. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Wang, W., Yin L., Gonzalez-Malerva, L., Wang, a. S., Yu, X., Eaton, S., et al. (2014). In situ kinetika vazby na léčivý receptor v jednotlivých buňkách: kvantitativní studie rezistence na protinádorové léky bez štítků. Věda. Rep. 4: 6609. doi: 10.1038 / srep06609
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
Wang, y., Zhang, s., Xu, T., Zhang, T., Mo, y., Liu, J., et al. (2018). Ultracitlivá a ultrarychlá detekce celé neoznačené odpovědi živých rakovinných buněk na paklitaxel pomocí biosenzoru na bázi grafenu. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j. snb.2018.02.095
CrossRef Full Text / Google Scholar
Yanase, y., Hiragun, T., Ishii, k., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Povrchová plazmonová rezonance pro buněčnou klinickou diagnostiku. Senzory 14, 4948-4959. doi: 10.3390/s140304948
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, J. H., Greaves, M. W., and Hide, m. (2010). Detekce změn indexu lomu v jednotlivých živých buňkách pomocí povrchového plazmonového rezonančního zobrazování. Bioseny. Bioelektron. 26, 674–681. doi: 10.1016 / j. bios.2010.06.065
PubMed Abstract / CrossRef Full Text / Google Scholar
Yang, y., Yu, h., Shan, X., Wang, W., Liu, X., Wang, S. a kol. (2015). Label-free sledování jednotlivých organela dopravy v buňkách s přesností nanometrů pomocí plazmové zobrazovací techniky. Malý 11, 2878-2884. DOI: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, F., Wang, s., Yin, L., Yang, y., Guan, y., Wang, W. a kol. (2015). Kvantifikace úrovně exprese receptoru epidermálního růstového faktoru a kinetiky vazby na buněčných površích pomocí povrchového plazmonového rezonančního zobrazování. Anální. Cheme. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstrakt / CrossRef Plný Text / Google Scholar