Fronteiras da Química
Introdução
a Imunofluorescência é uma técnica poderosa para visualizar a distribuição de biomoléculas específicas dentro de amostras biológicas, tais como células e tecidos (Joshi e Yu, 2017). Em ensaios imunofluorescentes baseados em células típicas, as células aderentes foram incubadas com anticorpos fluorescentes para permitir o reconhecimento e a ligação específicos entre o anticorpo e a molécula-alvo nas células. Após um enxaguamento completo, a amostra foi colocada sob microscópio de fluorescência para obter uma imagem de fluorescência, a partir da qual a distribuição das moléculas alvo foi relatada pelas placas fluorescentes. A fim de facilitar a acessibilidade dos anticorpos às moléculas alvo e inibir a atividade celular inerente, as amostras foram muitas vezes fixas e permeabilizadas antes dos procedimentos de coloração. Elas eram particularmente necessárias quando as moléculas-alvo estavam localizadas dentro do citoplasma. Entre muitos tipos de reagentes, o paraformaldeído (PFA) e Tritão X-100 são provavelmente os mais utilizados para fixação e permeabilização, respectivamente. Despolimerização de PFA produziu moléculas de formaldeído para criar ligações químicas covalentes entre proteínas na amostra. O mecanismo da ação baseou-se na ativação de um dos resíduos de aminoácidos da lisina. A PFA também dissolveu alguns lípidos em membranas celulares que danificaram ligeiramente a integridade da membrana celular (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, como um detergente não-iônico eficaz, poderia dissolver lípidos das membranas celulares, de modo que a membrana celular se tornou mais permeável ao anticorpo fluorescente. O permeabilization passo removido mais lipídios da membrana celular devido ao seu vazia, cabeça hidrofílica grupos que consistem de polioxietileno metades para permitir que grandes moléculas, como anticorpos para dentro da célula (Jamur e Oliver, 2010; Koley e Bard, 2010). A figura 1D mostra uma ilustração esquemática do processo de fixação e permeabilização de células. Apesar do fato de que a fixação e a permeabilização se tornaram procedimentos rotineiros em imunofluorescência e imuno-histoquímica, foram feitos esforços muito raros para esclarecer quantitativamente suas influências na integridade da membrana e densidade de massa celular a nível de uma única célula.
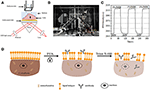
Figura 1. Sistemas de imagem SPR baseados em Prism. A) ilustração esquemática do dispositivo experimental. B) uma fotografia do aparelho. C) curva de calibração da sensibilidade. D) ilustração esquemática da fixação e permeabilização de células.
ressonância de plasma superficial (SPR) tem sido uma técnica popular e poderosa para determinar a cinética de ligação entre um par de moléculas desde a sua invenção em 1980 (Liedberg et al., 1983; Cullen et al., 1987). Isto é atribuído a suas vantagens notáveis, incluindo medição cinética quantitativa em tempo real com altas resoluções temporais, compatibilidade com dispositivos expandidos, e mais importante, sua característica intrínseca de sem etiquetas (Rothenhäusler e Knoll, 1988; Phillips e Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su and Wang, 2018). As primeiras aplicações concentraram-se principalmente na caracterização e quantificação das interacções Biomoleculares, imobilizando moléculas purificadas em substratos sensíveis a SPR (lâminas de vidro revestidas a ouro). Tais estudos ex situ não só exigiram os procedimentos de purificação trabalhosa, mas também levaram a resultados que podem não refletir a interação natural nos seres vivos (Phillips e Cheng, 2007; Homola, 2008). Impulsionado tanto pelo avanço técnico em vários sistemas de imagem SPR (SPRi) e a motivação científica em imagens e análise de células únicas, tanto as técnicas de prism e SPRi objetivas têm sido empregadas para visualizar a distribuição de massa de células vivas únicas sem a necessidade de rotulagem (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Cada um tem os seus próprios méritos. O segundo tem uma maior resolução espacial e o primeiro tem uma maior sensibilidade. Ao monitorizar as imagens SPR caducadas de células vivas únicas durante vários tipos de estímulos fisiológicos e biológicos, informações espaciais e dinâmicas importantes relativas às interacções com o substrato celular (Giebel et al., 1999), cell migrations (Smith et al., 2004), osmotic responses (Wang et al., 2012a), ligand-receptor binding kinetics (Wang et al., 2012b, 2014), signaling pathways (Deng et al., 2016), protein activation dynamics (Peng et al., 2018), e as respostas às células cancerígenas vivas (Wang et al., 2018). Por exemplo, estudos existentes demonstraram claramente que as técnicas SPRi eram capazes de mapear a densidade de massa, bem como a integridade da membrana a nível de uma única célula (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). O contraste de imagem de SPRi veio da distribuição subcelular do índice refrativo, que foi aproximadamente determinado pela densidade de massa local. A ligação de anticorpos específicos à membrana celular que expressava os antigénios correspondentes, ou estimulando as células vivas com produtos químicos específicos, foi encontrada para alterar a densidade de massa de células únicas de uma forma heterogénea e dinâmica (Wang et al., 2012a, b). A exposição de células vivas únicas a soluções hipertônicas foi encontrada para induzir a contração das células, indicando a excelente integridade das membranas celulares (Wang et al., 2012a). No entanto, a forma como os tratamentos de fixação e permeabilização afetariam as imagens SPR de células únicas permanece incerta.no presente trabalho, empregámos um sistema SPRi construído em casa para registar continuamente as imagens SPR de dezenas de células vivas com tempo de lapidação, quando as células foram sucessivamente tratadas por 4% de solução PFA e 1% de solução Triton X-100. A densidade de massa das células únicas foi determinada pelo sinal SPRi médio. A integridade da membrana foi avaliada expondo as células a uma solução hipertónica. Verificou-se que, além da densidade de massa ligeiramente reduzida por <10%, o tratamento com PFA destruiu significativamente a integridade celular, como indicado pela perda de resposta osmótica após a exposição de moléculas de açúcar. O tratamento subsequente por Triton X-100, no entanto, reduziu significativamente a densidade de massa em mais 20%, sugerindo a destruição grave da integridade da membrana.materiais e métodos
materiais
Dulbecco solução salina tampão de fosfato (PBS, Gibco), sacarose (reagente químico Sinopharm Co., Ltd), Triton X-100( Aladdin), Paraformaldeído (Shanghai Lingfeng Chemical Reagent Co., Ltd). Todos os reagentes foram dissolvidos em PBS.
de Cultura de Células
BT-474 células foram cultivadas a 37°C com 5% de CO2 e 70% de umidade relativa do ar em Dubelco Modificado Eagle Medium (DMEM, Invitrogen) com 10% de soro bovino fetal (FBS, Invitrogen), 100 unidades/mL de penicilina e 100 µg/mL de estreptomicina (Invitrogen). As células foram passadas quando eram 70-80% confluentes por tratamento com 0, 25% de solução de tripsina (Gibco).as figuras 1A, B. O aparelho SPRi é constituído principalmente por três partes: fonte luminosa, componentes ópticos e Câmara.
* fonte de luz: um díodo emissor de luz de 670 nm (L7868-01, Hamamatsu, Japão) e um socket de montagem controlado por temperatura (LDM21, Thorlabs, Newton, EUA).
• componentes ópticos (Edmund Optics, USA): um prisma triangular SF-11 com um chip sensor ligado (No. 1 BK7 glass from Fisherbrand), a converging lens, a polarizer, and a tunable lens.
• Camera: Charge-coupled device camera (Pike F032B, Allied Vision Technology, Newburyport, USA).
a luz polarizada p atinge o fundo do vidro revestido a ouro através do prisma diretamente e a câmera captura o feixe refletido para gerar imagens SPR a uma taxa de 0,828 Frame por segundo (fps). Ao escolher a ampliação 4X em uma lente sintonizável, o campo de visão era ~2 × 2 mm2.cada chip foi lavado com 75% de etanol e água desionizada (DIW), seguido de exposição UV durante 30 minutos para remover a contaminação da superfície e esterilizá-los antes de cada experiência. Uma câmara de silicone Flexi-Perm (Greiner Bio-One) foi colocada em cima do chip de ouro para servir como uma cultura de células. Para obter a modificação da superfície antes da sementeira das células, adicionou-se à câmara uma solução de colagénio de 100 µg/mL de 150 µL e manteve-se numa incubadora durante 2 h. O chip foi então enxaguado com água desionizada duas vezes e DMEM duas vezes antes da sementeira das células. Para fazer das células uma boa forma, o chip foi incubado no meio de crescimento por 36 h. O meio de crescimento foi então substituído por solução tampão PBS por 10 minutos para as células alcançarem um equilíbrio.
sistema de fluxo
um sistema de perfusão de fármacos multicanal conduzido por gravidade foi aplicado à injecção e à substituição da solução. O caudal é de 300 µL/min e a taxa de comutação da solução em torno das células pode atingir 1-2 s.
calibração de sensibilidade
foi preparado um chip de sensor conforme descrito na parte anterior, sem modificação da superfície e semeadura celular. Primeiro, DIW fluiu sobre o chip por cerca de 60 s. Em seguida, foi substituído por 1% (v / v) de solução de etanol para outros 60 s. como uma das soluções de calibração mais usadas, 1% de etanol é conhecido para aumentar o ângulo SPR de DIW em 60 mDeg. Os resultados experimentais mostraram que a intensidade de SPR aumentou em 96 U. I. (figura 1C), o que corresponde a uma sensibilidade de 1,6 ΔI.U. / mDeg.
Resultados e Discussão
A membrana celular (também conhecida como membrana citoplasmática), composta por uma bicamada lipídica com o embedded proteínas, é uma membrana semi-permeável que envolve o citoplasma de uma célula. Os passos de fixação e permeabilização das amostras de células e tecidos, que podem alterar a permeabilidade da membrana celular, são procedimentos cruciais que podem determinar os sucessos dos ensaios imunofluorescentes ou imunohistoquímicos. Além disso, a qualidade dos anticorpos e o procedimento de imunoreação são outros determinantes chave para este tipo de experimentos. SPR tem a característica de que tanto o ângulo de ressonância e o índice de refração (RI) perto da superfície sensora são altamente sensíveis à densidade de massa da camada superficial na interface médio-metal. Portanto, as variações de densidade de massa da célula que ocorrem em ou perto da película metálica (~200 nm) podem ser gravadas sincronicamente medindo a intensidade da luz refletida. Ao empregar a técnica de imagiologia por ressonância de plasmon de superfície, exploramos a distribuição dinâmica da densidade de massa celular com altas resoluções espaciais e temporais e sensibilidade confiável em ambos os processos de fixação e permeabilização neste estudo.a primeira etapa para preparar amostras biológicas para a análise imunofluorescente ou imunohistoquímica é geralmente a fixação. E os fixadores mais comumente usados para estes tipos de ensaios são fixadores cruzados como PFA que funcionam gerando ligações químicas covalentes entre proteínas em células ou tecidos. Investigamos, portanto, a influência do tratamento PFA na densidade de massa celular. As células BT-474 vivas foram cultivadas em coberturas revestidas de película dourada com uma espessura de 50 nm. A figura 2A apresenta uma imagem SPR representativa contendo células únicas. os sinais SPR de cada célula podem ser obtidos escolhendo uma região de interesse na imagem SPR que corresponda à morfologia da célula investigada. Em um experimento típico, quando a solução fluía sobre as células, sensorgramas SPR das células foram obtidos analisando cada célula como mostrado na figura 2B (curva preta). Nos 242 s precedentes, o tampão PBS sem PFA estava a fluir sobre as células e a linha de base foi determinada pela estabilidade do sistema (fonte luminosa e estabilidade mecânica) e pelos sinais de micromoção inerentes gerados pelas células vivas. A solução PFA foi então introduzida no 242º segundo, que imediatamente aumentou o sinal SPR por causa do Índice de refração relativamente grande de solução de 4% PFA (efeito bulk). A solução PFA funcionou durante mais 17 minutos para obter fixação suficiente. No segundo 1237, a solução PFA voltou a ser PBS pura. Para além do efeito a granel reduzido, verificou-se uma diminuição na intensidade SPR das células únicas ao comparar os sinais antes (0-242) e depois (1237-1545) dos tratamentos PFA e a percentagem de perda de massa foi obtida dividindo o valor de diminuição para o valor inicial. A figura 2B apresenta igualmente os resultados dos programas SPR relativos ao fundo (uma região adjacente sem aderência celular, Curva Azul) e a uma única célula tratada com PBS durante 1500 s (curva cinzenta). a análise estatística de 30 células revela uma perda média de densidade de massa de 10 ± 5%, como indicado na figura 2C. Constatou-se também que, depois de PFA tratamento, a base de flutuação de nível de SPR sinal foi significativamente reduzido pela metade ou até dois terços, o que sugere a perda de micromotions e fixação das células tratadas como mostrado na Figura 2D. Tais os micromovimentos sinais foram gerados por um bando de dinâmica de atividades celulares de diferentes componentes celulares, incluindo o esqueleto, membranas e organelas. A fixação terminou essas atividades biológicas e, portanto, eliminou os sinais de micromoção, acompanhando com uma flutuação de intensidade significativamente reduzida nos sensogramas SPR de células únicas.
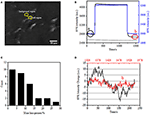
Figura 2. Processo de fixação de células. (A) SPRi image of BT-474 cells. B) sinais SPR de células únicas (curva a preto) e fundo (curva a azul) submetidos a um processo de comutação de soluções: tampão PBS para 4% PFA para tampão PBS. Sinal SPR de célula única tratada com PBS durante 1500 s (curva cinzenta). C) distribuição da perda de massa de 30 células individuais. D) nível de ruído da célula antes (a) e depois (b) do tratamento com PFA.a estrutura integrada da membrana celular, uma membrana semi-permeável, regula a homeostase de uma célula para atingir o equilíbrio na pressão osmótica fisiológica. Verificou-se também que o tratamento com PFA tem a capacidade de destruir a integridade da membrana, tal como demonstrado na Figura 3. Quando o tampão em torno da célula alvo se transformou em solução de sacarose de 25 mM em <1 s através de um sistema de perfusão de medicamentos, foi criado um ambiente de cultura de células hipertónicas. Para as células vivas, a exposição à solução hipertónica desencadeou uma série de respostas fisiológicas para equilibrar a pressão osmótica intracelular e extracelular, que foi investigada em detalhes no nosso trabalho anterior (Wang et al., 2012a). No presente estudo, um típico SPR sensorgram do único fisiológicas BT-474 células é fornecido na Figura 3A. Após a exposição à solução hipertônica solução de sacarose, tratados células em primeiro lugar, foram submetidos a uma pressão diminuir, levando a um aumento gradual da SPR intensidade até um platô foi atingido. Ele sugeriu o aumento da densidade de massa como resultado do encolhimento celular e componentes subcelulares se reunindo em direção ao fundo da cobertura da cultura de ouro. O aumento gradual da intensidade SPR por estimulação hipertônica é um tipo de regulação fisiológica para a pressão osmótica celular, indicando assim a integridade fisiológica da membrana celular. Quando a integridade da membrana foi destruída, verificou-se que a introdução de solução de sacarose hipertónica aumentou imediatamente a intensidade SPR num período muito mais curto, como demonstrado na figura 3B. É porque as moléculas de açúcar penetraram livremente nas células sem resistência da membrana semi-permeável e aumentaram o índice de refração local imediatamente (efeito bulk). É evidente que, embora o aumento lento da intensidade SPR reflectisse a regulação osmótica fisiológica (figura 3A), o salto rápido demonstrou que a membrana celular tinha sido danificada para permitir a entrada livre de pequenas moléculas de açúcar (figura 3B).

Figura 3. Respostas de pressão osmótica das células. A) resposta de uma célula viva a 25 mM de sacarose. B) Resposta da mesma célula fixada (10 min) a 25 mM de sacarose.
perda substancial de densidade de massa na Permeabilização celular por Triton
na fase de fixação anterior, uma densidade inicial de massa celular diminuiu apenas ~10% (figura 2C). É razoável especular que a fixação PFA apenas destruiu ligeiramente a integridade da membrana e aumentou a permeabilidade de pequenas moléculas. A maioria dos componentes intracelulares deve ainda estar abrigada na membrana citoplasmática. Posteriormente estudamos a influência de um detergente típico de permeabilização, 1% Triton X-100, em células que foram fixadas com PFA por 17 minutos previamente. A figura 4A mostra um sensorgrama de SPR representativo de células únicas durante a exposição a 1% de Triton X-100. a introdução de Triton X-100 aumentou a intensidade SPR seguida por uma diminuição gradual. O primeiro aumento é uma consequência do aumento do Índice de refração da solução a granel, e a diminuição seguida indicou a perda gradual na densidade de massa devido à permeabilização celular. A densidade de massa reduzida foi mais abundante ao comparar a variação da intensidade de SPR antes (0-300 s) e após a introdução do detergente (1.300–1.800 s). A análise em 30 células individuais demonstrou que o tratamento com Triton X-100 provocou uma diminuição substancial da densidade de massa em mais 20 ± 5% após a fixação de PFA, tal como demonstrado na figura 4D e no quadro 1. É claro que o detergente Triton X-100 eliminou muito mais lípidos da membrana celular e destruiu severamente a integridade da membrana neste estágio de permeabilização. Isto resultou em mais componentes intracelulares, especialmente macromoléculas, para a libertação das células. E também, isso permite que grandes moléculas como anticorpos entrem na célula no próximo estágio de imunoreação. Embora SPR intensidade de pequenas moléculas de lixiviação foi detectado depois de PFA fixação, permeabilization usando o Triton X-100 detergente claramente solubilizados lipídios e fez a células muito mais permeável aos movimentos de macromoléculas dentro e fora da célula do corpo.
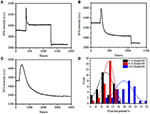
Figura 4. Curvas de perda de massa de células tratadas com diferentes soluções de concentração (a) 1, 0%, (b) 0, 5%, (C) 0, 1%. D) distribuição da perda de massa de 30 células individuais em condições diferentes.

a Tabela 1. Um resumo das variações na perda de densidade de massa das células estatísticas em diferentes condições.
verificou-se que a perda de densidade de massa é um processo bastante rápido, que ocorreu em poucos minutos na fase de permeabilização (figura 4A). A diminuição da densidade de massa seguiu aproximadamente um decaimento monotônico dentro de um período de tempo de 126 S. Os sensorgramas típicos de células únicas com menos de 0,5 e 0,1% de Tritão X-100 são exibidos nas figuras 4B,C, respectivamente. O processo de permeabilização tornou-se muito mais lento ao reduzir a concentração de detergentes. Foram precisos 126, 510, 2.600 s para os três tipos de células tratadas para terminar a perda de massa.
Conclusion
In summary, dynamic redistribution of cellular mass density in both fixation and permeabilization processes have been explored sensitively by using prism-based SPRi setup with high spatial and temporal resolutions. O PFA fixativo pode inicialmente aumentar a permeabilidade da membrana citoplásmica em certa medida porque a sua capacidade de fixação de proteínas celulares tanto na membrana como nas proteínas intra-celulares. Foi apoiado por (1) a diminuição da densidade de massa em ~10% após um tratamento de fixação de 17-minutos em solução de 4% PFA, e (2) a resposta celular eliminada a solução hipertônica, que demonstrou a destruição da integridade celular para pequenas moléculas como açúcares. Detergente Triton X-100 é superior ao fixador PFA em solubilizing lipídios e, portanto, aumentando a permeabilidade da membrana da célula, que acompanha com mais perda substancial na densidade de massa devido à liberação não apenas de pequenas moléculas, mas também grandes moléculas e, possivelmente, algumas organelas, tais como vesículas. Além disso, a taxa de perda de massa está positivamente correlacionada com a concentração de Triton X-100. Estes resultados forneceram entendimentos quantitativos e dinâmicos sobre a influência da fixação e permeabilização na densidade de massa celular e integridade da membrana, com implicações para a otimização das condições para experiências biológicas de células únicas, tais como ensaios imunofluorescentes e imunohistoquímicos.
contribuições dos autores
RC, Y-WS, e WW desenharam as experiências. RC, FZ, ML e XW realizaram os experimentos. RC, Y-WS, e WW escreveram o artigo. RC, FZ, Y-WS, e WW discutiram os resultados e analisaram os dados.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
O editor de manuseio declarou uma afiliação compartilhada, embora nenhuma outra colaboração, com os autores WW, RC, ML e XW no momento da revisão.agradecemos o apoio financeiro da Fundação Nacional de Ciência Natural da China (Grant No. 21522503).
Abadian, P. N. Em 2006, foi estimada uma população de 497, um decréscimo de 4 (-4.7%). Análise e detecção celular utilizando técnicas de ressonância de plasmões de superfície. Anal. Chem. 86, 2799–2812. doi: 10.1021 / ac500135s PubMed Abstract | CrossRef Full Text/Google Scholar
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Detecção de formação imunocomplexa por ressonância de plasma superficial em grelhas de difração revestidas de ouro. Biosensors 3, 211-225. doi: 10.1016 / 0265-928X (87)85002-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., and Wang, P. (2016). Um dispositivo microfluídico de dois compartimentos para a detecção de células vivas a longo prazo, com base na ressonância de plasma superficial. Biomicrofluoridics 10: 044109. doi: 10.1063 / 1.4960487 PubMed Abstract | CrossRef Full Text/Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Fixação de formaldeído. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Imagem de contacto celular / substrato de células vivas com microscopia de ressonância de plasmon superficial. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99) 77219-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Homola, J. (2008). Sensores de ressonância de plasmon de superfície para detecção de espécies químicas e biológicas. Chem. Rev. 108, 462-493. doi: 10.1021 / cr068107d
PubMed Abstract | CrossRef Full Text/Google Scholar
Jamur, M. C., and Oliver, C. (2010). “Permeabilization of cell membranes,” in Immunocitochemical Methods and Protocols, eds C. Oliver and M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef Full Text/Google Scholar
Joshi, S., and Yu, D. (2017). “Chapter 8-Immunofluorescence,” in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha, and M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Full Text | Google Scholar
Kiernan, J. A. (2018). Formaldeído, formalina, paraformaldeído e glutaraldeído: o que são e o que fazem. Micro. Hoje 8, 8-13. Doi: 10.1017/S1551929500057060
CrossRef Full Text | Google Scholar
Koley, D., and Bard, A. J. (2010). Triton X-100 efeitos de concentração na permeabilidade da membrana de uma única célula HeLa por varrimento de microscopia electroquímica (SECM). Procedimento. Natl. Acad. Ciência. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract | CrossRef Full Text | Google Scholar
Liedberg, B., Nylander, C., and Lundström, I. (1983). Ressonância de plasma superficial para detecção de gases e biossensagem. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Texto Completo | Google Scholar
Méjard, R., Griesser, H. J., e Thierry, B. (2014). Biosensing ópticos para estudos celulares sem rótulo. TrAC Trends Anal. Chem. 53, 178–186. D. O. I.: 10.1016 / j. trac.2013.08.012
CrossRef Full Text | Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Imagem sem rótulo da resposta induzida pelo receptor do factor de crescimento epidérmico em células vivas. Analista 143, 5264-5270. doi: 10.1039 / C8AN01534A
PubMed Abstract | CrossRef Full Text/Google Scholar
Phillips, K. S., and Cheng, Q. (2007). Avanços recentes em técnicas de ressonância de plasmon de superfície para Bioanálise. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text/Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Microscopia de plasma superficial. Nature 332, 615-617. doi: 10.1038/332615a0
CrossRef Texto Completo | Google Scholar
Smith, J. T.), Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. M. (2004). Medição da migração celular nos gradientes de fibronectina ligados à superfície. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763 PubMed Abstract | CrossRef Full Text/Google Scholar
Su, Y. W., and Wang, W. (2018). Sensor de ressonância de plasmões de superfície: desde biomoléculas purificadas até células intactas. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007/s00216-018-1008-8
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Thavarajah, R., Mudimbaimannar, V. K. Isabel , J., Rao, U. K., e Ranganathan, K. (2012). Fundamentos químicos e físicos da fixação de formaldeído de rotina. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103/0973-029X.102496
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J.; Li, J., et al. (2010). Imagiologia livre de etiquetas, detecção e medição da massa de vírus isolados por ressonância de plasmões de superfície. Procedimento. Natl. Acad. Ciência. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Mapeamento das interacções com substrato monocelular por microscopia de ressonância de plasmon superficial. Langmuir 28, 13373-13379. Doi: 10.1021/la301712h
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Medição e mapeamento sem etiqueta da cinética de ligação das proteínas de membrana em células vivas únicas. Conversao. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ drug-receptor binding kinetics in single cells: a quantitative label-free study of anti-tumoral drug resistance. Ciência. Rep. 4:6609. doi: 10.1038/srep06609
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Detecção Ultra-sensível e ultra-rápida de todas as respostas de células vivas não marcadas ao paclitaxel com um biossensor baseado em grafeno. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j. snb.2018.02.095
CrossRef Texto Completo | Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Ressonância de plasmon de superfície para diagnóstico clínico baseado em células. Sensores 14, 4948-4959. doi: 10.3390/s140304948
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., and Hide, M. (2010). Detecção de alterações do Índice de refracção em células vivas individuais por meio de imagiologia por ressonância de plasmões superficiais. Biosens. Bioelectron. 26, 674–681. doi: 10.1016 / j. bios.2010.06.065
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Rastreamento sem etiquetas de transporte de organela única em células com precisão nanométrica usando uma técnica de imagem plasmónica. Pequeno 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Quantificação do nível de expressão do receptor do factor de crescimento epidérmico e cinética de ligação em superfícies celulares por imagiologia de ressonância de plasmónio superficial. Anal. Chem. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstract | CrossRef Full Text | Google Scholar