gränser i kemi
- introduktion
- material och metoder
- Material
- cellodling
- Prism-baserade SPR-Avbildningsinställningar
- Sensorchipberedning
- flödessystem
- Känslighetskalibrering
- resultat och diskussion
- Initial Massdensitetsförlust vid Cellfixering med PFA
- osmotiskt Tryckrespons vid Cellfixering med PFA
- betydande Massdensitetsförlust i Cellpermeabilisering med Triton
- slutsats
- Författarbidrag
- intressekonflikt uttalande
- bekräftelser
introduktion
immunofluorescens är en kraftfull teknik för att visualisera fördelningen av specifika biomolekyler inom biologiska prover såsom celler och vävnader (Joshi och Yu, 2017). I typiska cellbaserade immunofluorescerande analyser inkuberades vidhäftande celler med fluorescerande antikropp för att möjliggöra specifik igenkänning och bindning mellan antikroppen och målmolekylen i cellerna. Efter noggrann sköljning placerades provet under fluorescensmikroskop för att erhålla en fluorescensbild, från vilken fördelningen av målmolekyler rapporterades av de fluorescerande taggarna. För att underlätta tillgängligheten av antikropp till målmolekylerna och för att hämma den inneboende cellulära aktiviteten fixerades proverna ofta och permeabiliserades före färgningsprocedurerna. De var särskilt nödvändiga när målmolekylerna var belägna i cytoplasman. Bland många typer av reagens är paraformaldehyd (PFA) och Triton X-100 förmodligen de mest använda för fixering respektive permeabilisering. Depolymerisation av PFA producerade formaldehydmolekyler för att skapa kovalenta kemiska bindningar mellan proteiner i provet. Verkningsmekanismen förlitade sig på aktiveringen av en av aminosyraresterna lysin. PFA löste också vissa lipider i cellulära membran som lätt skadade cellmembranets integritet (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, som ett effektivt icke-joniskt tvättmedel, kunde lösa lipider från cellmembran, så att cellmembranet blev mer permeabelt för den fluorescerande antikroppen. Permeabiliseringssteget avlägsnade mer cellulära membranlipider på grund av dess oladdade, hydrofila huvudgrupper som består av polyoxietylendelar för att tillåta stora molekyler som antikroppar att komma in i cellen (Jamur och Oliver, 2010; Koley och Bard, 2010). En schematisk illustration av cellfixering och permeabiliseringsprocess visas i Figur 1D. Trots det faktum att fixering och permeabilisering har blivit rutinprocedurer i immunofluorescens och immunhistokemi, har ganska sällsynta ansträngningar gjorts för att kvantitativt klargöra deras påverkan på membranintegriteten och cellulär massdensitet vid encellsnivå.
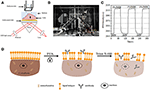
Figur 1. Prism-baserade SPR-avbildningsinställningar. (A) schematisk illustration av den experimentella set-up. B) ett fotografi av apparaten. C) kalibreringskurva för känslighet. (D) schematisk illustration av cellfixering och permeabilisering.
Ytplasmonresonans (SPR) har varit en populär och kraftfull teknik för att bestämma bindnings kinetiken mellan ett par molekyler sedan dess uppfinning på 1980-talet (Liedberg et al., 1983; Cullen et al., 1987). Detta beror på dess anmärkningsvärda fördelar, inklusive kvantitativ kinetisk mätning i realtid med höga temporala upplösningar, kompatibilitet med utökade enheter, och viktigast av allt, dess inneboende egenskap hos etikettfri (Rothenh Kambodjusler och Knoll, 1988; Phillips och Cheng, 2007; Homola, 2008; Abadian et al., 2014; M., 2014; Yanase et al., 2014; Su och Wang, 2018). Tidiga applikationer fokuserade mest på att karakterisera och kvantifiera biomolekylära interaktioner genom att immobilisera renade molekyler på SPR-avkänningssubstrat (guldbelagda glasskivor). Sådana ex situ-studier krävde inte bara de arbetsintensiva reningsprocedurerna utan ledde också till resultat som kanske inte återspeglar den naturliga interaktionen hos levande varelser (Phillips och Cheng, 2007; Homola, 2008). Driven av både den tekniska utvecklingen i olika SPR-avbildningssystem (SPRi) och den vetenskapliga motivationen i enkelcellsavbildning och analys har både prisma och objektbaserade SPRi-tekniker använts för att avbilda massfördelningen av enskilda levande celler utan behov av märkning (Wang et al., 2010, 2012A; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Var och en har sina egna fördelar. Den senare har högre rumsliga upplösningar och den förra har en bättre känslighet. Genom att övervaka de tidsfördröjda SPR-bilderna av enskilda levande celler under olika typer av fysiologiska och biologiska stimuleringar, viktig rumslig och dynamisk information om cell-substratinteraktioner (Giebel et al., 1999), cellmigrationer (Smith et al., 2004), osmotiska svar (Wang et al., 2012A), ligand-receptorbindande kinetik (Wang et al., 2012b, 2014), signalvägar (Deng et al., 2016), proteinaktiveringsdynamik (Peng et al., 2018), och levande cancercellsläkemedelssvar (Wang et al., 2018) har erhållits. För instanser har befintliga studier tydligt visat att SPRi-tekniker var kapabla för att kartlägga massdensiteten såväl som membranintegriteten vid enkelcellsnivå (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). Bildkontrasten för SPRi kom från den subcellulära fördelningen av brytningsindex, vilket grovt bestämdes av den lokala massdensiteten. Bindning av specifika antikroppar på cellmembranet som uttryckte motsvarande antigener, eller stimulering av levande celler med särskilda kemikalier, befanns förändra massdensiteten hos enskilda celler på ett heterogent och dynamiskt sätt (Wang et al., 2012A, b). Exponering av enstaka levande celler för hypertoniska lösningar befanns inducera sammandragning av celler, vilket indikerar cellmembranens utmärkta integritet (Wang et al., 2012a). Hur fixerings-och permeabiliseringsbehandlingarna skulle påverka SPR-bilderna av enskilda celler är dock oklart.
i det nuvarande arbetet använde vi ett hembyggt SPRi-system för att kontinuerligt registrera de tidsfördröjda SPR-bilderna av tiotals enskilda levande celler när cellerna successivt behandlades med 4% PFA-lösning och 1% Triton X-100-lösning. Massdensiteten hos enskilda celler bestämdes av den genomsnittliga SPRi-signalen. Membranintegriteten utvärderades genom att utsätta cellerna för hypertonisk lösning. Det visade sig att, förutom den något reducerade massdensiteten med <10%, förstörde PFA-behandling signifikant cellintegriteten, vilket indikeras av förlusten av osmotiskt svar vid exponering av sockermolekyler. Efterföljande behandling av Triton X-100 minskade emellertid signifikant massdensiteten med ytterligare 20%, vilket tyder på den allvarliga förstörelsen av membranintegriteten.
material och metoder
Material
dulbeccos fosfatbuffrade saltlösning (PBS, Gibco), sackaros (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Chemical Reagent Co., Ltd). Alla reagenser löstes i PBS.
cellodling
BT-474-celler odlades vid 37 CCG med 5% CO2 och 70% relativ fuktighet i Dubelcos modifierade Eagle ’ s Medium (DMEM, Invitrogen) med 10% fetalt bovint serum (FBS, Invitrogen), 100 enheter/mL penicillin och 100 CCG/mL streptomycin (Invitrogen). Celler passerade när de var 70-80% sammanflytande genom behandling med 0,25% trypsinlösning (Gibco).
Prism-baserade SPR-Avbildningsinställningar
ett schematiskt diagram och ett foto av SPRi-systemet presenteras i figurerna 1A,B. SPRi-apparaten består huvudsakligen av tre delar: ljuskälla, optiska komponenter och kamera.
• ljuskälla: en 670 nm ljusdiod (L7868-01, Hamamatsu, Japan) och ett temperaturstyrt monteringsuttag (LDM21, Thorlabs, Newton, USA).
• optiska komponenter (Edmund Optics, USA): en triangel SF-11 prisma med ett sensorchip på (nr. 1 BK7 glas från Fisherbrand), en konvergerande lins, en polarisator och en avstämbar lins.
• kamera: Laddningskopplad enhetskamera (Pike F032B, Allied Vision Technology, Newburyport, USA).
det p-polariserade ljuset träffar botten av den guldbelagda glasrutschbanan genom prismen direkt och kameran fångar den reflekterade strålen för att generera SPR-bilder med en hastighet av 0,828 bild per sekund (fps). När du väljer 4x förstoring i en avstämbar lins, synfältet var ~2 2 mm 2 oc.
Sensorchipberedning
varje chip tvättades med 75% etanol och avjoniserat vatten (DIW), följt av UV-exponering i 30 minuter för att avlägsna ytföroreningen och sterilisera dem före varje experiment. En Flexi-Perm-kiselkammare (Greiner Bio-One) placerades ovanpå guldchipet för att fungera som en cellkulturbrunn. För att uppnå ytmodifieringen före cellsådd tillsattes en kollagenlösning på 100 oc/mL 150 oc till kammaren och hölls i en inkubator i 2 timmar. chipet sköljdes sedan med avjoniserat vatten två gånger och DMEM två gånger före cellsådd. För att göra cellerna en bra form inkuberades chipet i tillväxtmediet i 36 h. tillväxtmediet ersattes sedan med PBS-buffertlösning i 10 min för celler som uppnådde en balans.
flödessystem
ett gravitationsdrivet flerkanaligt läkemedelsperfusionssystem applicerades på injektion och byte av lösningen. Flödeshastigheten är 300 oc / min och lösningsomkopplingshastigheten runt cellerna kan nå 1-2 s.
Känslighetskalibrering
ett sensorchip bereddes enligt beskrivningen i föregående del utan ytmodifiering och cellsådd. Först flödade DIW över chipet i cirka 60 s. sedan ersattes den med 1% (v/v) etanollösning under ytterligare 60 s. som en av de vanligaste kalibreringslösningarna är 1% etanol känt för att öka SPR-vinkeln för DIW med 60 mDeg. Experimentella resultat visade att SPR-intensiteten i enlighet därmed ökade med 96 Ie (figur 1C), vilket motsvarar en känslighet på 1,6 ACI.U. / mDeg.
resultat och diskussion
cellmembranet (även känt som cytoplasmiskt membran), som består av ett lipid-dubbelskikt med inbäddade proteiner, är ett halvgenomsläppligt membran som omsluter cytoplasman i en cell. Fixerings-och permeabiliseringsstegen hos celler och vävnadsprover, som kan förändra cellmembranets permeabilitet, är avgörande procedurer som kan bestämma framgångarna för immunofluorescerande eller immunhistokemiska analyser. Utöver detta är antikroppskvaliteten och immunoreaktionsförfarandet andra viktiga determinanter för dessa typer av experiment. SPR har funktionen att både resonansvinkeln och brytningsindexet (ri) nära avkänningsytan är mycket känsliga för ytskiktets massdensitet i mellanmetallgränssnittet. Därför kan cellens massdensitetsvariationer som äger rum på eller nära metallfilmen (~200 nm) registreras synkront genom att mäta intensiteten hos det reflekterade ljuset. Genom att använda ytplasmonresonansbildningsteknik undersökte vi dynamisk fördelning av cellulär massdensitet med höga rumsliga och temporala upplösningar och pålitlig känslighet i både fixerings-och permeabiliseringsprocesser i denna studie.
Initial Massdensitetsförlust vid Cellfixering med PFA
det första steget för att förbereda biologiska prover för immunofluorescerande eller immunhistokemisk analys är vanligtvis fixering. Och de vanligaste fixeringsmedlen för dessa typer av analyser är tvärbindande fixeringsmedel som PFA som fungerar genom att generera kovalenta kemiska bindningar mellan proteiner i celler eller vävnader. Vi undersökte därför påverkan av PFA-behandling på cellulär massdensitet. Levande BT-474-celler odlades på täckglas belagd med guldfilm med en tjocklek av 50 nm. En representativ SPR-bild som innehåller enstaka celler tillhandahålls i Figur 2a.SPR-signaler för varje cell kan erhållas genom att välja en region av intresse i SPR-bilden som matchar morfologin hos den undersökta cellen. I ett typiskt experiment, när lösningen flödade över cellerna, erhölls SPR-sensorgram av cellerna genom att analysera varje cell som visas i Figur 2B (svart kurva). Under de föregående 242 s flödade PBS-buffert utan PFA över cellerna och baslinjen bestämdes av systemstabiliteten (ljuskälla och mekanisk stabilitet) och de inneboende mikromotionssignalerna genererade av de levande cellerna. PFA-lösning infördes sedan vid 242: e sekunden, vilket omedelbart ökade SPR-signalen på grund av det relativt stora brytningsindexet för 4% PFA-lösning (bulkeffekt). PFA-lösningen sprang i ytterligare 17 minuter för att uppnå tillräcklig fixering. Vid den 1237: e sekunden byttes PFA-lösningen tillbaka till ren PBS-lösning. Förutom den reducerade bulkeffekten hittades en minskning av SPR-intensiteten hos enskilda celler vid jämförelse av signalerna före (0-242) och efter (1237-1545) erhölls PFA-behandlingarna och massförlustprocenten genom att dividera minskningsvärdet till initialvärdet. Spr-sensongrammen i bakgrunden (en intilliggande region utan celladhesion, blå kurva) och en enda cell behandlad med PBS under 1,500 s (grå kurva) visas också i Figur 2B. statistisk analys på 30 celler avslöjar en genomsnittlig massdensitetsförlust på 10 xnumx 5% som visas i Figur 2C. Det visade sig också att, efter PFA-behandling, baslinjefluktuationsnivån i SPR-signalen reducerades signifikant med hälften eller till och med två tredjedelar, vilket tyder på förlust av mikromotioner och fixering av de behandlade cellerna som visas i Figur 2D. sådana mikromotionssignaler genererades av en massa dynamiska cellulära aktiviteter från olika cellkomponenter inklusive skelett, membran och organeller. Fixeringen avslutade sådana biologiska aktiviteter och eliminerade därför mikromotionssignalerna, åtföljande med en signifikant minskad intensitetsfluktuation i SPR-sensogrammen hos enskilda celler.
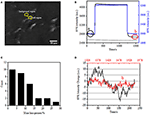
Figur 2. Cellfixeringsprocess. (A) SPRi-bild av BT-474-celler. (B) SPR-signaler för enstaka celler (svart kurva) och bakgrund (blå kurva) som genomgår en lösningsomkopplingsprocess: PBS-buffert till 4% PFA till PBS-buffert. SPR-signal av singelcell behandlad med PBS under 1500 s (grå kurva). (C) Massförlustfördelning av 30 enskilda celler. (D) cellens ljudnivå före (a) och efter (b) PFA-behandling.
osmotiskt Tryckrespons vid Cellfixering med PFA
den integrerade strukturen hos cellmembranet, ett halvgenomsläppligt membran, reglerar homeostasen hos en cell för att nå balans i fysiologiskt osmotiskt tryck. PFA-behandling befanns också ha förmågan att förstöra membranintegriteten som visas i Figur 3. När bufferten runt målcellen ändrades till 25 mM sackaroslösning i <1 s via ett läkemedelsperfusionssystem skapades en hypertonisk cellodlingsmiljö. För levande celler utlöste exponeringen för hypertonisk lösning en serie fysiologiska svar för att balansera det intracellulära och extracellulära osmotiska trycket, vilket har undersökts i detaljer i vårt tidigare arbete (Wang et al., 2012a). I denna studie tillhandahålls ett typiskt SPR-sensorgram av enskilda fysiologiska BT-474-celler i figur 3a. vid exponering för hypertonisk sackaroslösning genomgick behandlade celler först en pressande krympning, vilket ledde till en gradvis ökning av SPR-intensiteten tills en platå uppnåddes. Det föreslog den ökade massdensiteten som ett resultat av cellkrympning och subcellulära komponenter som samlades mot botten av guldkulturens täckglas. Den gradvisa ökningen av SPR-intensiteten genom hypertonisk stimulering är en slags fysiologisk reglering för cellulärt osmotiskt tryck, vilket indikerar cellmembranets fysiologiska integritet. När membranintegriteten förstördes befanns införandet av hypertonisk sackaroslösning omedelbart öka SPR-intensiteten på mycket kortare tid, såsom visas i figur 3b. Det beror på att sockermolekylerna fritt trängde in i cellerna utan motstånd från det halvgenomsläppliga membranet och ökade det lokala brytningsindexet omedelbart (bulkeffekt). Det är uppenbart att medan den långsamma ökningen av SPR-intensiteten återspeglade den fysiologiska osmotiska regleringen (figur 3A), visade det snabba hoppet att cellmembranet hade skadats för att möjliggöra fri inträde av små sockermolekyler (figur 3b).

Figur 3. Osmotiska tryckreaktioner av celler. A) svar från en levande cell på 25 mm sackaros. B) svar från samma cell fixerad (10 min) till 25 mM sackaros.
betydande Massdensitetsförlust i Cellpermeabilisering med Triton
i föregående fixeringssteg minskade en initial cellmassdensitet bara med ~10% (figur 2C). Det är rimligt att spekulera i att PFA-fixeringen endast förstörde membranintegriteten något och ökade permeabiliteten hos små molekyler. Majoriteten av de intracellulära komponenterna bör fortfarande hysas i det cytoplasmatiska membranet. Vi studerade därefter påverkan av ett typiskt permeabiliseringsmedel, 1% Triton X-100, på celler som tidigare har fixats med PFA i 17 minuter. Ett representativt SPR-sensorgram av enskilda celler under exponering för 1% Triton X-100 visas i Figur 4A. introduktionen av Triton X-100 ökade SPR-intensiteten följt av en gradvis minskning. Den första ökningen är en följd av ökning brytningsindex för bulklösning, och den efterföljande minskningen indikerade den gradvisa förlusten i massdensiteten på grund av cellpermeabiliseringen. Den reducerade massdensiteten var rikligare när man jämförde spr-intensitetsförändringen före (0-300 s) och efter införandet av tvättmedel (1 300-1 800 s). Analys på 30 enskilda celler visade att Triton X-100-behandlingen skapade en betydande massdensitetsminskning med ytterligare 20 5% av 5% efter PFA-fixering som visas i Figur 4D och Tabell 1. Det är uppenbart att tvättmedlet Triton X-100 eliminerade mycket mer cellulära membranlipider och förstörde membranintegriteten allvarligt i detta permeabiliseringssteg. Detta resulterade i att fler intracellulära komponenter, särskilt makromolekyler, släpptes från cellerna. Och detta tillåter också stora molekyler som antikroppar att komma in i cellen i nästa immunoreaktionssteg. Även om spr-intensiteten hos små molekyler urlakning detekterades efter PFA-fixering, permeabilisering genom användning av Triton X-100 tvättmedel klart solubiliserade lipider och gjorde cellerna mycket mer permeabla för rörelserna av makromolekyler in och ut ur cellkroppen.
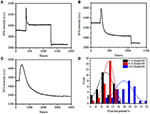
Figur 4. Massförlustkurvor för cell behandlade med olika koncentrationslösningar (a) 1,0%, (B) 0,5%, (C) 0,1%. (D) Massförlustfördelning av 30 enskilda celler under olika förhållanden.

tabell 1. En sammanfattning av variationer i massdensitetsförlust av statistikceller under olika förhållanden.
det visade sig att förlusten i massdensitet är en ganska snabb process som inträffade om några minuter i permeabiliseringsstadiet (figur 4A). Minskningen i massdensitet följde ungefär ett monotont sönderfall inom en tidsperiod av 126 s. de typiska sensorgrammen av enstaka celler under 0,5 och 0,1% Triton X-100 visas i figurerna 4B,C, respektive. Permeabiliseringsprocessen blev mycket långsammare när koncentrationen av tvättmedel reducerades. Det tog 126, 510, 2600 s för de tre typerna av de behandlade cellerna för att avsluta massförlust.
slutsats
Sammanfattningsvis har dynamisk omfördelning av cellulär massdensitet i både fixerings-och permeabiliseringsprocesser undersökts känsligt genom att använda prismbaserad SPRi-inställning med höga rumsliga och temporala upplösningar. Fixativ PFA kan initialt öka permeabiliteten hos cytoplasmiskt membran till viss del eftersom dess förmåga att fixera cellulära proteiner i både membran och intracellulära proteiner. Det stöddes av (1) den minskade massdensiteten med ~10% efter en 17-min fixeringsbehandling i 4% PFA-lösning och (2) det eliminerade cellulära svaret på hypertonisk lösning, vilket visade förstörelsen av cellulär integritet till små molekyler som sockerarter. Tvättmedel Triton X-100 är överlägsen fixativ PFA i solubiliserande lipider och ökar därför cellmembranpermeabiliteten, åtföljande med den mer betydande förlusten i massdensiteten på grund av frisättningen av inte bara små molekyler utan också stora molekyler och eventuellt vissa organeller såsom vesiklar. Dessutom är massförlusthastigheten positivt korrelerad med Triton X-100-koncentrationen. Dessa resultat gav kvantitativa och dynamiska förståelser om påverkan av fixering och permeabilisering på cellulär massdensitet och membranintegritet, med konsekvenser för optimering av betingelserna för enskilda cellbiologiska experiment, såsom immunofluorescerande och immunhistokemiska analyser.
Författarbidrag
RC, Y-WS och WW utformade experimenten. RC, FZ, ML och XW utförde experimenten. RC, Y-WS och WW skrev tidningen. RC, FZ, Y-WS och WW diskuterade resultaten och analyserade data.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
hanteringsredaktören förklarade en delad anslutning, men inget annat samarbete, med författarna WW, RC, ML och XW vid granskningstillfället.
bekräftelser
Vi tackar ekonomiskt stöd från National Natural Science Foundation of China (bidrag nr 21522503).
Abadian, P. N., Kelley, C. P. och Goluch, E. D. (2014). Cellanalys och detektion med användning av ytplasmonresonanstekniker. Anal. Chem. 86, 2799–2812. doi: 10.1021 / ac500135s
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Cullen, DC, Brown, RGW och Lowe, Cr (1987). Detektion av immunkomplexbildning via ytplasmonresonans på guldbelagda diffraktionsgaller. Biosensorer 3, 211-225. doi: 10.1016 / 0265-928X (87)85002-2
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., och Wang, P. (2016). En mikrofluidisk anordning med två avdelningar för långvarig levande celldetektering baserad på ytplasmonresonans. Biomikrofluidik 10:044109. doi: 10.1063 / 1.4960487
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J. och Roller, P. P. (1985). Formaldehyd fixering. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177 / 33.8.3894502
PubMed Abstrakt / CrossRef fulltext/Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Avbildning av cell / substratkontakter av levande celler med ytplasmonresonansmikroskopi. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495(99) 77219-x
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Homola, J. (2008). Ytplasmonresonanssensorer för detektering av kemiska och biologiska arter. Chem. Rev. 108, 462-493. doi: 10.1021 / cr068107d
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Jamur, mc, och Oliver, C. (2010). ”Permeabilisering av cellmembran”, i immunocytokemiska metoder och protokoll, eds C. Oliver och M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef fulltext / Google Scholar
Joshi, S. och Yu, D. (2017). ”Kapitel 8-immunofluorescens”, i grundläggande Vetenskapsmetoder för kliniska forskare, eds M. Jalali, F. Y. L. Saldanha och M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef fulltext / Google Scholar
Kiernan, J. A. (2018). Formaldehyd, formalin, paraformaldehyd och glutaraldehyd: vad de är och vad de gör. Micros. Idag 8, 8-13. doi: 10.1017 / S1551929500057060
CrossRef fulltext / Google Scholar
Koley, D., och Bard, A. J. (2010). Triton X-100 koncentrationseffekter på membranpermeabilitet hos en enda HeLa-cell genom att skanna elektrokemisk mikroskopi (SECM). Proc. Natl. Acad. Sci. USA 107, 16783-16787. doi: 10.1073/pnas.1011614107
PubMed Abstract / CrossRef fulltext / Google Scholar
Liedberg, B., Nylander, C., Och Lunstrubbib, I. (1983). Ytplasmonresonans för gasdetektering och biosensering. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef fulltext / Google Scholar
m Jacobjard, R., Griesser, Hj och Thierry, B. (2014). Optisk biosensing för etikettfria cellulära studier. TrAC Trender Anal. Chem. 53, 178–186. doi: 10.1016/j.trac.2013.08.012
CrossRef fulltext / Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y. och Li, J. (2018). Etikettfri avbildning av epidermal tillväxtfaktorreceptorinducerat svar i enstaka levande celler. Analytiker 143, 5264-5270. doi: 10.1039 / C8AN01534A
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Phillips, ks och Cheng, Q. (2007). Nya framsteg inom ytplasmonresonansbaserade tekniker för bioanalys. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract / CrossRef fulltext / Google Scholar
Rothenh Brasiliusler, B. Och Knoll, W. (1988). Ytplasmonmikroskopi. Natur 332, 615-617. doi: 10.1038 / 332615a0
CrossRef fulltext / Google Scholar
Smith, J. T., Tomfohr, JK, Wells, Mc, Beebe, TP, Kepler, TB och Reichert, WM (2004). Mätning av cellmigration på ytbundna fibronektingradienter. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Su, yw och Wang, W. (2018). Ytplasmonresonansavkänning: från renade biomolekyler till intakta celler. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Abstract / CrossRef fulltext/Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, Storbritannien och Ranganathan, K. (2012). Kemiska och fysiska grunderna i rutin formaldehyd fixering. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103 / 0973-029X. 102496
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Etikettfri avbildning, detektion och massmätning av enstaka virus genom ytplasmonresonans. Proc. Natl. Acad. Sci. USA 107, 16028-16032. doi: 10.1073/pnas.1005264107
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J. och Tao, N. (2012A). Kartläggning av interaktioner med encelliga substrat genom ytplasmonresonansmikroskopi. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, VJ, Liu, Q., Wu, J., et al. (2012b). Etikettfri mätning och kartläggning av bindande kinetik av membranproteiner i enskilda levande celler. Nat. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ läkemedelsreceptorbindande kinetik i enstaka celler: en kvantitativ etikettfri studie av antitumörläkemedelsresistens. Sci. REP. 4: 6609. doi: 10.1038 / srep06609
PubMed Abstrakt | CrossRef fulltext | Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Ultrakänslig och ultrasnabb upptäckt av helt omärkta levande cancercellsvar på paklitaxel med en grafenbaserad biosensor. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016/j.snb.2018.02.095
CrossRef fulltext / Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Ytplasmonresonans för cellbaserad klinisk diagnos. Sensorer 14, 4948-4959. doi: 10.3390 / s140304948
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, MW och Hide, M. (2010). Detektion av brytningsindexförändringar i enskilda levande celler med hjälp av ytplasmonresonansavbildning. Biosens. Bioelektron. 26, 674–681. doi: 10.1016/j.bios.2010.06.065
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Etikettfri spårning av enkel organelltransport i celler med nanometerprecision med hjälp av en plasmonisk bildteknik. Liten 11, 2878-2884. doi: 10.1002/smll.201403016
PubMed Abstrakt / CrossRef fulltext / Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Kvantifiering av epidermal tillväxtfaktorreceptoruttrycksnivå och bindande kinetik på cellytor genom ytplasmonresonansavbildning. Anal. Chem. 87, 9960–9965. doi: 10.1021/acs.analchem.5b02572
PubMed Abstrakt / CrossRef fulltext / Google Scholar