Frontiers in Chemistry
- wprowadzenie
- materiały i metody
- materiały
- hodowlę komórek
- Ustawienia obrazowania SPR oparte na pryzmacie
- przygotowanie Chipa czujnika
- system przepływu
- Kalibracja czułości
- wyniki i dyskusja
- początkowa utrata gęstości masy w fiksacji komórek przez PFA
- reakcja ciśnienia osmotycznego w fiksacji komórek przez PFA
- znaczna utrata gęstości masy w Permeabilizacji komórek przez Tryton
- podsumowanie
- autorzy
- Oświadczenie o konflikcie interesów
- podziękowania
wprowadzenie
Immunofluorescencja jest potężną techniką wizualizacji rozkładu określonych biomolekuł w próbkach biologicznych, takich jak komórki i tkanki (Joshi and Yu, 2017). W typowych testach immunofluorescencyjnych opartych na komórkach, przylegające komórki inkubowano z przeciwciałem fluorescencyjnym, aby umożliwić specyficzne rozpoznanie i wiązanie między przeciwciałem a cząsteczką docelową w komórkach. Po dokładnym płukaniu próbkę umieszczono pod mikroskopem fluorescencyjnym w celu uzyskania obrazu fluorescencyjnego, z którego rozkład cząsteczek docelowych został zgłoszony przez znaczniki fluorescencyjne. W celu ułatwienia dostępu przeciwciał do cząsteczek docelowych i zahamowania wrodzonej aktywności komórkowej, próbki były często utrwalane i przenikane przed procedurami barwienia. Były one szczególnie konieczne, gdy cząsteczki docelowe znajdowały się w cytoplazmie. Spośród wielu rodzajów odczynników, paraformaldehyd (PFA) i Triton X-100 są prawdopodobnie najczęściej stosowanymi odpowiednio do utrwalania i permeabilizacji. Depolimeryzacja PFA wytwarzała cząsteczki formaldehydu w celu utworzenia kowalencyjnych wiązań chemicznych między białkami w próbce. Mechanizm działania polegał na aktywacji jednej z reszt aminokwasowych lizyny. PFA rozpuszcza również niektóre lipidy w błonach komórkowych, które nieznacznie uszkodziły integralność błony komórkowej (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, jako skuteczny niejonowy detergent, może rozpuszczać lipidy z błon komórkowych, dzięki czemu błona komórkowa staje się bardziej przepuszczalna dla przeciwciała fluorescencyjnego. Etap permeabilizacji usunął więcej lipidów błony komórkowej z powodu niezaładowanych, hydrofilowych grup głowy, które składają się z ugrupowań polioksyetylenowych, aby umożliwić dostanie się dużych cząsteczek, takich jak przeciwciała, do wnętrza komórki (Jamur and Oliver, 2010; Koley and Bard, 2010). Schematyczna ilustracja procesu utrwalania i permeabilizacji komórek jest pokazana na fig. 1D. Pomimo faktu, że fiksacja i permeabilizacja stały się rutynowymi procedurami w immunofluorescencji i immunohistochemii, dość rzadkie wysiłki zostały podjęte w celu ilościowego wyjaśnienia ich wpływu na integralność błony i gęstość masy komórkowej na poziomie pojedynczych komórek.
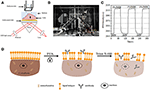
Rysunek 1. Ustawienia obrazowania SPR oparte na pryzmacie. A) schematyczna ilustracja eksperymentu. B) zdjęcie aparatu. C) krzywa kalibracji czułości. (D) schematyczna ilustracja utrwalania i przenikania komórek.
powierzchniowy rezonans plazmonowy (SPR) był popularną i potężną techniką określania kinetyki wiązania między parą cząsteczek od czasu wynalezienia w 1980 roku (Liedberg et al., 1983; Cullen et al., 1987). Przypisuje się to jego niezwykłym zaletom, w tym ilościowemu pomiarowi kinetycznemu w czasie rzeczywistym z wysokimi rozdzielczościami czasowymi, kompatybilności z rozszerzonymi urządzeniami, a co najważniejsze, jego wewnętrznej funkcji bez etykiet (Rothenhäusler and Knoll, 1988; Phillips and Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su i Wang, 2018). Wczesne zastosowania koncentrowały się głównie na charakteryzowaniu i ilościowym określaniu interakcji biomolekularnych poprzez unieruchamianie oczyszczonych cząsteczek na podłożach wykrywających SPR (szkiełka szklane pokryte złotem). Takie badania ex situ nie tylko wymagały pracochłonnych procedur oczyszczania, ale również doprowadziły do wyników, które mogą nie odzwierciedlać naturalnych interakcji u żywych istot (Phillips and Cheng, 2007; Homola, 2008). Napędzany zarówno zaawansowaniem technicznym w różnych systemach obrazowania SPR (SPRi), jak i motywacją naukową w obrazowaniu i analizie pojedynczych komórek, zarówno Prism, jak i obiektywne techniki SPRi zostały wykorzystane do obrazowania rozkładu masy pojedynczych żywych komórek bez potrzeby etykietowania (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Każdy z nich ma swoje zalety. Ten ostatni ma wyższą rozdzielczość przestrzenną, a ten pierwszy ma lepszą czułość. Monitorując upływające w czasie obrazy SPR pojedynczych żywych komórek podczas różnych rodzajów stymulacji fizjologicznych i biologicznych, ważne informacje przestrzenne i dynamiczne dotyczące interakcji komórka-substrat(Giebel et al., 1999), migracje komórek (Smith et al., 2004), odpowiedzi osmotyczne (Wang et al., 2012a), Kinetyka wiązania ligandu z receptorem (Wang i wsp., 2012b, 2014), ścieżki sygnalizacyjne (Deng et al., 2016), dynamika aktywacji białek (Peng et al., 2018) i żywe odpowiedzi na leki z komórek nowotworowych (Wang et al., 2018). W przypadkach, istniejące badania wyraźnie wykazały, że techniki SPRi były zdolne do mapowania gęstości masy, jak również integralności błony na poziomie pojedynczych komórek (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). Kontrast obrazu SPRi pochodził z subkomórkowego rozkładu współczynnika załamania światła, który był z grubsza określony przez lokalną gęstość masy. Stwierdzono, że Wiązanie specyficznych przeciwciał na błonie komórkowej, które wyrażały odpowiednie antygeny, lub stymulowanie żywych komórek konkretnymi chemikaliami, zmienia gęstość masy pojedynczych komórek w sposób heterogeniczny i dynamiczny (Wang i in., 2012a, b). Stwierdzono, że ekspozycja pojedynczych żywych komórek na roztwory hipertoniczne indukuje skurcz komórek, wskazując na doskonałą integralność błon komórkowych (Wang et al., 2012a). Jednak, jak utrwalania i permeabilizacji zabiegi wpłynie SPR obrazów pojedynczych komórek pozostaje niejasne.
w niniejszej pracy wykorzystaliśmy Domowy system SPRi do ciągłego rejestrowania upływających w czasie obrazów SPR dziesiątek pojedynczych żywych komórek, gdy komórki były kolejno leczone 4% roztworem PFA i 1% roztworem Triton X-100. Gęstość masową pojedynczych komórek określano uśrednionym sygnałem SPRi. Integralność błony oceniano poprzez wystawienie komórek na działanie roztworu hipertonicznego. Stwierdzono, że oprócz nieznacznie zmniejszonej gęstości masy o <10%, leczenie PFA znacząco zniszczyło integralność komórki, na co wskazuje utrata odpowiedzi osmotycznej po ekspozycji cząsteczek cukru. Jednak późniejsze leczenie za pomocą Tritona X-100 znacznie zmniejszyło gęstość masy o kolejne 20%, co sugeruje poważne zniszczenie integralności membrany.
materiały i metody
materiały
sól fizjologiczna buforowana fosforanem Dulbecco (PBS, Gibco), sacharoza (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Chemical Reagent Co., Ltd). Wszystkie odczynniki rozpuszczono w PBS.
hodowlę komórek
komórki BT-474 hodowano w temperaturze 37°C z 5% CO2 i 70% WILGOTNOŚCI WZGLĘDNEJ w zmodyfikowanej pożywce Dubelco 's Eagle’ s (Dmem, Invitrogen) z 10% płodową surowicą bydlęcą (FBS, Invitrogen), 100 jednostek/mL penicyliny i 100 µg / mL streptomycyny (Invitrogen). Komórki przepuszczono, gdy były 70-80% zbiegiem, traktując 0,25% roztworem trypsyny (Gibco).
Ustawienia obrazowania SPR oparte na pryzmacie
schemat i zdjęcie systemu SPRi przedstawiono na rysunkach 1A,B. aparat SPRi składa się głównie z trzech części: Źródła światła, elementów optycznych i Kamery.
• źródło światła: dioda emitująca światło o długości 670 nm (L7868-01, Hamamatsu, Japonia) i Gniazdo montażowe z regulacją temperatury (Ldm21, Thorlabs, Newton, USA).
• elementy optyczne (Edmund Optics, USA): trójkątny pryzmat SF-11 z włączonym chipem czujnika (No. 1 szkło BK7 firmy Fisherbrand), soczewka zbieżna, polaryzator i obiektyw przestrajalny.
• Camera: Charge-coupled device camera (Pike F032B, Allied Vision Technology, Newburyport, USA).
światło spolaryzowane p uderza bezpośrednio w dno szkiełka pokrytego złotem przez pryzmat, a kamera przechwytuje odbitą wiązkę, aby wygenerować obrazy SPR z szybkością 0,828 klatki na sekundę (fps). Przy wyborze 4-krotnego powiększenia w obiektywie przestrajalnym pole widzenia wynosiło ~2 × 2 mm2.
przygotowanie Chipa czujnika
każdy chip przemyto 75% etanolem i wodą dejonizowaną (DIW), a następnie poddano ekspozycji UV przez 30 minut, aby usunąć zanieczyszczenia powierzchniowe i wysterylizować je przed każdym eksperymentem. Komora silikonowa Flexi-Perm (Greiner Bio-One) została umieszczona na szczycie złotego Chipa, aby służyć jako dobrze do hodowli komórkowej. Aby uzyskać modyfikację powierzchni przed siewem komórek, do komory dodano 100 µg/mL 150 µL roztworu kolagenu i przechowywano w inkubatorze przez 2 godziny. chip następnie dwukrotnie przepłukano dejonizowaną wodą i dwukrotnie DMEM przed siewem komórek. Aby komórki miały dobry kształt, chip inkubowano w pożywce wzrostu przez 36 godzin. pożywkę wzrostu zastąpiono roztworem buforowym PBS przez 10 minut, aby komórki osiągnęły równowagę.
system przepływu
do iniekcji i wymiany roztworu zastosowano wielokanałowy system perfuzji leków napędzany grawitacyjnie. Natężenie przepływu wynosi 300 µL / min, a szybkość przełączania roztworu wokół ogniw może osiągnąć 1-2 s.
Kalibracja czułości
przygotowano chip czujnika, jak opisano w poprzedniej części, bez modyfikacji powierzchni i wysiewu komórek. Po pierwsze, DIW płynął nad chipem przez około 60 s. następnie został zastąpiony przez 1% (v/v) roztwór etanolu przez kolejne 60 s. jako jeden z najczęściej stosowanych roztworów kalibracyjnych, wiadomo, że 1% etanolu zwiększa kąt SPR DIW o 60 mDeg. Wyniki eksperymentów wykazały, że intensywność SPR odpowiednio wzrosła o 96 I. U. (Fig. 1C), co odpowiada czułości 1,6 ΔI.U. / mDeg.
wyniki i dyskusja
błona komórkowa (znana również jako błona cytoplazmatyczna), składająca się z dwuwarstwy lipidowej z wbudowanymi białkami, jest półprzepuszczalną błoną, która otacza cytoplazmę komórki. Etapy fiksacji i permeabilizacji komórek i próbek tkanek, które mogą zmienić przepuszczalność błony komórkowej, są kluczowymi procedurami, które mogą determinować sukcesy testów immunofluorescencyjnych lub immunohistochemicznych. Oprócz tego, Jakość przeciwciał i procedura immunoreaction są innymi kluczowymi wyznacznikami dla tego rodzaju eksperymentów. SPR ma tę cechę, że zarówno kąt rezonansowy, jak i współczynnik załamania światła (RI) w pobliżu powierzchni czujnika są bardzo wrażliwe na gęstość masy warstwy powierzchniowej w interfejsie medium-metal. W związku z tym zmiany gęstości masy komórki zachodzące na folii metalowej lub w jej pobliżu (~200 nm) mogą być synchronicznie rejestrowane przez pomiar natężenia światła odbitego. Wykorzystując technikę obrazowania rezonansowego plazmonu powierzchniowego, zbadaliśmy dynamiczny rozkład gęstości masy komórkowej z wysokimi rozdzielczościami przestrzennymi i czasowymi oraz niezawodną czułością zarówno w procesach fiksacji, jak i permeabilizacji.
początkowa utrata gęstości masy w fiksacji komórek przez PFA
pierwszym krokiem do przygotowania próbek biologicznych do analizy immunofluorescencyjnej lub immunohistochemicznej jest zwykle fiksacja. Najczęściej stosowanymi utrwalaczami do tego rodzaju testów są utrwalacze sieciujące, takie jak PFA, które działają poprzez generowanie kowalencyjnych wiązań chemicznych między białkami w komórkach lub tkankach. Dlatego badaliśmy wpływ leczenia PFA na gęstość masy komórkowej. Żywe komórki BT-474 hodowano na pokrywach pokrytych złotą folią o grubości 50 nm. Reprezentatywny obraz SPR zawierający pojedyncze komórki przedstawiono na fig. 2A. sygnały SPR każdej komórki można uzyskać, wybierając interesujący region obrazu SPR, który odpowiada morfologii badanej komórki. W typowym eksperymencie, gdy roztwór płynął nad komórkami, sensorgramy SPR komórek uzyskano analizując każdą komórkę, jak pokazano na fig. 2B (czarna krzywa). W poprzednich 242 s bufor PBS bez PFA przepływał przez komórki, a wartość wyjściową wyznaczano na podstawie stabilności systemu (Źródła światła i stabilności mechanicznej) oraz nieodłącznych sygnałów mikromocji generowanych przez żywe komórki. Następnie w 242 sekundzie wprowadzono roztwór PFA, który natychmiast zwiększył sygnał SPR ze względu na stosunkowo duży współczynnik załamania 4% roztworu PFA (efekt luzem). Roztwór PFA działał przez kolejne 17 minut, aby uzyskać wystarczające utrwalenie. W 1237 sekundzie rozwiązanie PFA zostało z powrotem zamienione na czyste rozwiązanie PBS. Oprócz zmniejszonego efektu luzem stwierdzono zmniejszenie intensywności SPR pojedynczych komórek podczas porównywania sygnałów przed (0-242) i po (1237-1545) zabiegach PFA i procent utraty masy uzyskano poprzez podzielenie wartości spadku do wartości początkowej. Sensongramy SPR tła (sąsiedni obszar bez adhezji komórek, niebieska krzywa) i pojedynczej komórki potraktowanej PBS podczas 1500 s (krzywa szara) są również pokazane na fig. 2B.Analiza statystyczna na 30 komórkach ujawnia uśrednioną utratę gęstości masy 10 ± 5%, Jak pokazano na fig. 2C. Stwierdzono również, że po leczeniu PFA poziom początkowych wahań w sygnale SPR został znacznie zmniejszony o połowę lub nawet dwie trzecie, co sugeruje utratę mikromocji i utrwalenie leczonych komórek, jak pokazano na fig. 2D.takie sygnały mikromocji były generowane przez kilka dynamicznych aktywności komórkowych z różnych składników komórkowych, w tym szkieletu, błon i organelli. Fiksacja zakończyła takie działania biologiczne i w związku z tym wyeliminowała sygnały mikromocji, towarzyszące znacznie zmniejszonym wahaniom intensywności w sensogramach SPR pojedynczych komórek.
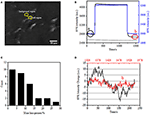
Rysunek 2. Proces utrwalania komórek. A) obraz SPRi komórek BT-474. B) sygnały SPR pojedynczej komórki (czarna krzywa) i tła (niebieska krzywa) poddawane procesowi przełączania roztworu: bufor PBS do 4% bufora PFA do bufora PBS. Sygnał SPR pojedynczej komórki potraktowanej PBS podczas 1500 s (krzywa szarości). (C) rozkład strat masy 30 pojedynczych komórek. D) poziom hałasu komórki przed a) i po B) obróbce PFA.
reakcja ciśnienia osmotycznego w fiksacji komórek przez PFA
zintegrowana struktura błony komórkowej, półprzepuszczalna membrana, reguluje homeostazę komórki, aby osiągnąć równowagę w fizjologicznym ciśnieniu osmotycznym. Stwierdzono również, że leczenie PFA ma zdolność do niszczenia integralności błony, jak pokazano na fig. 3. Gdy bufor wokół komórki docelowej zmienił się w 25 mM roztwór sacharozy w <1 s za pośrednictwem systemu perfuzji leków, powstało hipertoniczne środowisko hodowli komórek. W przypadku żywych komórek ekspozycja na hipertoniczny roztwór wywołała szereg reakcji fizjologicznych w celu zrównoważenia wewnątrzkomórkowego i zewnątrzkomórkowego ciśnienia osmotycznego, które zostało szczegółowo zbadane w naszej poprzedniej pracy (Wang et al., 2012a). W tym badaniu typowy sensorgram SPR pojedynczych fizjologicznych komórek BT – 474 przedstawiono na fig. 3A.po ekspozycji na hipertoniczny roztwór sacharozy, leczone komórki najpierw poddano naciskowemu skurczowi, prowadząc do stopniowego wzrostu intensywności SPR aż do osiągnięcia plateau. Zasugerował zwiększenie gęstości masy w wyniku kurczenia się komórek i subkomórkowych składników gromadzących się w kierunku dna pokrywy Kultury złota. Stopniowy wzrost intensywności SPR przez stymulację hipertoniczną jest rodzajem fizjologicznej regulacji ciśnienia osmotycznego komórek, co wskazuje na fizjologiczną integralność błony komórkowej. Po zniszczeniu integralności błony stwierdzono, że wprowadzenie hipertonicznego roztworu sacharozy natychmiast zwiększa intensywność SPR w znacznie krótszym czasie, jak pokazano na fig. 3B. Dzieje się tak dlatego, że cząsteczki cukru swobodnie przenikały do komórek bez oporu z półprzepuszczalnej błony i natychmiast zwiększały lokalny współczynnik załamania światła (efekt luzem). Jest oczywiste, że podczas gdy powolny wzrost intensywności SPR odzwierciedlał fizjologiczną regulację osmotyczną (Fig. 3A), szybki skok wykazał, że błona komórkowa została uszkodzona, aby umożliwić swobodny dostęp małych cząsteczek cukru (Fig.3B).

Rysunek 3. Osmotyczne reakcje ciśnieniowe komórek. A) odpowiedź żywej komórki na 25 mM sacharozy. B) reakcja tej samej komórki stała (10 min) na 25 mM sacharozy.
znaczna utrata gęstości masy w Permeabilizacji komórek przez Tryton
w poprzednim etapie fiksacji początkowa gęstość masy komórki zmniejszyła się tylko o ~10% (rysunek 2C). Uzasadnione jest spekulowanie, że Wiązanie PFA tylko nieznacznie zniszczyło integralność membrany i zwiększyło przepuszczalność małych cząsteczek. Większość składników wewnątrzkomórkowych powinna być nadal przechowywana w błonie cytoplazmatycznej. Następnie zbadaliśmy wpływ typowego detergentu do permeabilizacji, 1% Triton X-100, na komórki, które zostały utrwalone za pomocą PFA przez 17 minut wcześniej. Reprezentatywny sensorgram SPR pojedynczych komórek podczas ekspozycji na 1% Triton X-100 przedstawiono na fig. 4A.wprowadzenie Triton X-100 zwiększyło intensywność SPR, a następnie stopniowe zmniejszanie. Pierwszy wzrost jest konsekwencją wzrostu współczynnika załamania roztworu luzem, a następnie spadek wskazywał na stopniową utratę gęstości masy w wyniku przenikania komórek. Zmniejszona gęstość masy była większa przy porównaniu zmiany intensywności SPR przed (0-300 s) i po wprowadzeniu detergentu (1300-1800 s). Analiza na 30 pojedynczych komórkach wykazała, że zabieg Triton X-100 spowodował znaczny spadek gęstości masy o kolejne 20 ± 5% po utrwaleniu PFA, jak pokazano na fig.4D i w tabeli 1. Jest oczywiste, że detergent Triton X-100 wyeliminował znacznie więcej lipidów błony komórkowej i poważnie zniszczył integralność błony w tym etapie permeabilizacji. Spowodowało to uwolnienie z komórek większej ilości składników wewnątrzkomórkowych, zwłaszcza makrocząsteczek. Dzięki temu duże cząsteczki, takie jak przeciwciała, dostają się do wnętrza komórki w następnym etapie immunoreakcji. Chociaż intensywność wypłukiwania małych cząsteczek SPR została wykryta po utrwaleniu PFA, przenikanie za pomocą detergentu Triton X-100 wyraźnie rozpuszczało lipidy i sprawiło, że komórki były znacznie bardziej przepuszczalne dla ruchów makrocząsteczek wewnątrz i na zewnątrz ciała komórkowego.
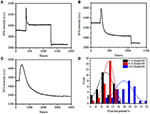
Rysunek 4. Krzywe utraty masy komórek leczonych różnymi roztworami stężenia (a) 1,0%, (B) 0,5%, (C) 0,1%. D) rozkład strat masy 30 pojedynczych komórek w różnych warunkach.

Tabela 1. Podsumowanie zmian w utracie gęstości masy komórek statystycznych w różnych warunkach.
stwierdzono, że utrata gęstości masy jest dość szybkim procesem, który wystąpił w ciągu kilku minut na etapie permeabilizacji (rysunek 4A). Spadek gęstości masy następuje po monotonicznym rozpadie w czasie 126 s. typowe sensorgramy pojedynczych komórek poniżej 0,5 i 0,1% Trytonu X-100 są pokazane odpowiednio na fig. 4B, C. Proces permeabilizacji stał się znacznie wolniejszy przy zmniejszaniu stężenia detergentu. Zajęło 126, 510, 2600 s dla trzech rodzajów leczonych komórek, aby zakończyć utratę masy.
podsumowanie
dynamiczna redystrybucja gęstości masy komórkowej zarówno w procesach fiksacji, jak i permeabilizacji została zbadana z wyczuciem za pomocą pryzmatycznej konfiguracji SPRi z wysokimi rozdzielczościami przestrzennymi i czasowymi. Utrwalacz PFA może początkowo zwiększyć przepuszczalność błony cytoplazmatycznej do pewnego stopnia, ponieważ jego zdolność do mocowania białek komórkowych zarówno w błonie, jak i wewnątrzkomórkowych białek. Był on wspierany przez (1) zmniejszoną gęstość masy o ~10% po 17-minutowej obróbce utrwalającej w 4% roztworze PFA oraz (2) wyeliminowaną odpowiedź komórkową na roztwór hipertoniczny, który wykazał zniszczenie integralności komórkowej małych cząsteczek, takich jak cukry. Detergent Triton X-100 jest lepszy od utrwalającego PFA w rozpuszczaniu lipidów, a tym samym zwiększaniu przepuszczalności błony komórkowej, wraz z bardziej znaczną utratą gęstości masy spowodowaną uwalnianiem nie tylko małych cząsteczek, ale także dużych cząsteczek i prawdopodobnie niektórych organelli, takich jak pęcherzyki. Poza tym tempo utraty masy jest dodatnio skorelowane ze stężeniem Triton X-100. Wyniki te dostarczyły ilościowego i dynamicznego zrozumienia wpływu fiksacji i permeabilizacji na gęstość masy komórkowej i integralność błony, z implikacjami dla optymalizacji warunków dla pojedynczych eksperymentów biologicznych, takich jak testy immunofluorescencyjne i immunohistochemiczne.
autorzy
RC, Y-ws i WW zaprojektowali eksperymenty. Eksperymenty przeprowadziły RC, FZ, ML i XW. RC, Y-ws i WW. RC, FZ, Y-ws i WW omówiły wyniki i przeanalizowały dane.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
redaktor prowadzący zadeklarował wspólną przynależność, choć żadnej innej współpracy, z autorami WW, RC, ML i XW w momencie recenzji.
podziękowania
dziękujemy za wsparcie finansowe od National Natural Science Foundation Of China (Grant nr 21522503).
Abadian, P. N.(2014) Analiza komórkowa i detekcja przy użyciu technik powierzchniowego rezonansu plazmonowego. Anal. Chem. 86, 2799–2812. doi: 10.1021/ac500135s
PubMed Abstract | CrossRef Full Text/Google Scholar
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Wykrywanie powstawania immuno-kompleksów poprzez powierzchniowy rezonans plazmonowy na pokrytych złotem kratkach dyfrakcyjnych. Biosensors 3, 211-225. doi: 10.1016/0265-928x(87)85002-2
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., i Wang, P. (2016). Dwukomorowe urządzenie mikroprzepływowe do długotrwałego wykrywania żywych komórek w oparciu o powierzchniowy rezonans plazmonowy. Biomicrofluidics 10: 044109. doi: 10.1063/1.4960487
PubMed Abstract | CrossRef Full Text/Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Utrwalenie Formaldehydu. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Obrazowanie kontaktów komórki z podłożem żywych komórek za pomocą powierzchniowej plazmonowej mikroskopii rezonansowej. Biophys. J. 76, 509-516. doi: 10.1016/S0006-3495(99)77219-X
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Homola, J. (2008). Powierzchniowe czujniki rezonansu plazmonowego do wykrywania gatunków chemicznych i biologicznych. Chem. Rev. 108, 462-493. doi: 10.1021/cr068107d
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Jamur, M. C., and Oliver, C. (2010). „Permeabilization of cell membranes,” in Immunocytochemical Methods and Protocols, eds C. Oliver and M. C. Jamur (Totowa, NJ: Humana Press), 63-66. DOI: 10.1007/978-1-59745-324-0_9
CrossRef Pełny tekst/Google Scholar
Joshi, S., and Yu, D. (2017). „Chapter 8-Immunofluorescence,” in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha, and M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Pełny tekst / Google Scholar
Kiernan, J. A. (2018). Formaldehyd, formalina, paraformaldehyd i glutaraldehyd: czym są i co robią. Micros. Dzisiaj 8, 8-13. doi: 10.1017/s1551929500057060
CrossRef Full Text/Google Scholar
Koley, D., And Bard, A. J. (2010). Stężenie Triton X-100 wpływa na przepuszczalność błony pojedynczej komórki HeLa za pomocą skaningowej mikroskopii elektrochemicznej (SECM). Proc. Natl. Acad. Sci. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Liedberg, B., Nylander, C., and Lunström, I. (1983). Powierzchniowy rezonans plazmonowy do wykrywania i biosensingu gazów. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Pełny tekst / Google Scholar
Méjard, R., Griesser, H. J., and Thierry, B. (2014). Biosensing optyczny do badań komórkowych bez etykiet. TrAC Trendy Anal. Chem. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
CrossRef Pełny tekst/Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Obrazowanie bez etykiety odpowiedzi indukowanej receptorem naskórkowego czynnika wzrostu w pojedynczych żywych komórkach. Analityk 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Abstract / CrossRef Full Text / Google Scholar
Ostatnie postępy w powierzchniowych rezonans plazmonowy oparte technik bioanalizy. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Mikroskopia powierzchniowo-plazmonowa. Nature 332, 615-617. doi: 10.1038 / 332615a0
CrossRef Full Text | Google Scholar
, Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. M. (2004). Pomiar migracji komórek na powierzchniowych gradientach fibronektyny. Langmuir 20, 8279-8286. doi: 10.1021/la0489763
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Su, Y. W., and Wang, W. (2018). Powierzchniowe wykrywanie rezonansu plazmonowego: od oczyszczonych biomolekuł do nienaruszonych komórek. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., and Ranganathan, K. (2012). Chemiczne i fizyczne podstawy rutynowego utrwalania Formaldehydu. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103/0973-029x.102496
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Obrazowanie, wykrywanie i pomiar masy pojedynczych wirusów metodą powierzchniowego rezonansu plazmonowego. Proc. Natl. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Mapowanie oddziaływań jednokomórkowych z substratem za pomocą powierzchniowej mikroskopii rezonansowej plazmonów. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Bez etykiety pomiar i mapowanie kinetyki wiązania białek błonowych w pojedynczych żywych komórkach. Nat. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). Kinetyka wiązania leku z receptorem in situ w pojedynczych komórkach: ilościowe badanie oporności na leki przeciwnowotworowe. Sci. / Align = „left” / 6609 doi: 10.1038/srep06609
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Ultra-czułe i ultraszybkie wykrywanie całych nieoznakowanych żywych komórek nowotworowych odpowiedzi na paklitaksel za pomocą biosensora opartego na grafenie. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef Pełny tekst | Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Powierzchniowy rezonans plazmonowy do diagnostyki klinicznej opartej na komórkach. Czujniki 14, 4948-4959. doi: 10.3390/s140304948
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., and Hide, M. (2010). Wykrywanie zmian współczynnika załamania światła w poszczególnych żywych komórkach za pomocą powierzchniowego rezonansu plazmonowego. Biosens. Bioelektron. 26, 674–681. doi: 10.1016 / j.bios.2010.06.065
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Bez etykiet śledzenie transportu pojedynczych organelli w komórkach z nanometrową precyzją przy użyciu techniki obrazowania plazmonowego. Mała 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Streszczenie | CrossRef Pełny tekst | Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Kwantyfikacja poziomu ekspresji receptora naskórkowego czynnika wzrostu i kinetyka wiązania na powierzchniach komórek za pomocą powierzchniowego rezonansu plazmonowego. Anal. Chem. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstract / CrossRef Full Text / Google Scholar