grænser i kemi
- introduktion
- materialer og metoder
- materialer
- cellekultur
- Prismebaserede SPR-Billedopsætninger
- forberedelse af sensorchip
- strømningssystem
- Følsomhedskalibrering
- resultater og diskussion
- initialt Massetæthedstab i Cellefiksering ved PFA
- osmotisk Trykrespons i Cellefiksering ved PFA
- betydeligt Massetæthedstab i Cellepermeabilisering af Triton
- konklusion
- Forfatterbidrag
- interessekonflikt Erklæring
- anerkendelser
introduktion
immunofluorescens er en kraftfuld teknik til at visualisere fordelingen af specifikke biomolekyler inden for biologiske prøver såsom celler og væv (Joshi og Yu, 2017). I typiske cellebaserede immunofluorescerende analyser blev adhærente celler inkuberet med fluorescerende antistof for at muliggøre specifik genkendelse og binding mellem antistoffet og målmolekylet i cellerne. Efter grundig skylning blev prøven anbragt under fluorescensmikroskop for at opnå et fluorescensbillede, hvorfra fordelingen af målmolekyler blev rapporteret af de fluorescerende tags. For at lette tilgængeligheden af antistof til målmolekylerne og for at hæmme den iboende cellulære aktivitet blev prøverne ofte fikseret og permeabiliseret inden farvningsprocedurerne. De var især nødvendige, når målmolekylerne var placeret i cytoplasmaet. Blandt mange typer reagenser er paraformaldehyd (PFA) og Triton HS-100 sandsynligvis de mest anvendte til henholdsvis fiksering og permeabilisering. Depolymerisering af PFA producerede formaldehydmolekyler for at skabe kovalente kemiske bindinger mellem proteiner i prøven. Virkningsmekanismen var afhængig af aktiveringen af en af aminosyreresterne lysin. PFA opløste også nogle lipider i cellulære membraner, som let beskadigede cellemembranintegriteten (ræv et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton H-100, som et effektivt ikke-ionisk rengøringsmiddel, kunne opløse lipider fra cellemembraner, så cellemembranen blev mere permeabel for det fluorescerende antistof. Permeabiliseringstrinnet fjernede flere cellulære membranlipider på grund af dets uladede, hydrofile hovedgrupper, der består af polyoksyethylendele for at tillade store molekyler som antistoffer at komme ind i cellen (Jamur og Oliver, 2010; Koley og Bard, 2010). En skematisk illustration af cellefiksering og permeabiliseringsproces er vist i figur 1D. På trods af det faktum, at fiksering og permeabilisering er blevet rutinemæssige procedurer i immunofluorescens og immunhistokemi, er der gjort temmelig sjældne bestræbelser på kvantitativt at afklare deres indflydelse på membranintegriteten og cellulær massetæthed på enkeltcelleniveau.
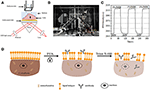
Figur 1. Prisme-baserede SPR imaging opsætninger. A) skematisk illustration af forsøgsopstillingen. B) et fotografi af apparatet. C) Følsomhedskalibreringskurve. D) skematisk illustration af cellefiksering og permeabilisering.Overfladeplasmonresonans (SPR) har været en populær og kraftfuld teknik til bestemmelse af bindingskinetikken mellem et par molekyler siden dets opfindelse i 1980 ‘ erne (Liedberg et al., 1983; Cullen et al., 1987). Dette tilskrives dets bemærkelsesværdige fordele, herunder kvantitativ kinetisk måling i realtid med høje tidsmæssige opløsninger, kompatibilitet med udvidede enheder, og vigtigst af alt, dets iboende træk ved etiketfri (Rothenh Lutusler og Knoll, 1988; Phillips og Cheng, 2007; Homola, 2008; Abadian et al., 2014; m Larjard et al., 2014; Yanase et al., 2014; Jens og Jørgen, 2018). Tidlige applikationer fokuserede mest på at karakterisere og kvantificere biomolekylære interaktioner ved at immobilisere rensede molekyler på SPR-sensingsubstrater (guldbelagte glasrutschebaner). Sådanne tidligere situ-undersøgelser krævede ikke kun de arbejdskrævende rensningsprocedurer, men førte også til resultater, der muligvis ikke afspejler den naturlige interaktion hos levende væsener (Phillips og Cheng, 2007; Homola, 2008). Drevet af både den tekniske udvikling i forskellige SPR-billeddannelsessystemer (SPRi) og den videnskabelige motivation i enkeltcellebilleddannelse og analyse er både prisme og målbaserede SPRi-teknikker blevet anvendt til at afbilde massefordelingen af enkelt levende celler uden behov for mærkning., 2010, 2012A; Yanase et al., 2010; Yang et al., 2015; Chang et al., 2015). Hver enkelt har sine egne fordele. Sidstnævnte har en højere rumlige opløsninger, og førstnævnte har en bedre følsomhed. Ved at overvåge de tidsforløbne SPR-billeder af enkelt levende celler under forskellige typer fysiologiske og biologiske stimuleringer, vigtig rumlig og dynamisk information om celle-substratinteraktionerne (Giebel et al., 1999), cellevandringer (Smith et al., 2004), osmotiske reaktioner (Vang et al., 2012A), ligand-receptorbindende kinetik (Vang et al., 2012b, 2014), signalveje (Deng et al., 2016), proteinaktiveringsdynamik (Peng et al., 2018), og levende kræftcellemedicinresponser (Vang et al., 2018) er opnået. I tilfælde har eksisterende undersøgelser tydeligt vist, at SPRi-teknikker var i stand til at kortlægge massetætheden såvel som membranintegriteten på enkeltcelleniveau (Yanase et al., 2010; Jørgen et al., 2012b; Yang et al., 2015). Billedkontrasten af SPRi kom fra den subcellulære fordeling af brydningsindeks, som groft blev bestemt af den lokale massetæthed. Binding af specifikke antistoffer på cellemembranen, der udtrykte de tilsvarende antigener eller stimulerede de levende celler med bestemte kemikalier, viste sig at ændre massetætheden af enkeltceller på en heterogen og dynamisk måde., 2012A, b). Eksponering af enkelte levende celler for hypertoniske opløsninger viste sig at inducere sammentrækning af celler, hvilket indikerer den fremragende integritet af cellemembraner., 2012a). Hvordan fikserings-og permeabiliseringsbehandlingerne vil påvirke SPR-billederne af enkeltceller forbliver imidlertid uklare.
i det nuværende arbejde anvendte vi et hjemmebygget SPRi-system til kontinuerligt at registrere de tidsforløbne SPR-billeder af snesevis af enkelt levende celler, når cellerne successivt blev behandlet med 4% PFA-opløsning og 1% Triton-100-opløsning. Massetætheden af enkeltceller blev bestemt af det gennemsnitlige SPRi-signal. Membranintegriteten blev evalueret ved at udsætte cellerne for hypertonisk opløsning. Det blev fundet, at ud over den let reducerede massetæthed med <10% ødelagde PFA-behandling signifikant celleintegriteten som angivet ved tabet af osmotisk respons ved eksponering af sukkermolekyler. Efterfølgende behandling med Triton H-100 reducerede imidlertid massetætheden signifikant med yderligere 20%, hvilket antyder den alvorlige ødelæggelse af membranintegriteten.
materialer og metoder
materialer
dulbeccos phosphatbufret saltvand (PBS, Gibco), saccharose (Sinopharm Chemical Reagent Co., Ltd), Triton 100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Chemical Reagent Co., Ltd). Alle reagenserne blev opløst i PBS.
cellekultur
BT-474 celler blev dyrket ved 37 liter C med 5% CO2 og 70% relativ fugtighed i Dubelcos modificerede Ørnemedium (DMEM, Invitrogen) med 10% føtal bovint serum (FBS, Invitrogen), 100 enheder/mL penicillin og 100 liter / mL streptomycin (Invitrogen). Celler blev passeret, når de var 70-80% sammenflydende ved behandling med 0,25% trypsinopløsning (Gibco).
Prismebaserede SPR-Billedopsætninger
et skematisk diagram og et foto af SPRi-systemet er præsenteret i figur 1a,B. SPRi-apparatet består hovedsageligt af tre dele: lyskilde, optiske komponenter og kamera.
• lyskilde: en 670 nm lysemitterende diode (L7868-01, Hamamatsu, Japan) og en temperaturstyret monteringsstik (LDM21, Thorlabs, Nyton, USA).
• optiske komponenter (Edmund Optics, USA): en trekant SF-11 prisme med en sensorchip på (nr. 1 BK7 glas fra Fisherbrand), en konvergerende linse, en polarisator og en indstillelig linse.
• kamera: Opladningskoblet enhedskamera (Pike F032B, Allied Vision Technology, Nyburyport, USA).
det p-polariserede lys rammer bunden af det guldbelagte glasglas direkte gennem prismet, og kameraet fanger den reflekterede stråle for at generere SPR-billeder med en hastighed på 0,828 ramme pr. Når du vælger 4 gange forstørrelse i en indstillelig linse, var synsfeltet ~2 liter 2 mm2.
forberedelse af sensorchip
hver chip blev vasket med 75% ethanol og deioniseret vand efterfulgt af UV-eksponering i 30 minutter for at fjerne overfladeforurening og sterilisere dem før hvert eksperiment. Et fleksi-Perm siliciumkammer (Greiner Bio-One) blev anbragt oven på guldchippen for at tjene som en cellekulturbrønd. For at opnå overflademodifikationen før cellesåning blev en 100 liter/mL 150 liter kollagenopløsning tilsat til kammeret og opbevaret i en inkubator i 2 timer. chippen blev derefter skyllet med deioniseret vand to gange og DMEM to gange før cellesåning. For at gøre cellerne til en god form blev chippen inkuberet i vækstmediet i 36 timer. vækstmediet blev derefter erstattet med PBS-bufferopløsning i 10 minutter for celler, der opnåede en balance.
strømningssystem
et tyngdekraftsdrevet flerkanals lægemiddelperfusionssystem blev anvendt til injektion og omskiftning af opløsningen. Strømningshastigheden er 300 liter / min, og opløsningsskiftehastigheden omkring cellerne kan nå 1-2 s.
Følsomhedskalibrering
en sensorchip blev fremstillet som beskrevet i foregående del uden overflademodifikation og cellesåning. 60 s. derefter blev den erstattet af 1% (v/v) ethanolopløsning i yderligere 60 s. som en af de mest almindeligt anvendte kalibreringsopløsninger er 1% ethanol kendt for at øge SPR-vinklen på div med 60 mDeg. Eksperimentelle resultater viste, at SPR-intensitet følgelig steg med 96 I. U. (figur 1C) svarende til en følsomhed på 1,6 Kursi.U. / mDeg.
resultater og diskussion
cellemembranen (også kendt som cytoplasmisk membran), der består af et lipid-dobbeltlag med indlejrede proteiner, er en semipermeabel membran, der omslutter cytoplasmaet i en celle. Fikserings-og permeabiliseringstrinnene for celler og vævsprøver, som kan ændre permeabiliteten af cellemembranen, er afgørende procedurer, der kan bestemme succeserne for immunofluorescerende eller immunhistokemiske analyser. Ud over dette er antistofkvaliteten og immunoreaktionsproceduren andre vigtige determinanter for denne slags eksperimenter. SPR har den funktion, at både resonansvinklen og brydningsindekset (RI) nær sensoroverfladen er meget følsomme over for massetætheden af overfladelaget i mellemmetalgrænsefladen. Derfor kan cellens massetæthedsvariationer, der finder sted på eller i nærheden af metalfilmen (~200 nm), registreres synkront ved at måle intensiteten af det reflekterede lys. Ved at anvende overfladeplasmon resonansbilleddannelsesteknik udforskede vi dynamisk fordeling af cellulær massetæthed med høje rumlige og tidsmæssige opløsninger og pålidelig følsomhed i både fikserings-og permeabiliseringsprocesser i denne undersøgelse.
initialt Massetæthedstab i Cellefiksering ved PFA
det første trin til fremstilling af biologiske prøver til immunofluorescerende eller immunhistokemisk analyse er normalt fiksering. Og de mest almindeligt anvendte fikseringsmidler til denne slags analyser er tværbindende fikseringsmidler som PFA, der virker ved at generere kovalente kemiske bindinger mellem proteiner i celler eller væv. Vi undersøgte derfor indflydelsen af PFA-behandling på cellulær massetæthed. Levende BT-474 celler blev dyrket på dækglas belagt med guldfilm med en tykkelse på 50 nm. Et repræsentativt SPR-billede indeholdende enkeltceller er tilvejebragt i figur 2a. SPR-signaler fra hver celle kan opnås ved at vælge en region af interesse i SPR-billedet, der matcher morfologien for den undersøgte celle. I et typisk eksperiment, når opløsningen flød over cellerne, blev SPR-sensorgrammer af cellerne opnået ved at analysere hver celle som vist i figur 2b (sort kurve). I de foregående 242 s strømmede PBS-buffer uden PFA over cellerne, og basislinjen blev bestemt af systemstabiliteten (lyskilde og mekanisk stabilitet) og de iboende mikromotionssignaler genereret af de levende celler. PFA-opløsning blev derefter introduceret i det 242.sekund, hvilket straks øgede SPR-signalet på grund af det relativt store brydningsindeks på 4% PFA-opløsning (bulkeffekt). PFA-opløsningen løb i yderligere 17 minutter for at opnå tilstrækkelig fiksering. I det 1237. sekund blev PFA-opløsningen skiftet tilbage til ren PBS-opløsning. Ud over den reducerede bulkeffekt blev der fundet et fald i SPR-intensiteten af enkeltceller ved sammenligning af signalerne før (0-242) og efter (1237-1545) PFA-behandlingerne og massetabsprocenten blev opnået ved at dividere faldværdien til den oprindelige værdi. SPR-sensongrammerne i baggrunden (et tilstødende område uden celleadhæsion, blå kurve) og en enkelt celle behandlet med PBS i løbet af 1.500 s (grå kurve) er også vist i figur 2b. statistisk analyse på 30 celler afslører et gennemsnitligt massetæthedstab på 10 liter 5% som vist i figur 2C. Det blev også fundet, at efter PFA-behandling blev basislinjens fluktuationsniveau i SPR-signal signifikant reduceret med halvdelen eller endda to tredjedele, hvilket tyder på tab af mikromotioner og fiksering af de behandlede celler som vist i figur 2D. sådanne mikromotionssignaler blev genereret af en flok dynamiske cellulære aktiviteter fra forskellige cellekomponenter, herunder skelet, membraner og organeller. Fikseringen afsluttede sådanne biologiske aktiviteter og eliminerede derfor mikromotionssignalerne, ledsaget af en signifikant reduceret intensitetsudsving i SPR-sensogrammerne for enkeltceller.
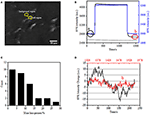
figur 2. Cellefikseringsproces. (- En) SPRi billede af BT-474 celler. (B) SPR-signaler af enkeltcelle (sort kurve) og baggrund (blå kurve), der gennemgår en opløsningskoblingsproces: PBS-buffer til 4% PFA til PBS-buffer. SPR-signal af enkeltcelle behandlet med PBS i løbet af 1.500 s (grå kurve). C) Massetabsfordeling af 30 enkeltceller. D) støjniveauet i cellen før (A) og efter (b) PFA-behandling.
osmotisk Trykrespons i Cellefiksering ved PFA
den integrerede struktur af cellemembranen, en semipermeabel membran, regulerer homeostasen af en celle for at nå balance i fysiologisk osmotisk tryk. PFA-behandling viste sig også at have evnen til at ødelægge membranintegriteten som vist i figur 3. Når bufferen omkring målcellen ændrede sig til 25 mM saccharoseopløsning i <1 s via et lægemiddelperfusionssystem, blev der skabt et hypertonisk cellekulturmiljø. For levende celler udløste eksponeringen for hypertonisk opløsning en række fysiologiske reaktioner for at afbalancere det intracellulære og ekstracellulære osmotiske tryk, som er blevet undersøgt i detaljer i vores tidligere arbejde., 2012a). I denne undersøgelse er et typisk SPR-sensorgram af enkeltfysiologiske BT-474-celler tilvejebragt i figur 3a. ved eksponering for hypertonisk saccharoseopløsning gennemgik behandlede celler først en pressekrympning, hvilket førte til en gradvis stigning i SPR-intensitet, indtil et plateau blev nået. Det foreslog den øgede massetæthed som et resultat af cellekrympning og subcellulære komponenter, der samles mod bunden af guldkulturdækslet. Den gradvise stigning i SPR-intensitet ved hypertonisk stimulering er en slags fysiologisk regulering for cellulært osmotisk tryk, hvilket indikerer cellemembranens fysiologiske integritet. Når membranintegriteten blev ødelagt, blev indførelsen af hypertonisk saccharoseopløsning fundet at straks øge SPR-intensiteten på meget kortere tid, som vist i figur 3b. Det skyldes, at sukkermolekylerne frit trængte ind i cellerne uden modstand fra den semipermeable membran og øgede det lokale brydningsindeks med det samme (bulkeffekt). Det er klart, at mens den langsomme stigning i SPR-intensiteten afspejlede den fysiologiske osmotiske regulering (figur 3a), viste det hurtige spring, at cellemembranen var blevet beskadiget for at muliggøre fri adgang til små sukkermolekyler (figur 3b).

figur 3. Osmotiske trykresponser af celler. A) en levende celles respons på 25 mM saccharose. (B) respons fra den samme celle fast (10 min) til 25 mM saccharose.
betydeligt Massetæthedstab i Cellepermeabilisering af Triton
i det foregående fikseringstrin faldt en indledende cellemassetæthed kun med ~10% (figur 2C). Det er rimeligt at spekulere i, at PFA-fikseringen kun lidt ødelagde membranintegriteten og øgede permeabiliteten af små molekyler. Størstedelen af de intracellulære komponenter skal stadig være indeholdt i den cytoplasmatiske membran. Vi undersøgte efterfølgende indflydelsen af et typisk permeabiliseringsvaskemiddel, 1% Triton H-100, på celler, der tidligere er blevet fikseret med PFA i 17 minutter. Et repræsentativt SPR-sensorgram af enkeltceller under eksponering for 1% Triton H-100 er vist i figur 4a. indførelsen af Triton H-100 øgede SPR-intensiteten efterfulgt af et gradvist fald. Den første stigning er en konsekvens af stigning brydningsindeks for bulkopløsning, og det fulgte fald indikerede det gradvise tab i massetætheden på grund af cellepermeabiliseringen. Den reducerede massetæthed var mere rigelig, når man sammenlignede SPR-intensitetsændringen før (0-300 s) og efter introduktionen af vaskemiddel (1.300–1.800 s). Analyse på 30 enkeltceller viste, at Triton-100-behandlingen skabte et betydeligt massetæthedsfald med yderligere 20 liter 5% efter PFA-fiksering som vist i figur 4D og tabel 1. Det er klart, at vaskemidlet Triton H-100 eliminerede meget mere cellulære membranlipider og alvorligt ødelagde membranintegriteten i dette permeabiliseringsstadium. Dette resulterede i flere intracellulære komponenter, især makromolekyler, at frigive fra cellerne. Og også dette tillader store molekyler som antistoffer at komme ind i cellen i det næste immunreaktionsstadium. Selvom SPR-intensitet af små molekyler udvaskning blev påvist efter PFA-fiksering, permeabilisering ved anvendelse af Triton 100 vaskemiddel klart opløste lipider og gjorde cellerne meget mere permeable for bevægelser af makromolekyler ind og ud af cellelegemet.
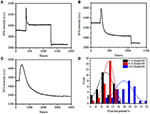
figur 4. Massetabskurver for celler behandlet med forskellige koncentrationsopløsninger (a) 1,0%, (B) 0,5%, (C) 0,1%. D) Massetabsfordeling af 30 enkeltceller under forskellige forhold.

tabel 1. En oversigt over variationer i massetæthedstab af statistiske celler under forskellige forhold.
det blev konstateret, at tabet i massetæthed er en ret hurtig proces, der opstod om få minutter i permeabiliseringsstadiet (figur 4a). Faldet i massetæthed fulgte groft et monotonisk henfald inden for en tidsperiode på 126 s. de typiske sensorgrammer af enkeltceller under 0,5 og 0,1% Triton H-100 vises i henholdsvis figur 4b,C. Permeabiliseringsprocessen blev meget langsommere, når koncentrationen af vaskemiddel blev reduceret. Det tog 126, 510, 2.600 s for de tre slags behandlede celler at afslutte massetab.
konklusion
Sammenfattende er dynamisk omfordeling af cellulær massetæthed i både fikserings-og permeabiliseringsprocesser blevet udforsket følsomt ved hjælp af prismebaseret SPRi-opsætning med høje rumlige og tidsmæssige opløsninger. Fikseringsmiddel PFA kunne oprindeligt øge permeabiliteten af cytoplasmatisk membran til en vis grad, fordi dens evne til at fiksere cellulære proteiner i både membran-og intracellulære proteiner. Det blev understøttet af (1) den nedsatte massetæthed med ~10% efter en 17-minutters fikseringsbehandling i 4% PFA-opløsning og (2) den eliminerede cellulære respons på hypertonisk opløsning, som demonstrerede ødelæggelsen af cellulær integritet over for små molekyler som sukkerarter. 100 er bedre end fiksativ PFA i opløseliggørende lipider og øger derfor cellemembranpermeabilitet, der ledsager det mere betydelige tab i massetætheden på grund af frigivelsen af ikke kun små molekyler, men også store molekyler og muligvis nogle organeller, såsom vesikler. Desuden er massetabshastigheden positivt korreleret med Triton 100 koncentration. Disse resultater tilvejebragte kvantitative og dynamiske forståelser af indflydelsen af fiksering og permeabilisering på den cellulære massetæthed og membranintegritet med implikationer for optimering af betingelserne for enkeltcellebiologiske eksperimenter, såsom immunofluorescerende og immunhistokemiske analyser.
Forfatterbidrag
RC, Y-VSOG verden designet eksperimenterne. RC, RC, ML og RC udførte forsøgene. RC, Y-V og V skrev avisen. RC, FS, Y-VS og VV drøftede resultaterne og analyserede dataene.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.håndteringsredaktøren erklærede en fælles tilknytning, dog ikke noget andet samarbejde, med forfatterne første, RC, ML og anden på tidspunktet for gennemgangen.
anerkendelser
Vi takker økonomisk støtte fra National Natural Science Foundation of China (Grant No. 21522503).
Abadian, P. N. Kelley, C. P. og Goluch, E. D. (2014). Cellulær analyse og detektion ved hjælp af overflade plasmon resonans teknikker. Anal. Chem. 86, 2799–2812. doi: 10.1021 / ac500135s
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
Cullen, D. C., Brun, R. G. V. og lav, C. R. (1987). Påvisning af immuno-kompleks dannelse via overfladeplasmonresonans på guldbelagte diffraktionsgitter. Biosensorer 3, 211-225. doi: 10.1016/0265-928h (87) 85002-2
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
Deng, S., Yu, Liu, R., Chen, U. Jens, P. (2016). En to-rums mikrofluidisk enhed til langvarig live celledetektion baseret på overfladeplasmonresonans. Biomicrofluidics 10: 044109. doi: 10.1063 / 1.4960487
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
ræv, C. H., Johnson, F. B., hvilling, J. og Roller, P. P. (1985). Formaldehyd fiksering. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177 / 33.8.3894502
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Viiland, U., et al. (1999). Billeddannelse af celle / substratkontakter af levende celler med overfladeplasmonresonansmikroskopi. Biofys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99)77219-
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
Homola, J. (2008). Overfladeplasmonresonansfølere til påvisning af kemiske og biologiske arter. Chem. Åb 108, 462-493. doi: 10.1021 / cr068107d
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
Jamur, M. C. og Oliver, C. (2010). “Permeabilisering af cellemembraner,” i Immunocytokemiske metoder og protokoller, eds C. Oliver og M. C. Jamur, 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef Fuld tekst/Google Scholar
Joshi, S., og Yu, D. (2017). “Kapitel 8-immunofluorescens” i grundlæggende videnskabelige metoder til kliniske forskere, eds M. Jalali, F. Y. L. Saldanha og M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Fuld tekst / Google Scholar
Kiernan, J. A. (2018). Formaldehyd, formalin, paraformaldehyd og glutaraldehyd: hvad de er, og hvad de gør. Micros. I dag 8, 8-13. doi: 10.1017 / S1551929500057060
CrossRef fuldtekst/Google Scholar
Koley, D., And Bard, A. J. (2010). 100 koncentrationseffekter på membranpermeabilitet af en enkelt HeLa-celle ved scanning af elektrokemisk mikroskopi (SECM). Proc. Natl. Acad. Sci. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Liedberg, B., Nylander, C., Og Lunstr Larsm, I. (1983). Overfladeplasmonresonans til gasdetektion og biosensering. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Fuld tekst / Google Scholar
m Krisjard, R., Griesser, H. J. og Thierry, B. (2014). Optisk biosensering til etiketfri cellulære undersøgelser. TrAC Tendenser Anal. Chem. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
CrossRef Fuld tekst / Google Scholar
Peng, å, Lu, J., J., Liu, Y. og Li, J. (2018). Etiketfri billeddannelse af epidermal vækstfaktorreceptor-induceret respons i enkelt levende celler. Analytiker 143, 5264-5270. doi: 10.1039 / C8AN01534A
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
Phillips, K. S. og Cheng, K. (2007). Nylige fremskridt inden for overfladeplasmonresonansbaserede teknikker til bioanalyse. Anal. Bioanal. Chem. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract / CrossRef fuldtekst / Google Scholar
Rothenhriusler, B., Og Knoll, V. (1988). Overflade-plasmon mikroskopi. Natur 332, 615-617. doi: 10.1038/332615a0
CrossRef Fuld tekst/Google Scholar
Smith, J. T.(2004), tomfohr, J. K., M. C., Beebe, T. P., Kepler, T. B. Og Reichert . Måling af cellemigration på overfladebundne fibronectingradienter. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Su, Y. V. og Vang, H. (2018). Overfladeplasmonresonansføler: fra rensede biomolekyler til intakte celler. Anal. Bioanal. Chem. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elisabeth, J., Rao, U. K. og Ranganathan, K. (2012). Kemiske og fysiske basics af rutinemæssig formaldehyd fiksering. J. Oral Maksillofac. Pathol. 16, 400–405. doi: 10.4103 / 0973-029h.102496
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
Vang, S., Shan, H., Patel, U., Huang, H., Lu, J., Li, J., et al. (2010). Etiketfri billeddannelse, detektion og massemåling af enkelte vira ved overfladeplasmonresonans. Proc. Natl. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Vang, S., Liu, S., Vu, J. og Tao, N. (2012A). Kortlægning af enkeltcelle-substratinteraktioner ved overfladeplasmon-resonansmikroskopi. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Vang, V., Y., V., Nagaraj, V. J., Liu, K., Vu, J., et al. (2012b). Etiketfri måling og kortlægning af bindende kinetik af membranproteiner i enkelt levende celler. Nat. Chem. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Vang, V., Yin, L., Vang, S., Yu, Eaton, S., et al. (2014). In situ lægemiddelreceptorbindende kinetik i enkeltceller: en kvantitativ etiketfri undersøgelse af anti-tumor-lægemiddelresistens. Sci. Rep. 4: 6609. doi: 10.1038 / srep06609
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
Vang, Y., S., S., T., T., Mo, Y., Liu, J., et al. (2018). Ultrafølsom og ultrahurtig påvisning af hele umærkede levende kræftcelleresponser på paclitaksel med en grafenbaseret biosensor. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef Fuld tekst/Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Yanase, T., Yanase, T., K., Et Al. (2014). Overfladeplasmonresonans til cellebaseret klinisk diagnose. Sensorer 14, 4948-4959. doi: 10.3390 / s140304948
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. H. og Skjul, M. (2010). Påvisning af brydningsindeksændringer i individuelle levende celler ved hjælp af overfladeplasmon resonansbilleddannelse. Biosens. Bioelektron. 26, 674–681. doi: 10.1016 / j. bios.2010.06.065
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Yang, Y., Yu, H., Shan, H., Vang, V., Liu, Vang, S., et al. (2015). Etiketfri sporing af enkelt organelletransport i celler med nanometerpræcision ved hjælp af en plasmonisk billeddannelsesteknik. Lille 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef fuldtekst/Google Scholar
Jang, F., Vang, S., Yin, L., Yang, Y., Guan, Y., Vang, V., et al. (2015). Kvantificering af epidermal vækstfaktorreceptorekspressionsniveau og bindende kinetik på celleoverflader ved overfladeplasmonresonansafbildning. Anal. Chem. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar