grenzen in de chemie
- introductie
- materialen en methoden
- materialen
- celkweek
- Prism-gebaseerde Spr-Beeldvormingsopstellingen
- Sensorchipvoorbereiding
- stroomsysteem
- Gevoeligheidskalibratie
- resultaten en discussie
- initiële Massadichtheidsverlies in Celfixatie door PFA
- osmotische Drukrespons in Celfixatie door PFA
- aanzienlijk verlies van massadichtheid in Celpermeabilisatie door Triton
- conclusie
- Auteursbijdragen
- belangenconflict verklaring
- Dankbetuigingen
introductie
immunofluorescentie is een krachtige techniek om de distributie van specifieke biomoleculen binnen biologische monsters zoals cellen en weefsels te visualiseren (Joshi and Yu, 2017). In typische op cel-gebaseerde immunofluorescent analyses, werden de adherente cellen geïncubeerd met fluorescente antilichaam om specifieke erkenning en band tussen het antilichaam en de doelmolecule in de cellen toe te laten. Na grondig spoelen, werd de steekproef geplaatst onder fluorescentiemicroscoop om een fluorescentiebeeld te verkrijgen, waarvan de distributie van doelmolecules door de fluorescente markeringen werd gemeld. Om de toegankelijkheid van antilichaam aan de doelmolecules te vergemakkelijken en de inherente cellulaire activiteit te remmen, werden de steekproeven vaak vast en permeabilized voorafgaand aan de het bevlekken procedures. Zij waren vooral noodzakelijk toen de doelmolecules binnen het cytoplasma werden gevestigd. Onder vele soorten reagentia, paraformaldehyde (PFA) en Triton X-100 zijn waarschijnlijk de meest gebruikte voor fixatie en permeabilisatie, respectievelijk. Depolymerisatie van PFA produceerde formaldehydemolecules om covalente chemische banden tussen proteã nen in de steekproef te creëren. Het mechanisme van de actie baseerde zich op de activering van één van de aminozuurresiduals lysine. PFA loste ook enkele lipiden op in cellulaire membranen die de integriteit van het celmembraan enigszins beschadigden (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, als een effectief niet-ionisch detergens, kon lipiden van celmembranen oplossen, zodat het celmembraan meer doorlaatbaar aan het fluorescente antilichaam werd. De permeabilizationstap verwijderde meer cellulaire membraanlipiden toe te schrijven aan zijn ongeladen, hydrofiele hoofdgroepen die uit polyoxyethyleendelen bestaan om grote molecules zoals antilichamen toe te staan om binnen de cel te krijgen (Jamur en Oliver, 2010; Koley en Bard, 2010). Een schematische illustratie van celfixatie en permeabilisatieproces wordt getoond in Figuur 1D. Ondanks het feit dat fixatie en permeabilization routine procedures in immunofluorescentie en immunohistochemie zijn geworden, zijn vrij zeldzame inspanningen gedaan om kwantitatief hun invloeden op de membraanintegriteit en cellulaire massadichtheid op eencellig niveau te verduidelijken.
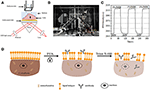
figuur 1. Prisma – gebaseerde SPR imaging setups. A) schematische illustratie van de experimentele opzet. B) een foto van het apparaat. C) Gevoeligheidskalibratiecurve. (D) schematische illustratie van celfixatie en permeabilisering.
Surface plasmon resonance (SPR) is een populaire en krachtige techniek om de bindingskinetiek tussen een paar moleculen te bepalen sinds de uitvinding in de jaren 1980 (Liedberg et al., 1983; Cullen et al., 1987). Dit wordt toegeschreven aan zijn opmerkelijke voordelen, waaronder real-time kwantitatieve kinetische meting met hoge temporele resoluties, compatibiliteit met uitgebreide apparaten, en vooral, de intrinsieke eigenschap van label-free (Rothenhäusler and Knoll, 1988; Phillips and Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su en Wang, 2018). De vroege toepassingen concentreerden zich meestal op het karakteriseren en kwantificeren van biomoleculaire interactie door gezuiverde molecules op SPR het ontdekken substraten (goud-met een laag bedekte glasplaatjes) te immobiliseren. Dergelijke ex situ-studies vereisten niet alleen de arbeidsintensieve zuiveringsprocedures, maar leidden ook tot resultaten die mogelijk niet de natuurlijke interactie in levende wezens weerspiegelen (Phillips and Cheng, 2007; Homola, 2008). Gedreven door zowel de technische vooruitgang in diverse SPR weergavesystemen (SPRi) als De wetenschappelijke motivatie in ééncellige weergave en analyse, zijn zowel Prisma als objectief-gebaseerde Spri technieken aangewend om de massadistributie van enige levende cellen zonder de behoefte van etikettering te beelden (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Elk heeft zijn eigen verdiensten. De laatste heeft een hogere ruimtelijke resolutie en de eerste heeft een betere gevoeligheid. Door het monitoren van de time-lapsed SPR beelden van enkele levende cellen tijdens verschillende soorten fysiologische en biologische stimulaties, belangrijke ruimtelijke en dynamische informatie met betrekking tot de cel-substraat interacties (Giebel et al., 1999), cell migrations (Smith et al., 2004), osmotische reacties (Wang et al., 2012a), ligand-receptor bindingskinetiek (Wang et al., 2012b, 2014), signaalwegen (Deng et al., 2016), protein activation dynamics (Peng et al., 2018), en levende kankerceldrugreacties (Wang et al., 2018) zijn verkregen. Voor gevallen, hebben de bestaande studies duidelijk aangetoond dat Spri technieken geschikt waren voor het in kaart brengen van de massadichtheid evenals de membraanintegriteit op eencellig niveau (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). Het beeldcontrast van SPRi kwam van de subcellular verdeling van brekingsindex, die ruwweg door de lokale massadichtheid werd bepaald. De band van specifieke antilichamen op het celmembraan dat de overeenkomstige antigenen uitdrukte, of het bevorderen van de levende cellen met bepaalde chemische producten, werd gevonden om de massadichtheid van enige cellen op een heterogene en dynamische manier te veranderen (Wang et al., 2012a, b). Blootstelling van enkele levende cellen aan hypertone oplossingen werd gevonden om de samentrekking van cellen te veroorzaken, die de uitstekende integriteit van celmembranen aangeeft (Wang et al., 2012a). Nochtans, hoe de fixatie en permeabilizationbehandelingen de SPR beelden van enige cellen zouden beà nvloeden blijft onduidelijk.
in het huidige werk gebruikten we een zelfgebouwd SPRi-systeem om continu de time-lapsed SPR-beelden van tientallen enkele levende cellen vast te leggen wanneer de cellen achtereenvolgens werden behandeld met 4% PFA-oplossing en 1% Triton X-100-oplossing. De massadichtheid van enkele cellen werd bepaald door het gemiddelde SPRi signaal. De membraanintegriteit werd geëvalueerd door de cellen aan hypertone oplossing bloot te stellen. Er werd vastgesteld dat, naast de enigszins gereduceerde massadichtheid met <10%, PFA-behandeling de celintegriteit significant vernietigde, zoals blijkt uit het verlies van osmotische respons bij de blootstelling van suikermoleculen. De daaropvolgende behandeling door Triton X-100, echter, verminderde significant de massadichtheid met nog eens 20%, die de strenge vernietiging aan de membraanintegriteit suggereren.
materialen en methoden
materialen
Dulbecco ‘ s fosfaatgebufferde zoutoplossing (PBS, Gibco), Sucrose (Sinopharm Chemical reagens Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyde (Shanghai Lingfeng Chemical Reagent Co., Ltd). Alle reagentia werden opgelost in PBS.
celkweek
BT-474 cellen werden gekweekt bij 37°C met 5% CO2 en 70% relatieve vochtigheid in Dubelco ’s Modified Eagle’ s Medium (DMEM, Invitrogen) met 10% foetaal runderserum (FBS, Invitrogen), 100 eenheden/mL penicilline en 100 µg/mL streptomycine (Invitrogen). Cellen werden doorgegeven toen ze 70-80% samenvloeien door behandeling met 0,25% trypsine-oplossing (Gibco).
Prism-gebaseerde Spr-Beeldvormingsopstellingen
een schematisch schema en een foto van het SPRi-systeem zijn weergegeven in de figuren 1A,B. Het SPRi-apparaat bestaat hoofdzakelijk uit drie delen: lichtbron, optische componenten en camera.
* lichtbron: een lichtemitterende diode van 670 nm (L7868-01, Hamamatsu, Japan) en een temperatuurgestuurde montagecontactdoos (Ldm21, Thorlabs, Newton, USA).
• Optical components (Edmund Optics, USA): een driehoek SF-11 prisma met een sensorchip aan (No. 1 BK7 glas van Fisherbrand), een convergerende lens, een polarisator en een afstembare lens.
* camera: Charge-coupled device camera (Pike F032B, Allied Vision Technology, Newburyport, USA).
het P-gepolariseerde licht raakt direct de bodem van het met goud beklede glasplaatje door het prisma en de camera legt de gereflecteerde bundel vast om SPR-beelden te genereren met een snelheid van 0,828 Frame per seconde (fps). Bij het kiezen van 4x vergroting in een afstembare lens, was het gezichtsveld ~2 × 2 mm2.
Sensorchipvoorbereiding
elke chip werd gewassen met 75% ethanol en gedeïoniseerd water (DIW), gevolgd door UV-blootstelling gedurende 30 minuten om de oppervlaktecontaminatie te verwijderen en te steriliseren voor elk experiment. Een Flexi-Perm siliconen kamer (Greiner Bio-One) werd geplaatst op de top van de gouden chip om te dienen als een cel cultuur goed. Om de oppervlaktemodificatie voorafgaand aan cel zaaien te bereiken, werd een 100 µg/mL 150 µL collageenoplossing toegevoegd aan de kamer en 2 uur in een incubator bewaard. de chip werd dan gespoeld met gedeïoniseerd water tweemaal en dmem tweemaal voorafgaand aan cel zaaien. Om de cellen een goede vorm te geven, werd de chip 36 uur lang in het groeimedium geïncubeerd, waarna het groeimedium gedurende 10 minuten werd vervangen door een PBS bufferoplossing voor cellen die een balans bereikten.
stroomsysteem
een door zwaartekracht aangedreven meerkanaals geneesmiddelperfusie systeem werd toegepast op injectie en switch van de oplossing. Het debiet is 300 µL / min en de oplossingsomschakelsnelheid rond de cellen kan 1-2 s bereiken.
Gevoeligheidskalibratie
een sensorchip werd bereid zoals beschreven in het vorige deel zonder oppervlaktemodificatie en celzaaien. Eerst stroomde DIW over de chip voor ongeveer 60 s. vervolgens werd het vervangen door 1% (v/v) ethanoloplossing voor een andere 60 s. als een van de meest gebruikte kalibratieoplossing, is 1% ethanol bekend om de SPR hoek van DIW met 60 mDeg te verhogen. Experimentele resultaten toonden aan dat de SPR-intensiteit dienovereenkomstig met 96 I. E. steeg( figuur 1C), wat overeenkomt met een gevoeligheid van 1,6 ΔI.U. / mDeg.
resultaten en discussie
het celmembraan (ook bekend als cytoplasmisch membraan), bestaande uit een lipide bilayer met ingebedde eiwitten, is een semi-permeabel membraan dat het cytoplasma van een cel omsluit. De fixatie en permeabilisatiestappen van cellen en weefselsteekproeven, die de permeabiliteit van celmembraan konden veranderen, zijn cruciale procedures die de successen van immunofluorescente of immunohistochemische analyses konden bepalen. Daarnaast zijn de antilichaamkwaliteit en de immunoreactieprocedure andere belangrijke determinanten voor dit soort experimenten. SPR heeft de eigenschap dat zowel de resonantiehoek als de brekingsindex (RI) bij het sensoroppervlak zeer gevoelig zijn voor de massadichtheid van de oppervlaktelaag in het medium-metalen interface. Daarom kunnen de variaties van de massadichtheid van de cel die plaatsvinden op of in de buurt van de metaalfilm (~200 nm) synchroon worden geregistreerd door de intensiteit van het gereflecteerde licht te meten. Door gebruik te maken van oppervlakte plasmon resonantie imaging techniek, hebben we onderzocht dynamische verdeling van cellulaire massa dichtheid met hoge ruimtelijke en temporele resoluties en betrouwbare gevoeligheid in zowel fixatie en permeabilisatieprocessen in deze studie.
initiële Massadichtheidsverlies in Celfixatie door PFA
de eerste stap om biologische monsters voor immunofluorescente of immunohistochemische analyse te bereiden is gewoonlijk fixatie. En de meest gebruikte fixeermiddelen voor dit soort tests zijn crosslinking fixeermiddelen zoals PFA dat werkt door covalente chemische bindingen te genereren tussen eiwitten in cellen of weefsels. We onderzochten daarom de invloed van PFA behandeling op cellulaire massa dichtheid. Levende BT-474 cellen werden gekweekt op coverslip met een laag bedekt door gouden film met een dikte van 50 nm. Een representatief SPR-beeld dat enkele cellen bevat wordt verstrekt in Figuur 2A. SPR-signalen van elke cel kunnen worden verkregen door een gebied-van-belang in het SPR-beeld te kiezen dat de morfologie van de onderzochte cel overeenkomt. In een typisch experiment, toen de oplossing over de cellen stroomde, werden de sensorgrams van de cellen van SPR verkregen door elke cel te analyseren zoals getoond in Figuur 2B (zwarte kromme). In de voorgaande 242 s, PBS buffer zonder PFA stroomde over de cellen en de basislijn werd bepaald door de systeemstabiliteit (lichtbron en mechanische stabiliteit) en de inherente micromotion signalen gegenereerd door de levende cellen. PFA-oplossing werd vervolgens geïntroduceerd op de 242e seconde, die onmiddellijk het SPR-signaal verhoogde vanwege de relatief grote brekingsindex van 4% PFA-oplossing (bulk-effect). PFA-oplossing liep nog 17 minuten om voldoende fixatie te bereiken. Op de 1237e seconde werd de PFA-oplossing teruggeschakeld naar de zuivere PBS-oplossing. Naast het verminderde bulk effect, werd een daling van de SPR intensiteit van enkele cellen gevonden bij het vergelijken van de signalen vóór (0-242) en na (1237-1545) de PFA behandelingen en het massaverlies percent werd verkregen door de daling waarde te delen aan de initiële waarde. De SPR-sensongrammen van de achtergrond (een aangrenzend gebied zonder celadhesie, blauwe kromme) en een enkele cel behandeld met PBS gedurende 1.500 s (grijze kromme) worden ook getoond in Figuur 2B. statistische analyse op 30 cellen onthult een gemiddeld massadichtheidsverlies van 10 ± 5% Zoals getoond in Figuur 2C. Men vond ook dat, na PFA behandeling, het niveau van de basislijnschommeling in SPR signaal beduidend met de helft of zelfs twee derde werd verminderd, die het verlies van micromotions en fixatie van de behandelde cellen voorstellen zoals in Figuur 2D wordt getoond. dergelijke micromotionsignalen werden geproduceerd door een bos van dynamische cellulaire activiteiten van verschillende celcomponenten met inbegrip van skelet, membranen en organellen. De fixatie beëindigde dergelijke biologische activiteiten en elimineerde daarom de micromotiesignalen, die gepaard gingen met een aanzienlijk verminderde intensiteitsfluctuatie in de SPR-sensogrammen van enkele cellen.
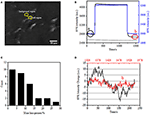
Figuur 2. Cel fixatie proces. (A) Spri beeld van BT-474 cellen. B) SPR-signalen van eencellige (zwarte curve) en achtergrond (blauwe curve) die een oplossingsschakelproces ondergaan: PBS-buffer tot 4% PFA-naar PBS-buffer. SPR signaal van eencellige behandeld met PBS gedurende 1.500 s (grijze curve). C) verdeling van het massaverlies van 30 afzonderlijke cellen. D) geluidsniveau van de cel vóór A) en na B) PFA-behandeling.
osmotische Drukrespons in Celfixatie door PFA
De geïntegreerde structuur van celmembraan, een semi-permeabel membraan, reguleert de homeostase van een cel om evenwicht te bereiken in fysiologische osmotische druk. PFA behandeling werd ook gevonden om de capaciteit in het vernietigen van de membraanintegriteit zoals getoond in Figuur 3 te hebben. Toen de buffer rond de doelcel in <1 s via een geneesmiddelperfusie-systeem veranderde in 25 mM sucrose-oplossing, werd een hypertonische celcultuuromgeving gecreëerd. Voor levende cellen, veroorzaakte de blootstelling aan hypertone oplossing een reeks fysiologische reacties om de intracellulaire en extracellulaire osmotische druk in evenwicht te brengen, die in details in ons vorige werk is onderzocht (Wang et al., 2012a). In deze studie, wordt een typisch SPR-sensorgram van enige fysiologische BT-474 cellen verstrekt in Figuur 3A. na de blootstelling aan hypertone sucrose-oplossing, ondergingen behandelde cellen eerst een dringende krimp, leidend tot een geleidelijke verhoging van SPR intensiteit tot een plateau werd bereikt. Het stelde voor de verhoogde massadichtheid als gevolg van cel krimpt en subcellular componenten die naar de bodem van de gouden cultuur coverslip verzamelen. De geleidelijke toename van de SPR-intensiteit door hypertonische stimulatie is een soort fysiologische Regulatie voor cellulaire osmotische druk, waardoor de fysiologische integriteit van het celmembraan wordt aangegeven. Toen de membraanintegriteit werd vernietigd, bleek de introductie van hypertone sucrose-oplossing onmiddellijk de SPR-intensiteit in een veel kortere tijd te verhogen, zoals getoond in Figuur 3B. Het is omdat de suikermoleculen vrij doorgedrongen in de cellen zonder weerstand van het semi-permeabele membraan en verhoogde de lokale brekingsindex onmiddellijk (bulk effect). Het is duidelijk dat, terwijl de langzame toename van de SPR-intensiteit de fysiologische osmotische Regulatie weerspiegelde (figuur 3A), de snelle sprong aantoonde dat het celmembraan was beschadigd om de vrije toegang van kleine suikermoleculen mogelijk te maken (figuur 3B).

Figuur 3. Osmotische drukreacties van cellen. A) respons van een levende cel op 25 mM sucrose. B) respons van dezelfde cel, gefixeerd (10 min) op 25 mM sucrose.
aanzienlijk verlies van massadichtheid in Celpermeabilisatie door Triton
In het vorige fixatiestadium nam de initiële dichtheid van de celmassa met slechts ~10% af (figuur 2C). Het is redelijk om te speculeren dat de PFA-fixatie slechts lichtjes de membraanintegriteit vernietigde en de doorlaatbaarheid van kleine molecules verhoogde. De meerderheid van de intracellulaire componenten zou nog binnen het cytoplasmic membraan moeten worden gehuisvest. Vervolgens bestudeerden we de invloed van een typisch permeabilisatiewasmiddel, 1% Triton X-100, op cellen die eerder 17 minuten met PFA zijn gefixeerd. Een representatief SPR sensorgram van enkele cellen tijdens blootstelling aan 1% Triton X-100 is weergegeven in Figuur 4A. de introductie van Triton X-100 verhoogde de SPR intensiteit gevolgd door een geleidelijke afname. De eerste verhoging is een gevolg van verhoging brekingsindex van bulkoplossing, en de volgende daling wees op het geleidelijke verlies in de massadichtheid toe te schrijven aan de celpermeabilisatie. De verminderde massadichtheid was overvloediger bij het vergelijken van de SPR–intensiteitsverandering vóór (0-300 s) en na de introductie van detergens (1300-1800 s). Analyse op 30 afzonderlijke cellen toonde aan dat de Triton X-100-behandeling na PFA-fixatie een aanzienlijke afname van de massadichtheid met nog eens 20 ± 5% veroorzaakte, zoals weergegeven in Figuur 4D en Tabel 1. Het is duidelijk dat het detergent Triton X-100 veel meer cellulaire membraanlipiden elimineerde en de membraanintegriteit in dit permeabilisatiestadium ernstig vernietigde. Dit resulteerde in meer intracellular componenten, vooral macromoleculen, om van de cellen vrij te geven. Dit laat ook grote moleculen zoals antilichamen toe om in de cel te komen in de volgende immunoreactiefase. Hoewel de intensiteit van SPR van kleine molecules uitloging na PFA-fixatie werd ontdekt, heeft permeabilization door Triton X-100 detergent duidelijk opgeloste lipiden gebruikt en maakte de cellen veel meer permeabel aan de bewegingen van macromoleculen in en uit het cellichaam.
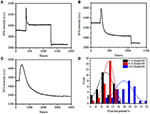
Figuur 4. Massa verlies curven van cel behandeld met verschillende concentratieoplossingen (a) 1,0%, (B) 0,5%, (C) 0,1%. D) verdeling van het massaverlies van 30 afzonderlijke cellen onder verschillende omstandigheden.

Tabel 1. Een samenvatting van de variaties in het verlies van de massadichtheid van statistische cellen in verschillende omstandigheden.
bleek dat het verlies in massadichtheid een vrij snel proces is, dat zich in een paar minuten in de permeabilisatiefase voordeed (figuur 4A). De afname van de massadichtheid volgde grofweg een monotoon verval binnen een periode van 126 s. de typische sensorgrams van enkele cellen onder 0,5 en 0,1% Triton X-100 worden weergegeven in de figuren 4B, C, respectievelijk. Het permeabilisatieproces werd veel langzamer bij het verminderen van de concentratie van detergent. Het duurde 126, 510, 2.600 s voor de drie soorten van de behandelde cellen om massa verlies te voltooien.
conclusie
samenvattend is de dynamische herverdeling van cellulaire massadichtheid in zowel fixatie-als permeabilisatieprocessen gevoelig onderzocht door gebruik te maken van Prisma-gebaseerde Spri-setup met hoge ruimtelijke en temporele resoluties. Fixatief PFA kon aanvankelijk de permeabiliteit van cytoplasmatisch membraan in zekere mate verhogen omdat zijn capaciteit cellulaire proteã nen in zowel membraan als intracellulaire proteã nen fixeert. Het werd ondersteund door (1) de verminderde massadichtheid met ~10% na een fixatiebehandeling van 17 minuten in 4% PFA-oplossing, en (2) de geëlimineerde cellulaire respons op hypertone oplossing, die de vernietiging van cellulaire integriteit aan kleine moleculen zoals suikers aantoonde. Het Detergent Triton X-100 is superieur aan fixatief PFA in het oplossen van lipiden en daarom het verhogen van de permeabiliteit van het celmembraan, begeleidend met het meer substantiële verlies in de massadichtheid toe te schrijven aan de versie van niet alleen kleine molecules maar ook grote molecules en mogelijk sommige organellen zoals blaasjes. Bovendien is de snelheid van massaverlies positief gecorreleerd met Triton X-100 concentratie. Deze resultaten leverden kwantitatieve en dynamische inzichten op over de invloed van fixatie en permeabilisatie op de cellulaire massadichtheid en membraanintegriteit, met implicaties voor het optimaliseren van de voorwaarden voor eencellige biologische experimenten, zoals immunofluorescente en immunohistochemische analyses.
Auteursbijdragen
RC, Y-WS en WW ontwierpen de experimenten. RC, FZ, ML en XW voerden de experimenten uit. RC, Y-WS en WW schreven de paper. RC, FZ, Y-WS en WW bespraken de resultaten en analyseerden de gegevens.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
De handling editor verklaarde een gedeelde affiliatie, hoewel geen andere samenwerking, met de auteurs WW, RC, ML, en XW op het moment van beoordeling.
Dankbetuigingen
wij danken de financiële steun van de National Natural Science Foundation of China (subsidie nr. 21522503).
Abadian, P. N., Kelley, C. P., and Goluch, E. D. (2014). Cellulaire analyse en detectie met behulp van oppervlakte plasmon resonantie technieken. Anaal. Scheikunde. 86, 2799–2812. doi: 10.1021 / ac500135s
PubMed Abstract / CrossRef Full Text / Google Scholar
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Detectie van immuno-complex vorming via oppervlakte plasmon resonantie op goud-gecoate diffractie roosters. Biosensors 3, 211-225. doi: 10.1016 / 0265-928X (87)85002-2
PubMed Abstract / CrossRef Full Text / Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., and Wang, P. (2016). Een microfluidic apparaat met twee compartimenten voor levende celopsporing op lange termijn die op de resonantie van het oppervlakteplasmon wordt gebaseerd. Biomicrofluidics 10: 044109. doi: 10.1063/1.4960487
PubMed Abstract / CrossRef Full Text/Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Formaldehyde fixatie. J. Histochem. Cytochem. 33, 845–853. doi: 10.1177 / 33.8.3894502
PubMed Abstract / CrossRef Full Text / Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Beeldvorming van cel / substraat contacten van levende cellen met oppervlakte plasmon resonantie microscopie. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99)77219-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Homola, J. (2008). Oppervlakte plasmon resonantie sensoren voor detectie van chemische en biologische soorten. Scheikunde. Rev. 108, 462-493. doi: 10.1021 / cr068107d
PubMed Abstract | CrossRef Full Text/Google Scholar
Jamur, M. C., and Oliver, C. (2010). “Permeabilization of cell membranes,” in Immunocytochemical Methods and Protocols, eds C. Oliver and M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef Full Text / Google Scholar
Joshi, S., and Yu, D. (2017). “Chapter 8-Immunofluorescence,” in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha, and M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Full Text / Google Scholar
Kiernan, J. A. (2018). Formaldehyde, formaline, paraformaldehyde en glutaaraldehyde: wat ze zijn en wat ze doen. Micros. Vandaag 8, 8-13. doi: 10.1017/S1551929500057060
CrossRef Full Text/Google Scholar
Koley, D., and Bard, A. J. (2010). Triton X-100 concentratie effecten op membraanpermeabiliteit van een enkele HeLa cel door het scannen van elektrochemische microscopie (SECM). Proc. Natl. Acad. Sci. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract / CrossRef Full Text/Google Scholar
Liedberg, B., Nylander, C., and Lunström, I. (1983). Oppervlakte plasmon resonantie voor gas detectie en biosensing. Sens Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text / Google Scholar
Méjard, R., Griesser, H. J., and Thierry, B. (2014). Optische biosensing voor labelvrije cellulaire studies. TrAC Trends Anaal. Scheikunde. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
CrossRef Full Text / Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Labelvrije weergave van epidermale groeifactor receptor-geïnduceerde respons in enkele levende cellen. Analist 143, 5264-5270. doi: 10.1039 / C8AN01534A
PubMed Abstract | CrossRef Full Text/Google Scholar
Phillips, K. S., and Cheng, Q. (2007). Recente ontwikkelingen in oppervlakte plasmon resonantie gebaseerde technieken voor bioanalyse. Anaal. Bioanal. Scheikunde. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract / CrossRef Full Text/Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Oppervlakte-plasmon microscopie. Natuur 332, 615-617. doi: 10.1038 / 332615a0
CrossRef Full Text / Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B., and Reichert, W. M. (2004). Meting van celmigratie op oppervlaktegebonden fibronectine gradiënten. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
PubMed Abstract / CrossRef Full Text / Google Scholar
Su, Y. W., and Wang, W. (2018). Oppervlakteplasmon resonantie sensing: van gezuiverde biomoleculen tot intacte cellen. Anaal. Bioanal. Scheikunde. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Abstract / CrossRef Full Text / Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K., and Ranganathan, K. (2012). Chemische en fysische basis van routine formaldehyde fixatie. J. Oral Maxillofac. Pathol. 16, 400–405. doi: 10.4103 / 0973-029X. 102496
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Labelvrije beeldvorming, detectie en massameting van enkele virussen door oppervlakteplasmonresonantie. Proc. Natl. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Het in kaart brengen van eencellige-substraatinteracties door de resonantiemicroscopie van het oppervlakteplasmon. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Labelvrij meten en in kaart brengen van bindingskinetiek van membraanproteã nen in enige levende cellen. Nat. Scheikunde. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ drug-receptor bindende kinetiek in enkele cellen: een kwantitatieve label-vrije studie van anti-tumor geneesmiddelresistentie. Sci. Rep. 4: 6609. doi: 10.1038 / srep06609
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Ultragevoelige en ultrasnelle detectie van volledig niet gelabelde levende kankercelreacties op paclitaxel met een biosensor op basis van grafeen. Sens Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef Full Text / Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Oppervlakte plasmon resonantie voor cel-gebaseerde klinische diagnose. Sensors 14, 4948-4959. doi: 10.3390 / s140304948
PubMed Abstract / CrossRef Full Text / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., and Hide, M. (2010). Detectie van brekingsindex veranderingen in individuele levende cellen door middel van oppervlakte plasmon resonantie beeldvorming. Biosens. Bio-elektronica. 26, 674–681. doi: 10.1016 / j.bios.2010.06.065
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Label-vrije het volgen van enig organeltransport in cellen met nanometerprecisie gebruikend een plasmonic weergavetechniek. Small 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract / CrossRef Full Text/Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Kwantificering van epidermale groeifactor receptor expressie niveau en binding kinetiek op celoppervlakken door oppervlakte plasmon resonantie beeldvorming. Anaal. Scheikunde. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstract / CrossRef Full Text / Google Scholar