határok a kémiában
- Bevezetés
- anyagok és módszerek
- anyagok
- sejttenyészet
- prizma alapú SPR képalkotó beállítások
- érzékelő Chip előkészítése
- áramlási rendszer
- érzékenység kalibrálás
- eredmények és megbeszélés
- kezdeti tömegsűrűség-veszteség a sejtek PFA általi rögzítésében
- ozmotikus Nyomásválasz a sejtek PFA általi rögzítésében
- jelentős tömegsűrűség-veszteség a sejt Permeabilizációjában a Triton által
- következtetés
- szerzői hozzájárulások
- összeférhetetlenségi nyilatkozat
- Köszönetnyilvánítás
Bevezetés
az immunfluoreszcencia hatékony módszer a specifikus biomolekulák eloszlásának vizualizálására biológiai mintákban, például sejtekben és szövetekben (Joshi and Yu, 2017). Tipikus sejtalapú immunfluoreszcens vizsgálatokban az adherens sejteket fluoreszcens antitesttel inkubáltuk, hogy lehetővé tegyük a specifikus felismerést és kötődést az antitest és a célmolekula között a sejtekben. Alapos öblítés után a mintát fluoreszcens mikroszkóp alá helyeztük, hogy fluoreszcens képet kapjunk, amelyből a célmolekulák eloszlását a fluoreszcens címkék jelentették. Annak érdekében, hogy megkönnyítsék az ellenanyag hozzáférhetőségét a célmolekulákhoz és gátolják a benne rejlő sejtaktivitást, a mintákat gyakran rögzítették és permeabilizálták a festési eljárások előtt. Különösen akkor voltak szükségesek, amikor a célmolekulák a citoplazmában helyezkedtek el. A sokféle reagens közül a paraformaldehid (PFA) és a Triton X-100 valószínűleg a legszélesebb körben használt a rögzítéshez és a permeabilizáláshoz. A PFA depolimerizációja formaldehid molekulákat eredményezett, hogy kovalens kémiai kötéseket hozzon létre a mintában lévő fehérjék között. A hatásmechanizmus az egyik aminosav-maradék lizin aktiválására támaszkodott. A PFA néhány lipidet is feloldott a sejtmembránokban, amelyek kissé károsították a sejtmembrán integritását (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). A Triton X-100, mint hatékony nem ionos mosószer, feloldhatja a lipideket a sejtmembránokból, így a sejtmembrán átjárhatóbbá vált a fluoreszcens antitest számára. A permeabilizációs lépés több sejtmembrán lipidet távolított el a töltetlen, hidrofil fejcsoportok miatt, amelyek polioxietilén részekből állnak, hogy nagy molekulák, például antitestek kerüljenek a sejtbe (Jamur and Oliver, 2010; Koley and Bard, 2010). A sejtrögzítési és permeabilizációs folyamat sematikus ábrázolása az 1D. ábrán látható. Annak ellenére, hogy a rögzítés és a permeabilizáció rutinszerű eljárássá vált az immunfluoreszcencia és az immunhisztokémia területén, meglehetősen ritka erőfeszítéseket tettek a membrán integritására és a sejtek tömegsűrűségére gyakorolt hatásuk mennyiségi tisztázására egysejtes szinten.
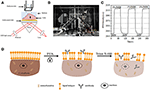
1. ábra. Prism alapú SPR képalkotó beállítások. A) A kísérleti berendezés sematikus ábrázolása. B) a készülék fényképe. C) érzékenységi kalibrációs görbe. D) a sejtrögzítés és permeabilizáció sematikus ábrázolása.
a felszíni plazmonrezonancia (SPR) az 1980-as évek találmánya óta népszerű és hatékony módszer a molekulapárok közötti kötési kinetika meghatározására (Liedberg et al., 1983; Cullen et al., 1987). Ez figyelemre méltó előnyeinek tulajdonítható, beleértve a valós idejű kvantitatív kinetikus mérést nagy időbeli felbontással, a kibővített eszközökkel való kompatibilitást, és ami a legfontosabb, a címkementesség belső jellemzője (Rothenhagen és Knoll, 1988; Phillips és Cheng, 2007; Homola, 2008; Abadian et al., 2014; M., 2014; Yanase et al., 2014; Su és Wang, 2018). A korai alkalmazások elsősorban a biomolekuláris kölcsönhatások jellemzésére és számszerűsítésére összpontosítottak azáltal, hogy a tisztított molekulákat SPR érzékelő szubsztrátokra (arany bevonatú üveglemezekre) immobilizálták. Az ilyen ex situ vizsgálatok nemcsak munkaigényes tisztítási eljárásokat igényeltek, hanem olyan eredményekhez is vezettek, amelyek nem feltétlenül tükrözik az élőlények természetes kölcsönhatását (Phillips and Cheng, 2007; Homola, 2008). Mind a különböző SPR képalkotó (SPRi) rendszerek technikai fejlődése, mind az egysejtű képalkotás és elemzés tudományos motivációja miatt mind a prizma, mind az objektív alapú SPRi technikákat alkalmazták az egyetlen élő sejt tömegeloszlásának ábrázolására címkézés nélkül (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Mindegyiknek megvan a maga érdeme. Az utóbbi nagyobb térbeli felbontással rendelkezik, az előbbi pedig jobb érzékenységgel rendelkezik. A különböző típusú fiziológiai és biológiai stimulációk során az egyes élő sejtek idővesztett SPR-képeinek megfigyelésével fontos térbeli és dinamikus információk a sejt-szubsztrát kölcsönhatásokról (Giebel et al., 1999), sejtvándorlások (Smith et al., 2004), ozmotikus válaszok (Wang et al., 2012A), ligandum-receptor kötő kinetika (Wang et al., 2012b, 2014), jelátviteli utak (Deng et al., 2016), fehérje aktivációs dinamika (Peng et al., 2018), és az élő rákos sejtek gyógyszerválaszai (Wang et al., 2018) kaptak. Például a meglévő tanulmányok egyértelműen kimutatták, hogy az SPRi technikák képesek voltak feltérképezni a tömegsűrűséget, valamint a membrán integritását egysejtes szinten (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). A SPRi képkontrasztja a törésmutató szubcelluláris eloszlásából származott, amelyet nagyjából a helyi tömegsűrűség határozott meg. A specifikus antitestek kötődése a megfelelő antigéneket expresszáló sejtmembránhoz, vagy az élő sejtek stimulálása bizonyos vegyi anyagokkal, heterogén és dinamikus módon megváltoztatta az egyes sejtek tömegsűrűségét (Wang et al., 2012A, b). Az egyedülálló élő sejtek hipertóniás oldatoknak való kitettsége a sejtek összehúzódását indukálta, jelezve a sejtmembránok kiváló integritását (Wang et al., 2012a). Azonban, hogy a fixálás és permeabilizációs kezelések hogyan befolyásolják az egyes sejtek SPR képeit, továbbra sem tisztázott.
jelen munkánkban egy saját fejlesztésű SPRi rendszert alkalmaztunk, hogy folyamatosan rögzítsük több tíz élő sejt idővesztett SPR képeit, amikor a sejteket egymás után 4% PFA oldattal és 1% Triton X-100 oldattal kezeltük. Az egyes sejtek tömegsűrűségét az átlagolt SPRi jel határozta meg. A membrán integritását úgy értékeltük, hogy a sejteket hipertóniás oldatnak tettük ki. Megállapítottuk, hogy a <10% – kal kissé csökkentett tömegsűrűség mellett a PFA-kezelés jelentősen megsemmisítette a sejtek integritását, amint azt a cukormolekulák expozíciója utáni ozmotikus válasz elvesztése jelzi. A Triton X-100 későbbi kezelése azonban jelentősen csökkentette a tömegsűrűséget további 20% – kal, ami a membrán integritásának súlyos megsemmisítésére utal.
anyagok és módszerek
anyagok
Dulbecco foszfátpufferelt sóoldata (PBS, Gibco), szacharóz (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehid (Shanghai Lingfeng Kémiai Reagens Co., Ltd). Az összes reagenst PBS-ben oldottuk.
sejttenyészet
A BT-474 sejteket 37 6CC hőmérsékleten, 5% CO2 és 70% relatív páratartalom mellett tenyésztettük Dubelco módosított Eagle Táptalajában (DMEM, Invitrogen), 10% magzati szarvasmarha szérummal (FBS, Invitrogen), 100 egység/mL penicillinnel és 100 ~ g/mL sztreptomicinnel (Invitrogen). A sejteket 70-80% – os összefolyáskor 0,25% – os tripszin oldattal (Gibco) kezeltük.
prizma alapú SPR képalkotó beállítások
a SPRi rendszer vázlatos ábráját és fényképét az 1a., B. ábra mutatja be.
• fényforrás: 670 nm-es fénykibocsátó dióda (L7868-01, Hamamatsu, Japán) és hőmérséklet-szabályozott rögzítő aljzat (LDM21, Thorlabs, Newton, USA).
• optikai alkatrészek (Edmund Optics, USA): háromszög SF-11 prizma érzékelő chip be (No. 1 BK7 üveg a Fisherbrand-től), egy konvergáló lencse, egy polarizátor és egy hangolható lencse.
• kamera: töltéssel összekapcsolt eszközkamera (Pike F032B, Allied Vision Technology, Newburyport, USA).
A P-polarizált fény közvetlenül eléri az aranybevonatú üvegcsúszda alját a prizmán keresztül, és a kamera rögzíti a visszavert sugarat, hogy SPR képeket készítsen 0,828 képkocka / másodperc (fps) sebességgel. A hangolható objektív 4x-es nagyításának kiválasztásakor a látómező ~2 6 mm2 volt.
érzékelő Chip előkészítése
minden chipet 75% – os etanollal és ionmentesített vízzel (DIW) mostunk, majd 30 percig UV-expozíciót végeztünk, hogy eltávolítsuk a felületi szennyeződést és sterilizáljuk őket minden kísérlet előtt. Az arany chip tetejére Flexi-Perm szilíciumkamrát (Greiner Bio-One) helyeztünk, hogy sejttenyészetként szolgáljon. A sejtvetés előtti felületmódosítás elérése érdekében a kamrába 100 6G/mL 150 ml kollagénoldatot adtunk, és 2 órán át inkubátorban tartottuk.a chipet ezután kétszer ionmentesített vízzel, kétszer DMEM-Mel öblítettük a sejtvetés előtt. Annak érdekében, hogy a sejtek jó állapotban legyenek, a chipet inkubáltuk a tápközegben 36 órán át. a tápközeget ezután PBS pufferoldattal helyettesítettük 10 percig az egyensúlyt elérő sejtek számára.
áramlási rendszer
gravitációs meghajtású többcsatornás gyógyszer perfúziós rendszert alkalmaztunk az injekció beadására és az oldat váltására. Az átfolyási sebesség 300 6L / perc, és az oldat átkapcsolási sebessége a cellák körül elérheti az 1-2 másodpercet.
érzékenység kalibrálás
az előző részben leírtak szerint egy érzékelő chipet készítettünk felületmódosítás és sejtvetés nélkül. Először a DIW körülbelül 60 másodpercig áramlott a chipen. ezután 1% (v/v) etanol oldattal helyettesítettük további 60 másodpercig. az egyik leggyakrabban használt kalibrációs oldatként 1% etanolról ismert, hogy 60 mDeg-rel növeli a DIW SPR szögét. A kísérleti eredmények azt mutatták, hogy az SPR intenzitása ennek megfelelően 96 ne-vel nőtt (1C ábra), ami 1,6 KB-os érzékenységnek felel meg.U. / mDeg.
eredmények és megbeszélés
a sejtmembrán (más néven citoplazmatikus membrán), amely egy lipid kettős rétegből áll beágyazott fehérjékkel, egy félig áteresztő membrán, amely körülveszi a sejt citoplazmáját. A sejtek és szövetminták rögzítési és permeabilizációs lépései, amelyek megváltoztathatják a sejtmembrán permeabilitását, döntő fontosságú eljárások, amelyek meghatározhatják az immunfluoreszcens vagy immunhisztokémiai vizsgálatok sikereit. Ezen túlmenően az antitest minősége és az immunreakciós eljárás más kulcsfontosságú meghatározói az ilyen típusú kísérleteknek. Az SPR jellemzője, hogy mind a rezonáns szög, mind a törésmutató (ri) az érzékelő felület közelében nagyon érzékenyek a felületi réteg tömegsűrűségére a közepes fém interfészen. Ezért a fémfólián vagy annak közelében (~200 nm) zajló cella tömegsűrűség-változásait szinkronban lehet rögzíteni a visszavert fény intenzitásának mérésével. A felszíni plazmon rezonancia képalkotó technika alkalmazásával a celluláris tömegsűrűség dinamikus eloszlását vizsgáltuk nagy térbeli és időbeli felbontással és megbízható érzékenységgel mind a rögzítési, mind a permeabilizációs folyamatokban ebben a tanulmányban.
kezdeti tömegsűrűség-veszteség a sejtek PFA általi rögzítésében
az immunfluoreszcens vagy immunhisztokémiai elemzéshez szükséges biológiai minták előkészítésének első lépése általában a rögzítés. Az ilyen típusú vizsgálatokhoz leggyakrabban használt fixálószerek a térhálósító fixálószerek, mint például a PFA, amely kovalens kémiai kötéseket hoz létre a sejtek vagy szövetek fehérjéi között. Ezért megvizsgáltuk a PFA kezelés hatását a sejtek tömegsűrűségére. Az élő BT-474 sejteket 50 nm vastagságú aranyfóliával bevont fedőlapon tenyésztettük. Az egyes cellákat tartalmazó reprezentatív SPR-kép a 2a. ábrán látható.az egyes cellák SPR-jeleit úgy kaphatjuk meg, hogy az SPR-képben olyan érdekes régiót választunk, amely megfelel a vizsgált sejt morfológiájának. Egy tipikus kísérletben, amikor az oldat átáramlott a sejteken, a sejtek SPR szenzorgramjait az egyes sejtek elemzésével nyertük a 2b.ábrán látható módon (fekete görbe). Az előző 242 másodpercben a PFA nélküli PBS puffer áramlott a cellák felett, és a kiindulási értéket a rendszer stabilitása (fényforrás és mechanikai stabilitás) és az élő sejtek által generált mikromotion jelek határozták meg. Ezután a 242. másodpercben PFA-oldatot vezettek be, amely azonnal megnövelte az SPR jelet a 4% – os PFA-oldat viszonylag nagy törésmutatója miatt (tömeges hatás). A PFA oldat további 17 percig futott a megfelelő rögzítés elérése érdekében. Az 1237. másodpercben a PFA megoldást visszaváltották a tiszta PBS megoldásra. A csökkentett ömlesztett hatás mellett az egyes sejtek SPR-intenzitásának csökkenését tapasztaltuk, amikor összehasonlítottuk a jeleket a PFA kezelések előtt (0-242) és után (1237-1545), és a tömegveszteség százalékát úgy kaptuk meg, hogy a csökkenési értéket a kezdeti értékre osztottuk. A háttér SPR szenzongramjait (szomszédos régió sejtadhézió nélkül, kék görbe) és egy 1500 másodperc alatt PBS-sel kezelt egyetlen sejtet (szürke görbe) szintén a 2b. ábra mutatja.A 30 sejten végzett statisztikai elemzés 10 5% – os átlagos tömegsűrűség-veszteséget mutat, amint azt a 2C. ábra mutatja. Azt is megállapították, hogy a PFA-kezelés után az SPR-jel kiindulási ingadozási szintje szignifikánsan felére vagy akár kétharmadára csökkent, ami a mikromotiók elvesztésére és a kezelt sejtek rögzítésére utal, amint azt a 2D. ábra mutatja.az ilyen mikromotion jeleket egy csomó dinamikus sejtaktivitás generálta különböző sejtkomponensekből, beleértve a csontvázat, a membránokat és az organellákat. A rögzítés megszüntette az ilyen biológiai tevékenységeket, ezért kiküszöbölte a mikromotion jeleket, ami az egyes sejtek SPR szenzogramjainak jelentősen csökkent intenzitási ingadozásával jár együtt.
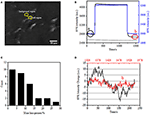
2. ábra. Sejt rögzítési folyamat. A) A BT-474 sejtek SPRi képe. (B) SPR jelek egysejtű (fekete görbe) és a háttér (kék görbe) átesett megoldás kapcsolási folyamat: PBS puffer 4% PFA PBS puffer. 1500 másodperc alatt PBS-sel kezelt egysejtű SPR jel (szürke görbe). C) 30 egyedi sejt Tömegveszteségének eloszlása. D) a cella zajszintje az a) és a b) PFA-kezelés előtt.
ozmotikus Nyomásválasz a sejtek PFA általi rögzítésében
a sejtmembrán integrált szerkezete, egy félig áteresztő membrán, szabályozza a sejt homeosztázisát, hogy elérje az egyensúlyt a fiziológiai ozmotikus nyomásban. Azt is megállapították, hogy a PFA-kezelés képes a membrán integritásának megsemmisítésére, amint azt a 3. ábra mutatja. Amikor a célsejt körüli puffer 25 mM-es szacharózoldattá változott <1 s-ban egy gyógyszer-perfúziós rendszeren keresztül, hipertóniás sejttenyésztési környezetet hoztak létre. Az élő sejtek esetében a hipertóniás oldatnak való kitettség fiziológiai válaszok sorozatát váltotta ki az intracelluláris és az extracelluláris ozmotikus nyomás kiegyensúlyozására, amelyet korábbi munkánkban részletesen megvizsgáltunk (Wang et al., 2012a). Ebben a vizsgálatban az egyetlen fiziológiás BT-474 sejt tipikus SPR szenzorgramját a 3a. ábra mutatja be.hipertóniás szacharózoldatnak való kitettség esetén a kezelt sejtek először sajtoló zsugorodáson estek át, ami az SPR intenzitásának fokozatos növekedéséhez vezetett, amíg fennsíkot nem értek el. Ez azt sugallta, hogy a sejtek zsugorodása és a szubcelluláris komponensek az aranykultúra fedőlapjának alja felé gyülekeznek. Az SPR intenzitásának fokozatos növekedése hipertóniás stimulációval egyfajta fiziológiai szabályozás a sejt ozmotikus nyomására, ezáltal jelezve a sejtmembrán fiziológiai integritását. Amikor a membrán integritása megsemmisült, a hipertóniás szacharózoldat bevezetése sokkal rövidebb idő alatt azonnal növelte az SPR intenzitását, amint azt a 3B.ábra mutatja. Ez azért van, mert a cukormolekulák szabadon behatoltak a sejtekbe a féligáteresztő membrán ellenállása nélkül, és azonnal megnövelték a helyi törésmutatót (tömeges hatás). Nyilvánvaló, hogy míg az SPR intenzitásának lassú növekedése tükrözte a fiziológiás ozmotikus szabályozást (3a ábra), a Gyors ugrás kimutatta, hogy a sejtmembrán megsérült, hogy lehetővé tegye a kis cukormolekulák szabad bejutását (3b ábra).

3. ábra. A sejtek ozmotikus nyomásválaszai. A) egy élő sejt reakciója 25 mM-es szacharózra. (B) válasz az azonos cella rögzített (10 perc) 25 mM szacharóz.
jelentős tömegsűrűség-veszteség a sejt Permeabilizációjában a Triton által
az előző rögzítési szakaszban a kezdeti sejttömeg-sűrűség csak ~10% – kal csökkent (2C ábra). Ésszerű feltételezni, hogy a PFA rögzítés csak kis mértékben rombolta a membrán integritását és növelte a kis molekulák permeabilitását. Az intracelluláris komponensek többségének továbbra is a citoplazmatikus membránon belül kell lennie. Ezt követően megvizsgáltuk egy tipikus permeabilizáló mosószer, 1% Triton X-100 hatását olyan sejtekre, amelyeket korábban 17 percig PFA-val rögzítettek. Az 1% – os Triton X-100 expozíció során az egyes sejtek reprezentatív SPR szenzorgramját a 4a ábra mutatja. a Triton X-100 bevezetése növelte az SPR intenzitást, majd fokozatos csökkenést követett. Az első növekedés az ömlesztett oldat törésmutatójának növekedésének következménye, az ezt követő csökkenés pedig a tömegsűrűség fokozatos csökkenését jelezte a sejt permeabilizációja miatt. A csökkentett tömegsűrűség nagyobb volt, ha összehasonlítottuk az SPR intenzitás változását a mosószer bevezetése előtt (0-300 s) és után (1300-1800 s). 30 egyes sejten végzett elemzés kimutatta, hogy a Triton X-100 kezelés jelentős tömegsűrűség-csökkenést eredményezett további 20 6% – kal a PFA rögzítés után, amint azt a 4D Ábra és az 1.táblázat mutatja. Nyilvánvaló, hogy a Triton X-100 mosószer sokkal több sejtmembrán lipidet távolított el, és súlyosan megsemmisítette a membrán integritását ebben a permeabilizációs szakaszban. Ennek eredményeként több intracelluláris komponens, különösen makromolekula szabadult fel a sejtekből. Ez lehetővé teszi a nagy molekulák, például az antitestek bejutását a sejtbe a következő immunreakciós szakaszban. Bár a kis molekulák kimosódásának SPR intenzitását a PFA rögzítés után észlelték, a permeabilizáció a Triton X-100 detergens alkalmazásával egyértelműen oldotta a lipideket, és a sejteket sokkal jobban áteresztővé tette a makromolekulák mozgására a sejttestben és azon kívül.
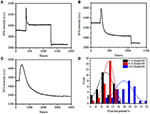
4. ábra. A különböző koncentrációjú oldatokkal kezelt sejtek tömegveszteségi görbéi (A) 1,0%, (B) 0,5%, (C) 0,1%. D) 30 egyes sejt Tömegveszteségének eloszlása különböző körülmények között.

1. táblázat. A statisztikai sejtek tömegsűrűség-veszteségének variációinak összefoglalása különböző körülmények között.
azt találtuk, hogy a tömegsűrűség csökkenése meglehetősen gyors folyamat, amely néhány perc alatt permeabilizációs szakaszban történt (4a ábra). A tömegsűrűség csökkenése nagyjából monoton bomlást követett 126 s időtartamon belül.a 0,5,illetve 0,1% Triton X-100 alatti egyes sejtek tipikus érzékelői a 4b, C ábrákon jelennek meg. A permeabilizációs folyamat sokkal lassabb lett a mosószer koncentrációjának csökkentésekor. 126, 510, 2600 másodpercre volt szükség ahhoz, hogy a kezelt sejtek három fajtája befejezze a tömegveszteséget.
következtetés
összefoglalva, a celluláris tömegsűrűség dinamikus újraelosztását mind a rögzítési, mind a permeabilizációs folyamatokban érzékenyen vizsgálták prizma-alapú SPRi beállítás alkalmazásával, nagy térbeli és időbeli felbontással. A fixáló PFA kezdetben bizonyos mértékben növelheti a citoplazmatikus membrán permeabilitását, mivel képes rögzíteni a sejtfehérjéket mind a membrán, mind a sejten belüli fehérjékben. Ezt támasztotta alá (1) a csökkent tömegsűrűség ~10%-kal egy 17 perces fixációs kezelés után 4% PFA oldatban, valamint (2) a hipertóniás oldatra adott eliminált sejtválasz, amely bizonyította a sejtek integritásának pusztulását kis molekulákra, például cukrokra. A detergens Triton X-100 a lipidek oldásában felülmúlja a fixáló PFA-t, ezért növeli a sejtmembrán permeabilitását, ami a tömegsűrűség jelentősebb veszteségével jár, nemcsak a kis molekulák, hanem a nagy molekulák és esetleg egyes organellák, például vezikulák felszabadulása miatt. Ezenkívül a tömegveszteség mértéke pozitívan korrelál a Triton X-100 koncentrációval. Ezek az eredmények kvantitatív és dinamikus megértést nyújtottak a rögzítés és permeabilizáció hatására a sejtek tömegsűrűségére és a membrán integritására, és hatással voltak az egysejtű biológiai kísérletek, például immunfluoreszcens és immunhisztokémiai vizsgálatok feltételeinek optimalizálására.
szerzői hozzájárulások
RC, Y-WS és WW tervezte a kísérleteket. RC, FZ, ML és XW végezte a kísérleteket. RC, Y-WS és WW írta a dolgozatot. Az RC, Az FZ, Az Y-WS és a WW megvitatta az eredményeket és elemezte az adatokat.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
a kezelőszerkesztő megosztott hovatartozást jelentett be, bár más együttműködést nem, a WW, RC, ML és XW szerzőkkel a felülvizsgálat idején.
Köszönetnyilvánítás
köszönjük a kínai Nemzeti Természettudományi Alapítvány pénzügyi támogatását (Grant No.21522503).
Abadian, P. N., Kelley, C. P. és Goluch, E. D. (2014). Celluláris analízis és detektálás felületi plazmon rezonancia technikák alkalmazásával. Anális. Kémia. 86, 2799–2812. doi: 10.1021 / ac500135s
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Cullen, D. C., Brown, R. G. W., and Lowe, C. R. (1987). Az immuno-komplex képződés kimutatása felületi plazmon rezonancián keresztül aranybevonatú diffrakciós rácsokon. Bioszenzorok 3, 211-225. doi: 10.1016 / 0265-928X (87) 85002-2
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
Deng, S., Yu, X., Liu, R., Chen, W., és Wang, P. (2016). Két rekeszes mikrofluidikus eszköz hosszú távú élő sejtek kimutatására felszíni plazmon rezonancia alapján. Biomikrofluidika 10: 044109. doi: 10.1063/1.4960487
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, P. P. (1985). Formaldehid rögzítés. J. Histochem. Citochem. 33, 845–853. doi: 10.1177 / 33.8.3894502
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Giebel, KF, Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Az élő sejtek sejt / szubsztrát érintkezőinek képalkotása felületi plazmon rezonancia mikroszkóppal. Biophys. J. 76, 509-516. doi: 10.1016 / S0006-3495 (99) 77219-X
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
Homola, J. (2008). Felszíni plazmon rezonancia érzékelők kémiai és biológiai fajok kimutatására. Kémia. Rev. 108, 462-493. doi: 10.1021 / cr068107d
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Jamur, MC, and Oliver, C. (2010). “A sejtmembránok permeabilizációja” in Immunocytochemical Methods and Protocols, eds C. Oliver és M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef teljes szöveg | Google Tudós
Joshi, S., and Yu, D. (2017). “8. fejezet-immunfluoreszcencia” in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha és M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / 978-0-12-803077-6.00008-4
CrossRef teljes szöveg / Google Tudós
Kiernan, J. A. (2018). Formaldehid, formalin, paraformaldehid és glutáraldehid: mik ezek és mit csinálnak. Micros. Ma 8, 8-13. doi: 10.1017 / S1551929500057060
CrossRef teljes szöveg / Google Tudós
Koley, D., And Bard, A. J. (2010). A Triton X-100 koncentráció hatása egyetlen HeLa sejt membrán permeabilitására elektrokémiai mikroszkópia (SECM) letapogatásával. Proc. NAT. Acad. Sci. U. S. A. 107, 16783-16787. doi: 10.1073/pnas.1011614107
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Liedberg, B., Nylander, C., és Lunstr, I. (1983). Felületi plazmon rezonancia gáz detektálására és bioszenzálására. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text / Google Scholar
m Enterprises, R., Griesser, H. J., and Thierry, B. (2014). Optikai bioszenzálás címke nélküli celluláris vizsgálatokhoz. Közlekedési Trendek Anális. Kémia. 53, 178–186. doi: 10.1016 / j. trac.2013.08.012
CrossRef teljes szöveg | Google Tudós
Peng, Z., Lu, J., Zhang, L., Liu, Y., and Li, J. (2018). Az epidermális növekedési faktor receptor által kiváltott válasz címkamentes képalkotása egyetlen élő sejtben. Elemző 143, 5264-5270. doi: 10.1039 / C8AN01534A
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Phillips, Ks, And Cheng, Q. (2007). A bioanalízis felszíni plazmon rezonancia alapú technikáinak legújabb fejleményei. Anális. Bioanal. Kémia. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text/Google Scholar
Rothenheim, B., and Knoll, W. (1988). Felszíni plazmon mikroszkópia. Természet 332, 615-617. doi: 10.1038/332615a0
CrossRef teljes szöveg | Google Tudós
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B. és Reichert, W. M. (2004). A sejtvándorlás mérése a felülethez kötött fibronektin gradienseken. Langmuir 20, 8279-8286. doi: 10.1021 / la0489763
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Su, Y. W., and Wang, W. (2018). Felületi plazmon rezonancia érzékelés: a tisztított biomolekuláktól az ép sejtekig. Anális. Bioanal. Kémia. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, Egyesült Királyság, és Ranganathan, K. (2012). A formaldehid rutinszerű rögzítésének kémiai és fizikai alapjai. J. Orális Maxillofac. Pathol. 16, 400–405. doi: 10.4103 / 0973-029X.102496
PubMed absztrakt | CrossRef teljes szöveg | Google Tudós
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Címke nélküli képalkotás, kimutatás és az egyes vírusok tömegének mérése felszíni plazmon rezonanciával. Proc. NAT. Acad. Sci. U. S. A. 107, 16028-16032. doi: 10.1073/pnas.1005264107
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Wang, Wang, S., Liu, Q., Wu, J., and Tao, N. (2012a). Egysejt-szubsztrát kölcsönhatások feltérképezése felületi plazmon rezonancia mikroszkóppal. Langmuir 28, 13373-13379. doi: 10.1021 / la301712h
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). A membránfehérjék kötési kinetikájának címkézés nélküli mérése és feltérképezése egyetlen élő sejtben. Nat. Kémia. 4, 846–853. doi: 10.1038/nchem.1434
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ gyógyszer-receptor kötő kinetika egyetlen sejtben: a daganatellenes gyógyszerrezisztencia kvantitatív, címke nélküli vizsgálata. Sci. REP. 4:6609. doi: 10.1038 / srep06609
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). A paklitaxelre adott teljes jelöletlen élő rákos sejtek ultraérzékeny és ultragyors detektálása grafén alapú bioszenzorral. Sens. Actuat. B Kémia. 263, 417–425. doi: 10.1016 / j.snb.2018.02.095
CrossRef teljes szöveg / Google Tudós
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Felszíni plazmon rezonancia sejtalapú klinikai diagnózishoz. Érzékelők 14, 4948-4959. doi: 10.3390 / s140304948
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W. és Hide, M. (2010). A törésmutató változásainak kimutatása az egyes élő sejtekben felületi plazmon rezonancia képalkotással. Bioszének. Bioelektron. 26, 674–681. doi: 10.1016 / j.bios.2010.06.065
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Az egyes organellák transzportjának címke nélküli nyomon követése a sejtekben nanométer pontossággal plazmonikus képalkotó technikával. Kis 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Az epidermális növekedési faktor receptor expressziós szintjének és a sejtfelszíni kötődés kinetikájának mennyiségi meghatározása felületi plazmon rezonancia képalkotással. Anális. Kémia. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós