Grenzen in der Chemie
- Einführung
- Materialien und Methoden
- Materialien
- Zellkultur
- Prismenbasierte SPR-Bildgebungsaufbauten
- Vorbereitung des Sensorchips
- Flow-System
- Empfindlichkeitskalibrierung
- Ergebnisse und Diskussion
- Anfänglicher Massendichteverlust bei der Zellfixierung durch PFA
- Osmotische Druckreaktion bei der Zellfixierung durch PFA
- Erheblicher Massendichteverlust bei der Zellpermeabilisierung durch Triton
- Fazit
- Autorenbeiträge
- Erklärung zum Interessenkonflikt
- Danksagung
Einführung
Die Immunfluoreszenz ist eine leistungsstarke Technik zur Visualisierung der Verteilung spezifischer Biomoleküle in biologischen Proben wie Zellen und Geweben (Joshi und Yu, 2017). In typischen zellbasierten Immunfluoreszenz-Assays wurden adhärente Zellen mit fluoreszierendem Antikörper inkubiert, um eine spezifische Erkennung und Bindung zwischen dem Antikörper und dem Zielmolekül in den Zellen zu ermöglichen. Nach gründlichem Spülen wurde die Probe unter ein Fluoreszenzmikroskop gestellt, um ein Fluoreszenzbild zu erhalten, aus dem die Verteilung der Zielmoleküle durch die fluoreszierenden Tags gemeldet wurde. Um die Zugänglichkeit von Antikörpern zu den Zielmolekülen zu erleichtern und die inhärente zelluläre Aktivität zu hemmen, wurden die Proben häufig vor den Färbeverfahren fixiert und permeabilisiert. Sie waren besonders notwendig, wenn sich die Zielmoleküle im Zytoplasma befanden. Unter vielen Arten von Reagenzien sind Paraformaldehyd (PFA) und Triton X-100 wahrscheinlich die am häufigsten verwendeten für die Fixierung bzw. Die Depolymerisation von PFA erzeugte Formaldehydmoleküle, um kovalente chemische Bindungen zwischen Proteinen in der Probe herzustellen. Der Wirkungsmechanismus beruhte auf der Aktivierung eines der Aminosäurereste Lysin. PFA löste auch einige Lipide in Zellmembranen auf, die die Integrität der Zellmembran leicht schädigten (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100 konnte als wirksames nichtionisches Detergens Lipide aus Zellmembranen auflösen, so dass die Zellmembran für den fluoreszierenden Antikörper durchlässiger wurde. Der Permeabilisierungsschritt entfernte mehr Zellmembranlipide aufgrund seiner ungeladenen, hydrophilen Kopfgruppen, die aus Polyoxyethylenresten bestehen, damit große Moleküle wie Antikörper in die Zelle gelangen können (Jamur und Oliver, 2010; Koley und Bard, 2010). Eine schematische Darstellung der Zellfixierung und des Permeabilisierungsprozesses ist in Abbildung 1D dargestellt. Trotz der Tatsache, dass Fixierung und Permeabilisierung zu Routineverfahren in der Immunfluoreszenz und Immunhistochemie geworden sind, wurden ziemlich seltene Anstrengungen unternommen, um ihre Einflüsse auf die Membranintegrität und die zelluläre Massendichte auf Einzelzellebene quantitativ zu klären.
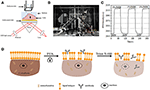
Abbildung 1. Prism-basierte SPR-Imaging-Setups. (A) Schematische Darstellung des Versuchsaufbaus. B) Ein Foto des Geräts. (C) Empfindlichkeit kalibrierung kurve. (D) Schematische Darstellung der Zellfixierung und Permeabilisierung.
Die Oberflächenplasmonenresonanz (SPR) ist seit ihrer Erfindung in den 1980er Jahren eine beliebte und leistungsfähige Technik zur Bestimmung der Bindungskinetik zwischen einem Molekülpaar (Liedberg et al., 1983; Cullen et al., 1987). Dies wird seinen bemerkenswerten Vorteilen zugeschrieben, einschließlich quantitativer kinetischer Echtzeitmessungen mit hohen zeitlichen Auflösungen, Kompatibilität mit erweiterten Geräten und vor allem seiner intrinsischen Eigenschaft, markierungsfrei zu sein (Rothenhäusler und Knoll, 1988; Phillips und Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su und Wang, 2018). Frühe Anwendungen konzentrierten sich hauptsächlich auf die Charakterisierung und Quantifizierung biomolekularer Wechselwirkungen durch Immobilisierung gereinigter Moleküle auf SPR-Sensorsubstraten (goldbeschichtete Objektträger). Solche Ex-situ-Studien erforderten nicht nur die arbeitsintensiven Reinigungsverfahren, sondern führten auch zu Ergebnissen, die möglicherweise nicht die natürliche Interaktion in Lebewesen widerspiegeln (Phillips und Cheng, 2007; Homola, 2008). Angetrieben durch den technischen Fortschritt in verschiedenen SPR-Bildgebungssystemen (SPRi) und die wissenschaftliche Motivation in der Einzelzellbildgebung und -analyse wurden sowohl Prisma- als auch objektivbasierte SPRi-Techniken eingesetzt, um die Massenverteilung einzelner lebender Zellen ohne Markierung abzubilden (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Jeder hat seine eigenen Vorzüge. Letzteres hat eine höhere räumliche Auflösung und ersteres eine bessere Empfindlichkeit. Durch die Überwachung der zeitlich abgelaufenen SPR-Bilder einzelner lebender Zellen während verschiedener physiologischer und biologischer Stimulationen konnten wichtige räumliche und dynamische Informationen über die Zell-Substrat-Wechselwirkungen gewonnen werden (Giebel et al., 1999), Zellmigrationen (Smith et al., 2004), osmotische Reaktionen (Wang et al., 2012a), Ligand-Rezeptor-Bindungskinetik (Wang et al., 2012b, 2014), Signalwege (Deng et al., 2016), protein activation dynamics (Peng et al., 2018) und Wirkstoffreaktionen auf lebende Krebszellen (Wang et al., 2018) erhalten wurden. Zum Beispiel haben bestehende Studien eindeutig gezeigt, dass SPRi-Techniken in der Lage waren, die Massendichte sowie die Membranintegrität auf Einzelzellebene abzubilden (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). Der Bildkontrast von SPRi ergab sich aus der subzellulären Verteilung des Brechungsindex, die grob durch die lokale Massendichte bestimmt wurde. Es wurde festgestellt, dass die Bindung spezifischer Antikörper an die Zellmembran, die die entsprechenden Antigene exprimierten, oder die Stimulierung der lebenden Zellen mit bestimmten Chemikalien die Massendichte einzelner Zellen auf heterogene und dynamische Weise verändert (Wang et al., 2012a, b). Es wurde festgestellt, dass die Exposition einzelner lebender Zellen gegenüber hypertonischen Lösungen die Kontraktion von Zellen induziert, was auf die hervorragende Integrität von Zellmembranen hinweist (Wang et al., 2012a). Wie sich die Fixierungs- und Permeabilisierungsbehandlungen jedoch auf die SPR-Bilder einzelner Zellen auswirken würden, bleibt unklar.In der vorliegenden Arbeit verwendeten wir ein selbstgebautes SPRi-System, um kontinuierlich die zeitverlaufenen SPR-Bilder von Dutzenden einzelner lebender Zellen aufzuzeichnen, wenn die Zellen nacheinander mit 4% PFA-Lösung und 1% Triton X-100-Lösung behandelt wurden. Die Massendichte von Einzelzellen wurde durch das gemittelte SPRi-Signal bestimmt. Die Membranintegrität wurde bewertet, indem die Zellen hypertoner Lösung ausgesetzt wurden. Es wurde festgestellt, dass zusätzlich zu der leicht reduzierten Massendichte von <10% die PFA-Behandlung die Zellintegrität signifikant zerstörte, was durch den Verlust der osmotischen Reaktion bei der Exposition von Zuckermolekülen angezeigt wird. Die anschließende Behandlung mit Triton X-100 reduzierte jedoch die Massendichte signifikant um weitere 20%, was auf eine schwere Zerstörung der Membranintegrität hindeutet.
Materialien und Methoden
Materialien
Dulbecco phosphatgepufferte Kochsalzlösung (PBS, Gibco), Saccharose (Sinopharm Chemical Reagent Co., Ltd), Triton X-100 (Aladdin), Paraformaldehyd (Shanghai Lingfeng Chemical Reagenz Co., Ltd). Alle Reagenzien wurden in PBS gelöst.
Zellkultur
BT-474-Zellen wurden bei 37°C mit 5% CO2 und 70% relativer Luftfeuchtigkeit in Dubelcos modifiziertem Eagle-Medium (DMEM, Invitrogen) mit 10% fötalem Rinderserum (FBS, Invitrogen), 100 Einheiten /ml Penicillin und 100 µg/ml Streptomycin (Invitrogen) kultiviert. Zellen wurden passiert, wenn sie 70-80% konfluent waren, indem sie mit 0,25% iger Trypsinlösung (Gibco) behandelt wurden.
Prismenbasierte SPR-Bildgebungsaufbauten
Eine schematische Darstellung und ein Foto des SPRi-Systems sind in den Abbildungen 1A, B dargestellt. Das SPRi-Gerät besteht hauptsächlich aus drei Teilen: Lichtquelle, optische Komponenten und Kamera.
• Lichtquelle: Eine 670 nm Leuchtdiode (L7868-01, Hamamatsu, Japan) und eine temperaturgesteuerte Montagesockel (LDM21, Thorlabs, Newton, USA).
• Optische Komponenten (Edmund Optics, USA): Ein dreieckiges SF-11-Prisma mit einem Sensorchip (Nr. 1 BK7-Glas von Fisherbrand), eine Sammellinse, ein Polarisator und eine abstimmbare Linse.
• Kamera: Ladungsgekoppelte Gerätekamera (Pike F032B, Allied Vision Technology, Newburyport, USA).
Das p-polarisierte Licht trifft durch das Prisma direkt auf den Boden des goldbeschichteten Glasschlittens und die Kamera erfasst den reflektierten Strahl, um SPR-Bilder mit einer Rate von 0,828 Bildern pro Sekunde (fps) zu erzeugen. Bei der Wahl einer 4-fachen Vergrößerung in einem abstimmbaren Objektiv betrug das Sichtfeld ~ 2 × 2 mm2.
Vorbereitung des Sensorchips
Jeder Chip wurde mit 75% Ethanol und deionisiertem Wasser (DIW) gewaschen, gefolgt von einer UV-Belichtung für 30 min, um die Oberflächenkontamination zu entfernen und vor jedem Experiment zu sterilisieren. Eine Flexi-Perm-Siliziumkammer (Greiner Bio-One) wurde auf den Goldchip gelegt, um als Zellkulturschacht zu dienen. Um die Oberflächenmodifikation vor der Zellsaat zu erreichen, wurde eine 100 µg / ml 150 µL Kollagenlösung in die Kammer gegeben und 2 h in einem Inkubator aufbewahrt. Um die Zellen in eine gute Form zu bringen, wurde der Chip im Wachstumsmedium für 36 h inkubiert. Das Wachstumsmedium wurde dann für 10 min durch PBS-Pufferlösung ersetzt, um ein Gleichgewicht der Zellen zu erreichen.
Flow-System
Ein schwerkraftgetriebenes Mehrkanal-Arzneimittelperfusionssystem wurde zur Injektion und zum Umschalten der Lösung verwendet. Die Durchflussrate beträgt 300 µL/min und die Lösungsumschaltrate um die Zellen kann 1-2 s erreichen.
Empfindlichkeitskalibrierung
Ein Sensorchip wurde wie im vorhergehenden Teil beschrieben ohne Oberflächenmodifikation und Zellsaat hergestellt. Erste, DIW floss über die chip für über 60 s. Dann, es wurde ersetzt durch 1% (v/v) ethanol lösung für eine andere 60 s. Als eine der am häufigsten verwendet kalibrierung lösung, 1% ethanol ist bekannt zu erhöhen die SPR winkel von DIW durch 60 mDeg. Experimentelle Ergebnisse zeigten, dass die SPR-Intensität dementsprechend um 96 IE anstieg (Abbildung 1C), was einer Empfindlichkeit von 1,6 ΔI entspricht.U./mDeg.
Ergebnisse und Diskussion
Die Zellmembran (auch Zytoplasmamembran genannt), bestehend aus einer Lipiddoppelschicht mit eingebetteten Proteinen, ist eine semipermeable Membran, die das Zytoplasma einer Zelle umschließt. Die Fixierungs- und Permeabilisierungsschritte von Zellen und Gewebeproben, die die Permeabilität der Zellmembran verändern könnten, sind entscheidende Verfahren, die den Erfolg immunfluoreszierender oder immunhistochemischer Assays bestimmen könnten. Darüber hinaus sind die Antikörperqualität und das Immunreaktionsverfahren weitere wichtige Determinanten für diese Art von Experimenten. SPR hat die Eigenschaft, dass sowohl der Resonanzwinkel als auch der Brechungsindex (RI) nahe der Abtastoberfläche hochempfindlich für die Massedichte der Oberflächenschicht in der Medium-Metall-Grenzfläche sind. Daher könnten die Massendichteschwankungen der Zelle, die auf oder in der Nähe des Metallfilms (~ 200 nm) stattfinden, synchron aufgezeichnet werden, indem die Intensität des reflektierten Lichts gemessen wird. Durch den Einsatz der Oberflächenplasmonenresonanztomographie haben wir in dieser Studie die dynamische Verteilung der zellulären Massendichte mit hohen räumlichen und zeitlichen Auflösungen und zuverlässiger Empfindlichkeit sowohl bei Fixierungs- als auch bei Permeabilisierungsprozessen untersucht.
Anfänglicher Massendichteverlust bei der Zellfixierung durch PFA
Der erste Schritt zur Vorbereitung biologischer Proben für die immunfluoreszierende oder immunhistochemische Analyse ist normalerweise die Fixierung. Die am häufigsten verwendeten Fixiermittel für diese Art von Assays sind vernetzende Fixiermittel wie PFA, die kovalente chemische Bindungen zwischen Proteinen in Zellen oder Geweben erzeugen. Wir untersuchten daher den Einfluss der PFA-Behandlung auf die Zellmassendichte. Lebende BT-474-Zellen wurden auf Deckglas kultiviert, das mit einem Goldfilm mit einer Dicke von 50 nm beschichtet war. Ein repräsentatives SPR-Bild, das einzelne Zellen enthält, ist in Abbildung 2A dargestellt. SPR-Signale jeder Zelle können erhalten werden, indem eine Region von Interesse im SPR-Bild ausgewählt wird, die der Morphologie der untersuchten Zelle entspricht. In einem typischen Experiment, wenn Lösung über die Zellen floss, wurden SPR-Sensorprogramme der Zellen erhalten, indem jede Zelle analysiert wurde, wie in Abbildung 2B (schwarze Kurve) gezeigt. In den vorhergehenden 242 s floss PBS-Puffer ohne PFA über die Zellen und die Grundlinie wurde durch die Systemstabilität (Lichtquelle und mechanische Stabilität) und die inhärenten Mikrobewegungssignale bestimmt, die von den lebenden Zellen erzeugt wurden. PFA-Lösung wurde dann in der 242. Sekunde eingeführt, was das SPR-Signal aufgrund des relativ großen Brechungsindex von 4% PFA-Lösung sofort erhöhte (Bulk-Effekt). Die PFA-Lösung lief weitere 17 Minuten, um eine ausreichende Fixierung zu erreichen. In der 1237. Sekunde wurde die PFA-Lösung wieder auf reine PBS-Lösung umgestellt. Zusätzlich zu dem verringerten Masseneffekt wurde beim Vergleich der Signale vor (0-242) und nach (1237-1545) den PFA-Behandlungen eine Abnahme der SPR-Intensität einzelner Zellen festgestellt und der Massenverlustprozentsatz wurde durch Dividieren des Abnahmewerts auf den Anfangswert erhalten. Die SPR-Sensongramme des Hintergrunds (eine angrenzende Region ohne Zelladhäsion, blaue Kurve) und einer einzelnen Zelle, die während 1.500 s mit PBS behandelt wurde (graue Kurve), sind ebenfalls in Abbildung 2B dargestellt. Die statistische Analyse an 30 Zellen zeigt einen gemittelten Massendichteverlust von 10 ± 5%, wie in Abbildung 2C gezeigt. Es wurde auch festgestellt, dass nach der PFA-Behandlung die Grundlinienfluktuation im SPR-Signal signifikant um die Hälfte oder sogar zwei Drittel reduziert wurde, was auf den Verlust von Mikrobewegungen und Fixierung der behandelten Zellen hindeutet, wie in Abbildung 2D gezeigt. Solche Mikrobewegungssignale wurden durch eine Reihe dynamischer zellulärer Aktivitäten von verschiedenen Zellkomponenten einschließlich Skelett, Membranen und Organellen erzeugt. Die Fixierung beendete solche biologischen Aktivitäten und eliminierte daher die Mikrobewegungssignale, was mit einer signifikant reduzierten Intensitätsschwankung in den SPR-Sensogrammen einzelner Zellen einherging.
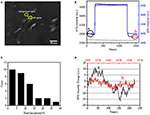
Abbildung 2. Zellfixierungsprozess. (A) SPRi-Bild von BT-474-Zellen. (B) SPR-Signale von Einzelzellen (schwarze Kurve) und Hintergrund (blaue Kurve), die einen Lösungsumschaltprozess durchlaufen: PBS-Puffer zu 4% PFA zu PBS-Puffer. SPR-Signal einer mit PBS behandelten Einzelzelle während 1.500 s (graue Kurve). (C) Massenverlustverteilung von 30 Einzelzellen. (D) Geräuschpegel der Zelle vor (a) und nach (b) PFA-Behandlung.
Osmotische Druckreaktion bei der Zellfixierung durch PFA
Die integrierte Struktur der Zellmembran, einer semipermeablen Membran, reguliert die Homöostase einer Zelle, um ein Gleichgewicht des physiologischen osmotischen Drucks zu erreichen. Es wurde auch festgestellt, dass die PFA-Behandlung die Membranintegrität zerstören kann, wie in Abbildung 3 gezeigt. Wenn der Puffer um die Zielzelle in <1 s über ein Arzneimittelperfusionssystem in 25 mM Saccharoselösung umgewandelt wurde, wurde eine hypertonische Zellkulturumgebung geschaffen. Bei lebenden Zellen löste die Exposition gegenüber hypertonischer Lösung eine Reihe physiologischer Reaktionen aus, um den intrazellulären und extrazellulären osmotischen Druck auszugleichen, was in unserer vorherigen Arbeit ausführlich untersucht wurde (Wang et al., 2012a). In dieser Studie ist ein typisches SPR-Sensorgramm einzelner physiologischer BT-474-Zellen in Abbildung 3A dargestellt. Bei der Exposition gegenüber hypertonischer Saccharoselösung wurden die behandelten Zellen zunächst einem Pressschrumpf unterzogen, was zu einem allmählichen Anstieg der SPR-Intensität führte, bis ein Plateau erreicht wurde. Es deutete auf die erhöhte Massendichte als Folge von Zellschrumpfung und subzellulären Komponenten hin, die sich zum Boden des Goldkulturdeckglases sammeln. Der allmähliche Anstieg der SPR-Intensität durch hypertonische Stimulation ist eine Art physiologische Regulation des zellulären osmotischen Drucks, was auf die physiologische Integrität der Zellmembran hinweist. Wenn die Membranintegrität zerstört wurde, wurde festgestellt, dass die Einführung einer hypertonischen Saccharoselösung die SPR-Intensität in einer viel kürzeren Zeit sofort erhöhte, wie in Abbildung 3B gezeigt. Dies liegt daran, dass die Zuckermoleküle ohne Widerstand der semipermeablen Membran frei in die Zellen eindrangen und den lokalen Brechungsindex sofort erhöhten (Bulk-Effekt). Es ist klar, dass der langsame Anstieg der SPR-Intensität zwar die physiologische osmotische Regulation widerspiegelte (Abbildung 3A), der schnelle Sprung jedoch zeigte, dass die Zellmembran beschädigt war, um den freien Eintritt kleiner Zuckermoleküle zu ermöglichen (Abbildung 3B).

Abbildung 3. Osmotische Druckreaktionen von Zellen. (A) Reaktion einer lebenden Zelle auf 25 mM Saccharose. (B) Reaktion derselben Zelle fixiert (10 min) auf 25 mM Saccharose.
Erheblicher Massendichteverlust bei der Zellpermeabilisierung durch Triton
In der vorherigen Fixierungsstufe verringerte sich eine anfängliche Zellmassendichte nur um ~ 10% (Abbildung 2C). Es ist vernünftig zu spekulieren, dass die PFA-Fixierung die Membranintegrität nur geringfügig zerstörte und die Permeabilität kleiner Moleküle erhöhte. Die Mehrheit der intrazellulären Komponenten sollte sich noch in der Zytoplasmamembran befinden. Anschließend untersuchten wir den Einfluss eines typischen Permeabilisierungsmittels, 1% Triton X-100, auf Zellen, die zuvor 17 Minuten mit PFA fixiert wurden. Ein repräsentatives SPR-Sensorgramm einzelner Zellen während der Exposition mit 1% Triton X-100 ist in Abbildung 4A dargestellt. Die Einführung von Triton X-100 erhöhte die SPR-Intensität, gefolgt von einer allmählichen Abnahme. Der erste Anstieg ist eine Folge des Anstiegs Brechungsindex der Bulk-Lösung, und die folgende Abnahme zeigte den allmählichen Verlust in der Massendichte aufgrund der Zellpermeabilisierung. Die reduzierte Massendichte war beim Vergleich der SPR–Intensitätsänderung vor (0-300 s) und nach der Einführung von Detergens (1.300-1.800 s) stärker ausgeprägt. Die Analyse an 30 Einzelzellen zeigte, dass die Triton X-100-Behandlung nach PFA-Fixierung eine erhebliche Abnahme der Massendichte um weitere 20 ± 5% verursachte, wie in Abbildung 4D und Tabelle 1 gezeigt. Es ist klar, dass das Detergens Triton X-100 viel mehr zelluläre Membranlipide eliminierte und die Membranintegrität in dieser Permeabilisierungsstufe stark zerstörte. Dies führte dazu, dass mehr intrazelluläre Komponenten, insbesondere Makromoleküle, aus den Zellen freigesetzt wurden. Außerdem können große Moleküle wie Antikörper in der nächsten Immunreaktionsstufe in die Zelle gelangen. Obwohl die SPR-Intensität der Auslaugung kleiner Moleküle nach der PFA-Fixierung nachgewiesen wurde, hat die Permeabilisierung unter Verwendung von Triton X-100-Detergens Lipide deutlich solubilisiert und die Zellen für die Bewegungen von Makromolekülen in und aus dem Zellkörper viel durchlässiger gemacht.
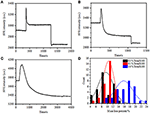
Abbildung 4. Massenverlustkurven von Zellen, die mit unterschiedlichen Konzentrationslösungen behandelt wurden (A) 1,0%, (B) 0,5%, (C) 0,1%. (D) Massenverlustverteilung von 30 Einzelzellen unter verschiedenen Bedingungen.

Tabelle 1. Eine Zusammenfassung der Variationen des Massendichteverlusts statistischer Zellen unter verschiedenen Bedingungen.
Es wurde festgestellt, dass der Verlust der Massendichte ein ziemlich schneller Prozess ist, der in wenigen Minuten in der Permeabilisierungsstufe auftrat (Abbildung 4A). Die Abnahme der Massendichte folgte in etwa einem monotonen Zerfall innerhalb eines Zeitraums von 126 s. Die typischen Sensorprogramme von Einzelzellen unter 0,5 und 0,1% Triton X-100 sind in den Abbildungen 4B bzw. C dargestellt. Der Permeabilisierungsprozess wurde viel langsamer, wenn die Waschmittelkonzentration reduziert wurde. Es dauerte 126, 510, 2.600 s für die drei Arten der behandelten Zellen, um Massenverlust zu beenden.
Fazit
Zusammenfassend wurde die dynamische Umverteilung der zellulären Massendichte sowohl bei Fixations- als auch bei Permeabilisierungsprozessen sensitiv untersucht, indem prismenbasierte Spri2 mit hohen räumlichen und zeitlichen Auflösungen verwendet wurden. Fixiermittel PFA könnte zunächst die Permeabilität der Zytoplasmamembran in gewissem Maße erhöhen, da es zelluläre Proteine sowohl in Membran- als auch in intrazellulären Proteinen fixieren kann. Es wurde unterstützt durch (1) die verringerte Massendichte um ~ 10% nach einer 17-minütigen Fixationsbehandlung in 4% iger PFA-Lösung und (2) die eliminierte zelluläre Reaktion auf hypertonische Lösung, die die Zerstörung der zellulären Integrität gegenüber kleinen Molekülen wie Zucker zeigte. Das Detergens Triton X-100 ist dem Fixiermittel PFA bei der Solubilisierung von Lipiden überlegen und erhöht daher die Permeabilität der Zellmembran, was mit dem größeren Verlust der Massendichte aufgrund der Freisetzung nicht nur kleiner Moleküle, sondern auch großer Moleküle und möglicherweise einiger Organellen wie Vesikel einhergeht. Außerdem korreliert die Rate des Massenverlusts positiv mit der Konzentration von Triton X-100. Diese Ergebnisse lieferten quantitative und dynamische Erkenntnisse über den Einfluss von Fixierung und Permeabilisierung auf die zelluläre Massendichte und Membranintegrität, mit Auswirkungen auf die Optimierung der Bedingungen für einzelzellbiologische Experimente, wie immunfluoreszierende und immunhistochemische Assays.
Autorenbeiträge
RC, Y-WS und WW entwarfen die Experimente. RC, FZ, ML und XW führten die Experimente durch. RC, Y-WS und WW schrieben das Papier. RC, FZ, Y-WS und WW diskutierten die Ergebnisse und analysierten die Daten.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der Handling-Editor erklärte zum Zeitpunkt der Überprüfung eine gemeinsame Zugehörigkeit, wenn auch keine andere Zusammenarbeit, mit den Autoren WW, RC, ML und XW.
Danksagung
Wir bedanken uns für die finanzielle Unterstützung durch die National Natural Science Foundation of China (Grant No. 21522503).Abadian, P. N., Kelley, CP und Goluch, ED (2014). Zelluläre Analyse und Detektion unter Verwendung von Oberflächenplasmonenresonanztechniken. Anal. Chem. 86, 2799–2812. doi: 10.1021 / ac500135s
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Cullen, DC, Brown, RGW und Lowe, CR (1987). Nachweis der Immunkomplexbildung über Oberflächenplasmonenresonanz auf goldbeschichteten Beugungsgittern. Biosensoren 3, 211-225. doi: 10.1016/0265-928X(87)85002-2
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., und Wang, P. (2016). Ein mikrofluidisches Gerät mit zwei Kompartimenten für die Langzeitdetektion von Lebendzellen basierend auf Oberflächenplasmonenresonanz. Biomikrofluidik 10:044109. doi: 10.1063/1.4960487
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J. und Roller, P. P. (1985). Formaldehyd-Fixierung. In: J. Histochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Giebel, K. F., Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Abbildung von Zell-Substrat-Kontakten lebender Zellen mit Oberflächenplasmonenresonanzmikroskopie. In: Biophys. J. 76, 509-516. doi: 10.1016/S0006-3495(99)77219-X
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Homola, J. (2008). Oberflächenplasmonenresonanzsensoren zum Nachweis chemischer und biologischer Spezies. Chem. Offenbarung 108, 462-493. doi: 10.1021/cr068107d
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Jamur, M. C. und Oliver, C. (2010). „Permeabilisierung von Zellmembranen“, in Immunocytochemical Methods and Protocols, eds C. Oliver und M. C. Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007/978-1-59745-324-0_9
CrossRef Volltext / Google Scholar
Joshi, S. und Yu, D. (2017). „Kapitel 8-Immunfluoreszenz“, in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha und M. Jalali (Boston, MA: Academic Press), 135-150. ust-IDNR.: 10.1016/B978-0-12-803077-6.00008-4
CrossRef Volltext / Google Scholar
Kiernan, J. A. (2018). Formaldehyd, Formalin, Paraformaldehyd und Glutaraldehyd: Was sie sind und was sie tun. Micro. Heute 8, 8-13. doi: 10.1017/S1551929500057060
CrossRef Volltext / Google Scholar
Koley, D. und Bard, A. J. (2010). Triton X-100 Konzentrationseffekte auf die Membranpermeabilität einer einzelnen HeLa-Zelle durch rasterelektrochemische Mikroskopie (SECM). Prok. Natl. Acad. Sci. USA 107, 16783-16787. doi: 10.1073/pnas.1011614107
PubMed Abstract / CrossRef Full Text / Google Scholar
Liedberg, B., Nylander, C. und Lunström, I. (1983). Oberflächenplasmonenresonanz zur Gasdetektion und Biosensorik. In: Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text / Google Scholar
Méjard, R., Griesser, H. J. und Thierry, B. (2014). Optische Biosensorik für markierungsfreie Zellstudien. TrAC Und Anal. Chem. 53, 178–186. doi: 10.1016/j.trac.2013.08.012
CrossRef Volltext / Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y. und Li, J. (2018). Markierungsfreie Bildgebung der epidermalen Wachstumsfaktor-Rezeptor-induzierten Reaktion in einzelnen lebenden Zellen. Seite 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Phillips, KS und Cheng, Q. (2007). Jüngste Fortschritte in der Oberflächenplasmonenresonanz basierten Techniken für die Bioanalyse. Anal. Bioanal. Chem. 387, 1831–1840. ust-idnr.: 10.1007/s00216-006-1052-7
PubMed Abstract | CrossRef Full Text / Google Scholar
Rothenhäusler, B. und Knoll, W. (1988). Oberflächenplasmonenmikroskopie. Natur 332, 615-617. doi: 10.1038/332615a0
CrossRef Volltext / Google Scholar
Smith, J. T., Tomfohr, J. K., Wells, M. C., Beebe, T. P., Kepler, T. B. und Reichert, W. M. (2004). Messung der Zellmigration an oberflächengebundenen Fibronektin-Gradienten. Langmuir 20, 8279-8286. doi: 10.1021/la0489763
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Su, YW und Wang, W. (2018). Surface plasmon resonance Sensing: von gereinigten Biomolekülen zu intakten Zellen. Anal. Bioanal. Chem. 410, 3943–3951. ust-idnr.: 10.1007/s00216-018-1008-8
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Thavarajah, R., Mudimbaimannar, V. K., Elizabeth, J., Rao, U. K. und Ranganathan, K. (2012). Chemische und physikalische Grundlagen der routinemäßigen Formaldehydfixierung. J. Oral Maxillofac. Pathologisch. 16, 400–405. doi: 10.4103/0973-029X.102496
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Markierungsfreie Bildgebung, Detektion und Massenmessung einzelner Viren durch Oberflächenplasmonenresonanz. Prok. Natl. Acad. Sci. U.S.A. 107, 16028-16032. doi: 10.1073/pnas.1005264107
PubMed Abstract / CrossRef Full Text / Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J. und Tao, N. (2012a). Kartierung von Einzelzell-Substrat-Wechselwirkungen durch Oberflächenplasmonenresonanzmikroskopie. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, V. J., Liu, Q., Wu, J., et al. (2012b). Markierungsfreie Messung und Kartierung der Bindungskinetik von Membranproteinen in einzelnen lebenden Zellen. Nat. Chem. 4, 846–853. doi: 10.1038/nchem.1434
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). In situ Drug-Rezeptor-Bindungskinetik in einzelnen Zellen: eine quantitative markierungsfreie Studie zur Antitumorresistenz. Sci. Rep. 4:6609. doi: 10.1038/srep06609
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Ultrasensitiver und ultraschneller Nachweis von Reaktionen ganzer unmarkierter lebender Krebszellen auf Paclitaxel mit einem graphenbasierten Biosensor. In: Sens. Actuat. In: B Chem. 263, 417–425. doi: 10.1016/j.schweizerische Nationalbank.2018.02.095
CrossRef Volltext / Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Oberflächenplasmonenresonanz für die zellbasierte klinische Diagnostik. Sensoren 14, 4948-4959. doi: 10.3390/s140304948
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W. und Hide, M. (2010). Nachweis von Brechungsindexänderungen in einzelnen lebenden Zellen mittels Oberflächenplasmonenresonanztomographie. Biosens. Bioelektron. 26, 674–681. modell: 10.1016/j.bios.2010.06.065
PubMed Zusammenfassung | CrossRef Volltext / Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Markierungsfreie Verfolgung des Transports einzelner Organellen in Zellen mit Nanometergenauigkeit unter Verwendung einer plasmonischen Bildgebungstechnik. Klein 11, 2878-2884. Kennziffer: 10.1002/smll.201403016
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Quantifizierung des Expressionsniveaus des epidermalen Wachstumsfaktorrezeptors und der Bindungskinetik auf Zelloberflächen durch Oberflächenplasmonenresonanztomographie. Anal. Chem. 87, 9960–9965. Ursprungsbezeichnung: 10.1021/acs.analchem.5b02572
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar