címke: MEGACE ES-megestrol-acetát szuszpenzió
klinikai farmakológia
a megestrol-acetát plazmakoncentrációjának becslésére számos analitikai módszert alkalmaznak, beleértve a gázkromatográfiás tömegfragmentográfiát (GC-MF), a nagynyomású folyadékkromatográfiát (HPLC) és a radioimmunoassay-t (ria). A GC-MF és a HPLC módszerek specifikusak a megestrol-acetátra, és ekvivalens koncentrációkat eredményeznek. A RIA módszer reagál a megestrol-acetát metabolitokra, ezért nem specifikus, és magasabb koncentrációkat jelez, mint a GC-MF és a HPLC módszerek. A plazmakoncentráció nemcsak az alkalmazott módszertől függ, hanem a gyógyszer intesztinális és máj inaktivációjától is, amelyet olyan tényezők befolyásolhatnak, mint a bélrendszer motilitása, a bélbaktériumok, az alkalmazott antibiotikumok, a testtömeg, az étrend és a májfunkció.
hatásmechanizmus
számos kutató számolt be a megestrol-acetát étvágyfokozó tulajdonságáról és annak lehetséges alkalmazásáról a cachexiában. A pontos mechanizmus, amellyel a megestrol-acetát hatással van az anorexiára és a cachexiára, jelenleg nem ismert.
Farmakokinetikai tulajdonságok:
a megestrol-acetát plazmakoncentrációja 625 mg (125 mg/mL) Megace 625 mg (40 mg/mL) belsőleges szuszpenzió beadását követően 800 mg (40 mg / mL) megestrol-acetát belsőleges szuszpenziónak felel meg (lásd az alábbi ábrát).
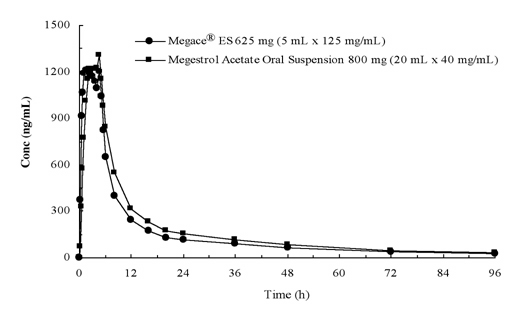
annak érdekében, hogy jellemezze a dózis arányosságát Megace (Megace) es, farmakokinetikai vizsgálatokat végeztek egy sor dózisban, amikor éhgyomri és táplált körülmények között alkalmazták. A megestrol farmakokinetikája a 150 mg és 675 mg közötti dózistartományban lineáris volt a Megace 675 mg-os adagolása után, függetlenül az étkezéstől. Magas zsírtartalmú étkezés esetén a Cmax és az AUC 48% – kal, illetve 36% – kal emelkedett a 625 mg Megace (Megace) es adag után éhgyomorra mért értékekhez képest (1.táblázat). A magas zsírtartalmú étkezés azonban jelentősen megnövelte a megestrol AUC és Cmax értékét 2-szeresére, illetve 7-szeresére, összehasonlítva azokkal, akik éhgyomri állapotban voltak az eredeti készítmény 800 mg-os adagolása után. A táplált állapotban történő beadást követően nem volt különbség a biztonságosságban,ezért a Megace-t az étkezéstől függetlenül lehetett bevenni.
|
*megestrol acetate oral suspension |
||||||||||||||||
| Table 1 – Pharmacokinetic Studies Conducted with Megace® ES | ||||||||||||||||
| Amount Dosed | 150 mg | 250 mg | 375 mg | 450 mg | 575 mg | 625 mg | 675 mg | 800 mg* | ||||||||
| Dose | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 5 mL | 20 mL | ||||||||
| Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | Fast | Fed | |
| Cmax (ng/mL) | 412 | 379 | 647 | 588 | 810 | 958 | 955 | 1079 | – | 1421 | 1133 | 1618 | 1044 | 1616 | 187 | 1364 |
| AUC0-∞ (ng∙h/mL) | 3058 | 3889 | 5194 | 6328 | 7238 | 12193 | 9483 | 11800 | – | 14743 | 12095 | 16268 | 11879 | 17029 | 8942 | 18625 |
| Tmax (h) | 1.74 | 3.80 | 1.58 | 3.38 | 1.56 | 3.42 | 1.74 | 3.16 | – | 3.75 | 1.72 | 2.91 | 1.96 | 2.76 | 5.89 | 3.85 |
a megestrol-acetát plazma steady state farmakokinetikáját 10 felnőtt, cachectiás férfi betegnél értékelték szerzett immunhiányos szindrómában (AIDS) és a kiindulási érték 10% – ánál nagyobb akaratlan testsúlycsökkenéssel. A betegek napi egyszeri 800 mg megestrol-acetát belsőleges szuszpenziót kaptak 21 napon keresztül. A 21.napon kapott plazmakoncentrációs adatokat az utolsó adag bevétele után legfeljebb 48 órán keresztül értékelték.
a megestrol-acetát átlagos plazma csúcskoncentrációja (Cmax) 753 (639) ng / mL volt. Az átlagos terület a koncentráció-idő görbe alatt (AUC) 10476 (6788) ng x óra/mL volt. A medián Tmax érték öt óra volt. A 10 beteg közül hét három hét alatt hízott.
ezenkívül 24 felnőtt, tünetmentes HIV-szeropozitív férfi alanyt adagoltak naponta egyszer 750 mg megestrol-acetát belsőleges szuszpenzióval. A kezelést 14 napig adták be. Az átlagos Cmax és AUC értékek sorrendben 490 (238) ng/mL és 6779 (3048) óra x ng/mL voltak. A medián Tmax érték három óra volt. Az átlagos Cmax érték 202 (601) ng / mL volt. A fluktuációs érték átlagos % – a 107 (60) volt.
metabolizmus
a vizeletben azonosított Megestrol-acetát metabolitok a beadott dózis 5-8% – át tették ki. A légzéssel jelölt szén-dioxid és zsírraktározás felelős lehet A radioaktivitás legalább egy részéért, amely nem található meg a vizeletben és a székletben.
elimináció
emberben a gyógyszer eliminációjának fő útja a vizelet. Amikor az izotóppal jelölt megestrol-acetátot 4-90 mg-os dózisban adták embereknek, a vizelettel történő kiválasztás 10 napon belül 56,5-78,4% (átlagosan 66,4%), a székletürítés pedig 7,7-30,3% (átlagosan 19,8%) volt. A teljes visszanyert radioaktivitás 83,1% és 94,7% között változott (átlagosan 86,2%).
speciális betegcsoportok
a megestrol-acetát farmakokinetikáját egyetlen speciális betegcsoportban sem vizsgálták.
ÁLLATFARMAKOLÓGIA és / vagy toxikológia
hosszú távú kezelés Megace-vel (megestrol-acetát) növelheti a légúti fertőzések kockázatát. Egy patkányokon végzett kétéves krónikus toxicitási/karcinogenitási vizsgálatban a légzőszervi fertőzések gyakoriságának, a csökkent lymphocytaszámnak és a megnövekedett neutrophilszámnak a növekedését figyelték meg.
a klinikai vizsgálatok leírása
a Megestrol-acetát belsőleges szuszpenzió 800 mg/20 mL dózisban 625 mg / 5 mL Megace-nek felel meg. A megestrol-acetát belsőleges szuszpenzió klinikai hatásosságát két klinikai vizsgálatban értékelték. Az egyik egy multicentrikus, randomizált, kettős-vak, placebo-kontrollos vizsgálat volt, amely a megestrol-acetátot (MA) hasonlította össze napi 100 mg, 400 mg és 800 mg dózisban placebóval anorexiában/cachexiában és jelentős testsúlycsökkenésben szenvedő AIDS-es betegeknél. A vizsgálatba bevitt 270 beteg közül 195 felelt meg az összes felvételi / kizárási kritériumnak, legalább két további súlymérést végeztek a kiindulási érték után egy 12 hetes időszak alatt, vagy egy volt a kiindulási érték utáni súlymérés, de terápiás sikertelenség miatt kimaradtak. A 12 vizsgálati héten a maximális testtömeg-gyarapodás mellett öt vagy több fontot elérő betegek százalékos aránya statisztikailag szignifikánsan nagyobb volt a 800 mg-os (64%) és a 400 mg-os (57%) MA-val kezelt csoportban, mint a placebo-csoportban (24%). Az átlagos testtömeg 12 vizsgálati héten a kiindulási értéktől az utolsó értékelésig 7-szeresére nőtt a 800 mg MA-val kezelt csoportban.8 font, a 400 mg MA csoport 4,2 fonttal, a 100 mg MA csoport 1,9 fonttal, a placebo csoportban pedig 1,6 fonttal csökkent. A két klinikai vizsgálatban a hatásosság szempontjából értékelhető betegeknél a 4., 8. és 12. héten bekövetkezett átlagos testtömeg-változások grafikusan láthatók. A 12 vizsgálati hét során a bioelektromos impedancia analízissel mért testösszetétel-változások a nem vizes testtömeg növekedését mutatták az MA-val kezelt csoportokban (lásd a klinikai vizsgálatok táblázatát). Ezenkívül az ödéma csak 3 betegnél alakult ki vagy súlyosbodott.
a 800 mg-os csoportban (89%), a 400 mg-os csoportban (68%) és a 100 mg-os csoportban (72%), mint a placebo csoportban (50%) az étvágy javulását mutatták az utolsó értékelés során a 12 vizsgálati hét során. Statisztikailag szignifikáns különbséget figyeltek meg a 800 mg MA-val kezelt csoport és a placebo csoport között a kalóriabevitelnek a kiindulási értéktől a maximális testtömeg-változás időpontjáig történő változásában. A betegeket arra kérték, hogy értékeljék a súlyváltozást, az étvágyat, a megjelenést és a jólét általános észlelését egy 9 kérdéses felmérésben. A maximális súlyváltozásnál csak a 800 mg MA-val kezelt csoport adott olyan válaszokat, amelyek statisztikailag szignifikánsan kedvezőbbek voltak minden kérdésre a placebóval kezelt csoporthoz képest. A felmérés során dózisreakciót figyeltek meg, a pozitív válaszok korreláltak a magasabb dózissal minden kérdésre.
a második vizsgálat egy multicentrikus, randomizált, kettős-vak, placebo-kontrollos vizsgálat volt, amely 800 mg/nap megestrol-acetátot hasonlított össze placebóval anorexiában/cachexiában és jelentős testsúlycsökkenésben szenvedő AIDS-es betegeknél. A vizsgálatba bevont 100 beteg közül 65 felelt meg az összes felvételi / kizárási kritériumnak, legalább két további súlymérést végeztek a kiindulási érték után egy 12 hetes időszak alatt, vagy egy volt a kiindulási érték utáni súlymérés, de terápiás hatástalanság miatt kimaradtak. A 800 mg MA-val kezelt csoportban az átlagos maximális testtömeg-változás statisztikailag szignifikánsan nagyobb mértékben növekedett, mint a placebo csoportban. A vizsgálat megkezdésétől a vizsgálat 12. hetéig az átlagos testtömeg 11,2 fonttal nőtt az MA-val kezelt csoportban, és 2,1 fonttal csökkent a placebo csoportban. A bioelektromos impedancia analízissel mért testösszetétel-változások a nem víztömeg növekedését mutatták az MA-val kezelt csoportban (lásd a klinikai vizsgálatok táblázatát). Az MA-val kezelt csoportban nem jelentettek ödémát. Az MA-val kezelt betegek nagyobb százaléka (67%), mint a placebóval kezelt betegek (38%) az étvágy javulását mutatta a 12 vizsgálati hét utolsó értékelésekor; ez a különbség statisztikailag szignifikáns volt. Nem volt statisztikailag szignifikáns különbség a kezelési csoportok között az átlagos kalóriaváltozásban vagy a napi kalóriabevitelben a maximális súlyváltozásig. Az első vizsgálatban hivatkozott 9 kérdéses felmérésben a betegek súlyváltozásának, étvágyának, megjelenésének és a jólét általános észlelésének értékelése az átlagos pontszámok növekedését mutatta az MA-val kezelt betegeknél a placebo csoporthoz képest.
mindkét vizsgálatban a betegek jól tolerálták a gyógyszert, és nem észleltek statisztikailag szignifikáns különbségeket a kezelési csoportok között a laboratóriumi rendellenességek, az új opportunista fertőzések, a limfocitaszám, a T4-szám, a T8-szám vagy a bőrreaktivitási tesztek tekintetében (lásd az ADVERSEREACTIONS részt).
| Megestrol Acetate Oral Suspension Clinical Efficacy Trials | |||||||
| Trial 1 | Trial 2 | ||||||
| Study Accrual Dates | Study Accrual Dates | ||||||
| 11/88 to 12/90 | 5/89 to 4/91 | ||||||
| Megestrol Acetate, mg/day | 0 | 100 | 400 | 800 | 0 | 800 | |
| Entered Patients | 38 | 82 | 75 | 75 | 48 | 52 | |
| Evaluable Patients | 28 | 61 | 53 | 53 | 29 | 36 | |
| Mean Change in Weight (lb.) | |||||||
| Baseline to 12 Weeks | 0.0 | 2.9 | 9.3 | 10.7 | -2.1 | 11.2 | |
| % Patients ≥ 5 Pound Gain | |||||||
| At Last Evaluation in 12 weeks | 21 | 44 | 57 | 64 | 28 | 47 | |
| Mean Changes in Body Composition: | |||||||
| Fat Body Mass (lb.) | 0.0 | 2.2 | 2.9 | 5.5 | 1.5 | 5.7 | |
| Lean Body Mass (lb.) | -1.7 | -0.3 | 1.5 | 2.5 | -1.6 | -0.6 | |
| Water (liters) | -1.3 | -0.3 | 0.0 | 0.0 | -0.1 | -0.1 | |
| % Patients With Improved Appetite: | |||||||
| At Time of Maximum Weight Change | 50 | 72 | 72 | 93 | 48 | 69 | |
| At Last Evaluation in 12 Weeks | 50 | 72 | 68 | 89 | 38 | 67 | |
| Mean Change in Daily Caloric Intake: | |||||||
| Baseline to Time of Maximum Weight Change | -107 | 326 | 308 | 646 | 30 | 464 | |
| *Based on bioelectrical impedance analysis determinations at last evaluation in 12 weeks |
Presented below are the results of mean weight changes for patients evaluable for efficacy in trials 1 and 2.