Frontiere della Chimica
- Introduzione
- Materiali e metodi
- Materiali
- Coltura cellulare
- Configurazioni di imaging SPR basate su prismi
- Preparazione del chip del sensore
- Sistema di flusso
- Calibrazione della sensibilità
- Risultati e discussione
- Perdita iniziale di densità di massa nella fissazione cellulare da parte di PFA
- Risposta alla pressione osmotica nella fissazione cellulare da PFA
- Sostanziale perdita di densità di massa nella permeabilizzazione cellulare da Tritone
- Conclusione
- Contributi dell’autore
- Dichiarazione sul conflitto di interessi
- Ringraziamenti
Introduzione
l’Immunofluorescenza è una potente tecnica per visualizzare la distribuzione delle biomolecole specifiche all’interno di campioni biologici quali cellule e tessuti (Joshi e Yu, 2017). Nei tipici test immunofluorescenti a base cellulare, le cellule aderenti sono state incubate con anticorpi fluorescenti per consentire il riconoscimento e il legame specifici tra l’anticorpo e la molecola bersaglio nelle cellule. Dopo un accurato risciacquo, il campione è stato posto sotto microscopio a fluorescenza per ottenere un’immagine a fluorescenza, da cui è stata riportata la distribuzione delle molecole bersaglio dai tag fluorescenti. Al fine di facilitare l’accessibilità dell’anticorpo alle molecole bersaglio e di inibire l’attività cellulare intrinseca, i campioni sono stati spesso fissati e permeabilizzati prima delle procedure di colorazione. Erano particolarmente necessari quando le molecole bersaglio si trovavano all’interno del citoplasma. Tra molti tipi di reagenti, la paraformaldeide (PFA) e Triton X-100 sono probabilmente i più utilizzati rispettivamente per la fissazione e la permeabilizzazione. La depolimerizzazione della PFA ha prodotto molecole di formaldeide per creare legami chimici covalenti tra le proteine nel campione. Il meccanismo dell’azione si basava sull’attivazione di uno dei residui di aminoacidi lisina. Il PFA ha anche disciolto alcuni lipidi nelle membrane cellulari che hanno leggermente danneggiato l’integrità della membrana cellulare (Fox et al., 1985; Thavarajah et al., 2012; Kiernan, 2018). Triton X-100, come efficace detergente non ionico, potrebbe dissolvere i lipidi dalle membrane cellulari, in modo che la membrana cellulare diventi più permeabile all’anticorpo fluorescente. La fase di permeabilizzazione ha rimosso più lipidi di membrana cellulare a causa dei suoi gruppi di testa idrofili non caricati che consistono in porzioni di poliossietilene per consentire a grandi molecole come gli anticorpi di entrare all’interno della cellula (Jamur e Oliver, 2010; Koley e Bard, 2010). Un’illustrazione schematica del processo di fissazione e permeabilizzazione delle cellule è mostrata in Figura 1D. Nonostante il fatto che la fissazione e la permeabilizzazione siano diventate procedure di routine nell’immunofluorescenza e nell’immunoistochimica, sono stati fatti sforzi piuttosto rari per chiarire quantitativamente le loro influenze sull’integrità della membrana e sulla densità di massa cellulare a livello di singola cellula.
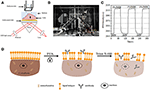
Figura 1. Configurazioni di imaging SPR basate su Prism. A) Illustrazione schematica dell’impianto sperimentale. B) Una fotografia dell’apparecchio. (C) Curva di calibrazione della sensibilità. (D) Illustrazione schematica di fissazione cellulare e permeabilizzazione.
Surface plasmon resonance (SPR) è stata una tecnica popolare e potente per determinare la cinetica di legame tra una coppia di molecole sin dalla sua invenzione nel 1980 (Liedberg et al., 1983; Cullen et al., 1987). Ciò è attribuito ai suoi notevoli vantaggi, tra cui la misurazione cinetica quantitativa in tempo reale con alte risoluzioni temporali, la compatibilità con dispositivi espansi e, soprattutto, la sua caratteristica intrinseca di label-free (Rothenhäusler e Knoll, 1988; Phillips e Cheng, 2007; Homola, 2008; Abadian et al., 2014; Méjard et al., 2014; Yanase et al., 2014; Su e Wang, 2018). Le prime applicazioni si sono concentrate principalmente sulla caratterizzazione e quantificazione delle interazioni biomolecolari immobilizzando le molecole purificate su substrati di rilevamento SPR (vetrini rivestiti in oro). Tali studi ex situ non solo hanno richiesto procedure di purificazione ad alta intensità di lavoro, ma hanno anche portato a risultati che potrebbero non riflettere l’interazione naturale negli esseri viventi (Phillips e Cheng, 2007; Homola, 2008). Guidati sia dal progresso tecnico in vari sistemi di imaging SPR (SPRi) che dalla motivazione scientifica nell’imaging e nell’analisi a cellule singole, sia le tecniche SPRi basate su prismi e obiettivi sono state impiegate per immaginare la distribuzione di massa di singole cellule viventi senza la necessità di etichettatura (Wang et al., 2010, 2012a; Yanase et al., 2010; Yang et al., 2015; Zhang et al., 2015). Ognuno ha i suoi meriti. Quest’ultimo ha una maggiore risoluzione spaziale e il primo ha una migliore sensibilità. Monitorando le immagini SPR time-lapsed di singole cellule viventi durante vari tipi di stimolazioni fisiologiche e biologiche, importanti informazioni spaziali e dinamiche riguardanti le interazioni cellula-substrato (Giebel et al., 1999), migrazioni cellulari (Smith et al., 2004), risposte osmotiche (Wang et al., 2012a), cinetica legante ligando-recettore (Wang et al., 2012b, 2014), vie di segnalazione (Deng et al., 2016), dinamica di attivazione proteica (Peng et al., 2018), e living cancer cell drug responses (Wang et al., 2018) sono stati ottenuti. Per i casi, gli studi esistenti hanno chiaramente dimostrato che le tecniche SPRi erano in grado di mappare la densità di massa e l’integrità della membrana a livello di singola cellula (Yanase et al., 2010; Wang et al., 2012b; Yang et al., 2015). Il contrasto dell’immagine di SPRi proveniva dalla distribuzione subcellulare dell’indice di rifrazione, che era approssimativamente determinata dalla densità di massa locale. Il legame di anticorpi specifici sulla membrana cellulare che esprimeva gli antigeni corrispondenti, o stimolando le cellule viventi con particolari sostanze chimiche, è stato trovato per alterare la densità di massa delle singole cellule in modo eterogeneo e dinamico (Wang et al.,2012 bis, b). L’esposizione di singole cellule viventi a soluzioni ipertoniche è stata trovata per indurre la contrazione delle cellule, indicando l’eccellente integrità delle membrane cellulari (Wang et al., 2012a). Tuttavia, il modo in cui i trattamenti di fissazione e permeabilizzazione influenzerebbero le immagini SPR delle singole cellule rimane poco chiaro.
Nel presente lavoro, abbiamo impiegato un sistema SPRi costruito in casa per registrare continuamente le immagini SPR scadute di decine di singole cellule viventi quando le cellule sono state successivamente trattate con una soluzione al 4% di PFA e una soluzione all ‘ 1% di Triton X-100. La densità di massa delle singole celle è stata determinata dal segnale SPRi medio. L’integrità della membrana è stata valutata esponendo le cellule alla soluzione ipertonica. È stato trovato che, oltre alla densità di massa leggermente ridotta da<10%, il trattamento con PFA ha distrutto significativamente l’integrità cellulare come indicato dalla perdita di risposta osmotica all’esposizione di molecole di zucchero. Il successivo trattamento con Triton X-100, tuttavia, ha ridotto significativamente la densità di massa di un altro 20%, suggerendo la grave distruzione dell’integrità della membrana.
Materiali e metodi
Materiali
Soluzione salina tamponata con fosfato di Dulbecco (PBS, Gibco), Saccarosio (Sinopharm Chemical Reagent Co., Ltd), Triton X-100( Aladdin), paraformaldeide (Shanghai Lingfeng Chemical Reagent Co., Ltd). Tutti i reagenti sono stati sciolti in PBS.
Coltura cellulare
Le cellule BT-474 sono state coltivate a 37°C con il 5% di CO2 e il 70% di umidità relativa nel mezzo di Eagle modificato di Dubelco (DMEM, Invitrogen) con siero bovino fetale al 10% (FBS, Invitrogen), penicillina 100 unità/mL e streptomicina 100 µg / mL (Invitrogen). Cellule è stato passato quando erano 70-80% confluenti trattando con soluzione di tripsina 0,25% (Gibco).
Configurazioni di imaging SPR basate su prismi
Un diagramma schematico e una foto del sistema SPRi sono presentati nelle figure 1A,B. L’apparato SPRi è composto principalmente da tre parti: sorgente luminosa, componenti ottici e fotocamera.
• Sorgente luminosa: Un diodo a emissione luminosa da 670 nm (L7868-01, Hamamatsu, Giappone) e una presa di montaggio a temperatura controllata (LDM21, Thorlabs, Newton, USA).
• Componenti ottici (Edmund Optics, USA): Un triangolo SF-11 prisma con un sensore chip on (no. 1 Vetro BK7 di Fisherbrand), una lente convergente, un polarizzatore e una lente sintonizzabile.
• Fotocamera: fotocamera dispositivo accoppiato alla carica (Pike F032B, Allied Vision Technology, Newburyport, USA).
La luce polarizzata p colpisce direttamente la parte inferiore del vetrino rivestito in oro attraverso il prisma e la fotocamera cattura il fascio riflesso per generare immagini SPR ad una velocità di 0,828 Fotogrammi al secondo (fps). Quando si sceglie l’ingrandimento 4X in una lente sintonizzabile, il campo visivo era ~ 2 × 2 mm2.
Preparazione del chip del sensore
Ogni chip è stato lavato con etanolo al 75% e acqua deionizzata (DIW), seguita da esposizione ai raggi UV per 30 min per rimuovere la contaminazione superficiale e sterilizzarli prima di ogni esperimento. Una camera di silicio Flexi-Perm (Greiner Bio-One) è stata posizionata sopra il chip d’oro per fungere da pozzo di coltura cellulare. Per ottenere la modifica della superficie prima della semina cellulare, una soluzione di collagene 100 µg/mL 150 µL è stata aggiunta alla camera e conservata in un incubatore per 2 h. Il chip è stato quindi risciacquato con acqua deionizzata due volte e DMEM due volte prima della semina cellulare. Per rendere le cellule una buona forma, il chip è stato incubato nel mezzo di crescita per 36 h. Il mezzo di crescita è stato quindi sostituito con una soluzione tampone PBS per 10 min per le cellule che raggiungono un equilibrio.
Sistema di flusso
Un sistema di perfusione multicanale a gravità è stato applicato all’iniezione e al passaggio della soluzione. La portata è di 300 µL / min e la velocità di commutazione della soluzione attorno alle celle può raggiungere 1-2 s.
Calibrazione della sensibilità
È stato preparato un chip sensore come descritto nella parte precedente senza modifiche superficiali e semina delle celle. In primo luogo, DIW scorreva sopra il chip per circa 60 s. Poi, è stato sostituito da 1% (v/v) soluzione di etanolo per un altro 60 s. Come uno dei più comunemente usato soluzione di calibrazione, 1% etanolo è noto per aumentare l’angolo SPR di DIW da 60 mDeg. I risultati sperimentali hanno mostrato che l’intensità SPR è aumentata di conseguenza di 96 UI (Figura 1C), corrispondente a una sensibilità di 1,6 ΔI.U. / mDeg.
Risultati e discussione
La membrana cellulare (nota anche come membrana citoplasmatica), costituita da un doppio strato lipidico con proteine incorporate, è una membrana semi-permeabile che racchiude il citoplasma di una cellula. Le fasi di fissazione e permeabilizzazione di cellule e campioni di tessuto, che potrebbero alterare la permeabilità della membrana cellulare, sono procedure cruciali che potrebbero determinare i successi di saggi immunofluorescenti o immunoistochimici. Oltre a questo, la qualità degli anticorpi e la procedura di immunoreazione sono altri fattori determinanti per questo tipo di esperimenti. SPR ha la caratteristica che sia l’angolo di risonanza e l’indice di rifrazione (RI) vicino alla superficie di rilevamento sono altamente sensibili alla densità di massa dello strato superficiale nell’interfaccia medio-metallo. Pertanto, le variazioni di densità di massa della cella che avvengono su o vicino al film metallico (~200 nm) potrebbero essere registrate in modo sincrono misurando l’intensità della luce riflessa. Utilizzando la tecnica di imaging a risonanza plasmonica superficiale, abbiamo esplorato la distribuzione dinamica della densità di massa cellulare con elevate risoluzioni spaziali e temporali e una sensibilità affidabile sia nei processi di fissazione che di permeabilizzazione in questo studio.
Perdita iniziale di densità di massa nella fissazione cellulare da parte di PFA
Il primo passo per preparare campioni biologici per analisi immunofluorescenti o immunoistochimiche è solitamente la fissazione. E i fissativi più comunemente usati per questi tipi di saggi sono fissativi reticolanti come PFA che funziona generando legami chimici covalenti tra proteine in cellule o tessuti. Abbiamo quindi studiato l’influenza del trattamento PFA sulla densità di massa cellulare. Le cellule viventi BT-474 sono state coltivate su coverslip rivestite da film d’oro con uno spessore di 50 nm. Nella Figura 2A è fornita un’immagine SPR rappresentativa contenente singole celle. I segnali SPR di ciascuna cella possono essere ottenuti scegliendo una regione di interesse nell’immagine SPR che corrisponda alla morfologia della cellula indagata. In un tipico esperimento, quando la soluzione scorreva sulle cellule, i sensorgrammi SPR delle cellule sono stati ottenuti analizzando ogni cellula come mostrato in Figura 2B (curva nera). Nei precedenti 242 s, il buffer PBS senza PFA scorreva sulle cellule e la linea di base era determinata dalla stabilità del sistema (sorgente luminosa e stabilità meccanica) e dai segnali di micromozione intrinseci generati dalle cellule viventi. La soluzione di PFA è stata quindi introdotta al 242 ° secondo, che ha immediatamente aumentato il segnale SPR a causa dell’indice di rifrazione relativamente grande della soluzione di PFA al 4% (effetto di massa). La soluzione di PFA ha funzionato per altri 17 minuti per ottenere una fissazione sufficiente. Al 1237 ° secondo, la soluzione PFA è stata riconvertita alla soluzione PBS pura. Oltre al ridotto effetto di massa, è stata rilevata una diminuzione dell’intensità SPR delle singole cellule confrontando i segnali prima (0-242) e dopo (1237-1545) i trattamenti PFA e la percentuale di perdita di massa è stata ottenuta dividendo il valore di diminuzione al valore iniziale. I sensongrammi SPR dello sfondo (una regione adiacente senza adesione cellulare, curva blu) e una singola cella trattata con PBS durante 1.500 s (curva grigia) sono anche mostrati in Figura 2B. L’analisi statistica su 30 cellule rivela una perdita media di densità di massa di 10 ± 5% come mostrato in Figura 2C. È stato anche scoperto che, dopo il trattamento con PFA, il livello di fluttuazione basale nel segnale SPR è stato significativamente ridotto della metà o anche di due terzi, suggerendo la perdita di micromotioni e la fissazione delle cellule trattate come mostrato nella Figura 2D. Tali segnali di micromotioni sono stati generati da un gruppo di attività cellulari dinamiche da diversi componenti cellulari tra La fissazione ha terminato tali attività biologiche e quindi eliminato i segnali di micromozione, accompagnando con una fluttuazione di intensità significativamente ridotta nei sensogrammi SPR delle singole cellule.
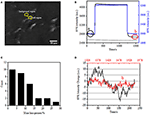
Figura 2. Processo di fissazione cellulare. (A) Immagine SPRi delle celle BT-474. (B) Segnali SPR di singola cella (curva nera) e sfondo (curva blu) sottoposti a un processo di commutazione della soluzione: buffer PBS al 4% PFA al buffer PBS. Segnale SPR di singola cella trattata con PBS durante 1.500 s (curva grigia). (C) Distribuzione della perdita di massa di 30 singole cellule. (D) Livello di rumore della cella prima (a) e dopo (b) trattamento PFA.
Risposta alla pressione osmotica nella fissazione cellulare da PFA
La struttura integrata della membrana cellulare, una membrana semipermeabile, regola l’omeostasi di una cellula per raggiungere l’equilibrio nella pressione osmotica fisiologica. Il trattamento PFA è stato anche trovato per avere la capacità di distruggere l’integrità della membrana come mostrato in Figura 3. Quando il tampone attorno alla cellula bersaglio si è trasformato in soluzione di saccarosio da 25 mm in <1 s tramite un sistema di perfusione del farmaco, è stato creato un ambiente di coltura cellulare ipertonica. Per le cellule viventi, l’esposizione alla soluzione ipertonica ha innescato una serie di risposte fisiologiche per bilanciare la pressione osmotica intracellulare ed extracellulare, che è stata studiata in dettaglio nel nostro lavoro precedente (Wang et al., 2012a). In questo studio, un tipico sensorgram SPR di singole cellule fisiologiche BT-474 è fornito in Figura 3A. Dopo l’esposizione alla soluzione di saccarosio ipertonico, le cellule trattate hanno subito prima un restringimento pressante, portando ad un graduale aumento dell’intensità SPR fino a raggiungere un plateau. Ha suggerito l’aumento della densità di massa come risultato del restringimento delle cellule e dei componenti subcellulari che si riuniscono verso il fondo del coprioggetto della coltura dell’oro. L’aumento graduale dell’intensità SPR mediante stimolazione ipertonica è una sorta di regolazione fisiologica della pressione osmotica cellulare, indicando così l’integrità fisiologica della membrana cellulare. Quando l’integrità della membrana è stata distrutta, l’introduzione della soluzione di saccarosio ipertonico è stata trovata per aumentare immediatamente l’intensità SPR in un tempo molto più breve, come mostrato in Figura 3B. È perché le molecole di zucchero penetravano liberamente nelle cellule senza resistenza dalla membrana semi-permeabile e aumentavano immediatamente l’indice di rifrazione locale (effetto bulk). È chiaro che, mentre il lento aumento dell’intensità SPR rifletteva la regolazione osmotica fisiologica (Figura 3A), il rapido salto ha dimostrato che la membrana cellulare era stata danneggiata per consentire l’ingresso libero di piccole molecole di zucchero (Figura 3B).

Figura 3. Risposte alla pressione osmotica delle cellule. A) Risposta di una cellula vivente a 25 mm di saccarosio. B) Risposta della stessa cella fissa (10 min) a 25 mm di saccarosio.
Sostanziale perdita di densità di massa nella permeabilizzazione cellulare da Tritone
Nella precedente fase di fissazione, una densità di massa cellulare iniziale è diminuita solo di ~10% (Figura 2C). È ragionevole ipotizzare che la fissazione del PFA abbia solo leggermente distrutto l’integrità della membrana e aumentato la permeabilità delle piccole molecole. La maggior parte dei componenti intracellulari dovrebbe essere ancora ospitata all’interno della membrana citoplasmatica. Successivamente abbiamo studiato l’influenza di un tipico detergente di permeabilizzazione, 1% Triton X-100, su cellule che sono state fissate con PFA per 17 min in precedenza. Un sensorgram rappresentativo SPR di singole cellule durante l’esposizione a 1% Triton X-100 è mostrato in Figura 4A. L’introduzione di Triton X-100 ha aumentato l’intensità SPR seguita da una diminuzione graduale. Il primo aumento è una conseguenza dell’aumento dell’indice di rifrazione della soluzione sfusa e la diminuzione seguita indica la graduale perdita della densità di massa dovuta alla permeabilizzazione cellulare. La densità di massa ridotta era più abbondante confrontando la variazione di intensità SPR prima (0-300 s) e dopo l’introduzione del detergente (1.300–1.800 s). L’analisi su 30 singole cellule ha dimostrato che il trattamento Triton X-100 ha creato una sostanziale diminuzione della densità di massa di un altro 20 ± 5% dopo la fissazione del PFA, come mostrato nella Figura 4D e nella Tabella 1. È chiaro che il detergente Triton X-100 ha eliminato molti più lipidi della membrana cellulare e ha gravemente distrutto l’integrità della membrana in questa fase di permeabilizzazione. Ciò ha provocato più componenti intracellulari, in particolare macromolecole, a rilasciare dalle cellule. E inoltre, questo consente a grandi molecole come gli anticorpi di entrare nella cellula nella prossima fase di immunoreazione. Sebbene l’intensità SPR di lisciviazione di piccole molecole sia stata rilevata dopo la fissazione del PFA, la permeabilizzazione utilizzando il detergente Triton X-100 ha chiaramente solubilizzato i lipidi e reso le cellule molto più permeabili ai movimenti delle macromolecole dentro e fuori dal corpo cellulare.
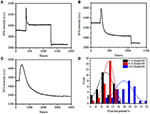
Figura 4. Curve di perdita di massa della cellula trattata con diverse soluzioni di concentrazione (A) 1,0%, (B) 0,5%, (C) 0,1%. (D) Distribuzione della perdita di massa di 30 singole cellule in condizioni diverse.

Tabella 1. Un riassunto delle variazioni nella perdita di densità di massa delle cellule statistiche in diverse condizioni.
Si è riscontrato che la perdita di densità di massa è un processo piuttosto rapido, che si è verificato in pochi minuti nella fase di permeabilizzazione (Figura 4A). La diminuzione della densità di massa ha seguito approssimativamente un decadimento monotonico entro un periodo di tempo di 126 s. I tipici sensorgrammi di singole cellule sotto 0,5 e 0,1% Triton X-100 sono visualizzati rispettivamente nelle figure 4B,C. Il processo di permeabilizzazione è diventato molto più lento quando si riduce la concentrazione di detergente. Ci sono voluti 126, 510, 2.600 s per i tre tipi di cellule trattate per finire la perdita di massa.
Conclusione
In sintesi, la ridistribuzione dinamica della densità di massa cellulare sia nei processi di fissazione che di permeabilizzazione è stata esplorata in modo sensibile utilizzando la configurazione SPRi basata su prismi con elevate risoluzioni spaziali e temporali. Fissativo PFA potrebbe inizialmente aumentare la permeabilità della membrana citoplasmatica in una certa misura perché la sua capacità di fissare le proteine cellulari sia in membrana e proteine intra-cellulari. È stato supportato da (1) la densità di massa diminuita di ~10% dopo un trattamento di fissazione di 17 minuti in soluzione di PFA al 4% e (2) la risposta cellulare eliminata alla soluzione ipertonica, che ha dimostrato la distruzione dell’integrità cellulare a piccole molecole come gli zuccheri. Il detergente Triton X-100 è superiore al fissativo PFA nella solubilizzazione dei lipidi e quindi nell’aumento della permeabilità della membrana cellulare, accompagnando con la perdita più sostanziale della densità di massa dovuta al rilascio non solo di piccole molecole ma anche di grandi molecole e possibilmente di alcuni organelli come le vescicole. Inoltre, il tasso di perdita di massa è positivamente correlato con la concentrazione di Triton X-100. Questi risultati hanno fornito conoscenze quantitative e dinamiche sull’influenza della fissazione e della permeabilizzazione sulla densità di massa cellulare e sull’integrità della membrana, con implicazioni per l’ottimizzazione delle condizioni per esperimenti biologici a cellule singole, come saggi immunofluorescenti e immunoistochimici.
Contributi dell’autore
RC, Y-WS e WW hanno progettato gli esperimenti. RC, FZ, ML e XW hanno eseguito gli esperimenti. RC, Y-WS, e WW ha scritto il giornale. RC, FZ, Y-WS e WW hanno discusso i risultati e analizzato i dati.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
L’editor di gestione ha dichiarato un’affiliazione condivisa, anche se nessuna altra collaborazione, con gli autori WW, RC, ML e XW al momento della revisione.
Ringraziamenti
Ringraziamo il sostegno finanziario della National Natural Science Foundation of China (Grant No. 21522503).
Abadian, P. N., Kelley, CP, e Goluch, ED (2014). Analisi e rilevazione cellulare mediante tecniche di risonanza plasmonica superficiale. Anale. Chimica. 86, 2799–2812. doi: 10.1021/ac500135s
PubMed Abstract / CrossRef Full Text/Google Scholar
Cullen, DC, Brown, RGW e Lowe, CR (1987). Rilevamento della formazione di immuno-complesso tramite risonanza plasmonica superficiale su griglie di diffrazione rivestite in oro. Biosensori 3, 211-225. doi: 10.1016/0265-928X(87)85002-2
PubMed Abstract / CrossRef Full Text / Google Scholar
Deng, S., Yu, X., Liu, R., Chen, W., e Wang, P. (2016). Un dispositivo microfluidico a due compartimenti per il rilevamento di cellule vive a lungo termine basato sulla risonanza plasmonica di superficie. Biomicrofluidica 10: 044109. doi: 10.1063 | 1.4960487
PubMed Abstract/CrossRef Full Text/Google Scholar
Fox, C. H., Johnson, F. B., Whiting, J., and Roller, PP (1985). Fissazione della formaldeide. J. Istochem. Cytochem. 33, 845–853. doi: 10.1177/33.8.3894502
PubMed Abstract | CrossRef Full Text/Google Scholar
Giebel, KF, Bechinger, C., Herminghaus, S., Riedel, M., Leiderer, P., Weiland, U., et al. (1999). Imaging dei contatti cellulare / substrato di cellule viventi con microscopia a risonanza plasmonica di superficie. Biophys. J. 76, 509-516. doi: 10.1016/S0006-3495 (99)77219-X
PubMed Abstract | CrossRef Full Text/Google Scholar
Homola, J. (2008). Sensori di risonanza plasmonica di superficie per il rilevamento di specie chimiche e biologiche. Chimica. Apoc 108, 462-493. doi: 10.1021/cr068107d
PubMed Abstract | CrossRef Full Text/Google Scholar
Jamur, MC, e Oliver, C. (2010). “Permeabilizzazione delle membrane cellulari”, in metodi e protocolli immunocitochimici, eds C. Oliver e MC Jamur (Totowa, NJ: Humana Press), 63-66. doi: 10.1007 / 978-1-59745-324-0_9
CrossRef Full Text/Google Scholar
Joshi, S., e Yu, D. (2017). “Chapter 8-Immunofluorescence,” in Basic Science Methods for Clinical Researchers, eds M. Jalali, F. Y. L. Saldanha e M. Jalali (Boston, MA: Academic Press), 135-150. doi: 10.1016 / B978-0-12-803077-6.00008-4
CrossRef Full Text/Google Scholar
Kiernan, J. A. (2018). Formaldeide, formalina, paraformaldeide e glutaraldeide: cosa sono e cosa fanno. Micro. Oggi 8, 8-13. doi: 10.1017 | S1551929500057060
CrossRef Full Text/Google Scholar
Koley, D., and Bard, AJ (2010). Triton X-100 effetti di concentrazione sulla permeabilità della membrana di una singola cella HeLa mediante scansione microscopia elettrochimica (SECM). Proc. Natl. Acad. Sic. U. S. A. 107, 16783-16787. doi: 10.1073 / pnas.1011614107
PubMed Abstract | CrossRef Full Text/Google Scholar
Liedberg, B., Nylander, C., e Lunström, I. (1983). Risonanza plasmonica di superficie per il rilevamento e il biosensing dei gas. Sens. Actuat. 4, 299–304. doi: 10.1016/0250-6874(83)85036-7
CrossRef Full Text/Google Scholar
Méjard, R., Griesser, HJ e Thierry, B. (2014). Biosensing ottico per studi cellulari privi di etichette. TRAC Tendenze Anale. Chimica. 53, 178–186. doi: 10.1016 / j.trac.2013.08.012
CrossRef Full Text/Google Scholar
Peng, Z., Lu, J., Zhang, L., Liu, Y. e Li, J. (2018). Imaging senza etichetta della risposta indotta dal recettore del fattore di crescita epidermico in singole cellule viventi. Analista 143, 5264-5270. doi: 10.1039/C8AN01534A
PubMed Abstract | CrossRef Full Text/Google Scholar
Phillips, KS, and Cheng, Q. (2007). Recenti progressi nelle tecniche basate sulla risonanza plasmonica di superficie per la bioanalisi. Anale. Bioanale. Chimica. 387, 1831–1840. doi: 10.1007 / s00216-006-1052-7
PubMed Abstract | CrossRef Full Text/Google Scholar
Rothenhäusler, B., and Knoll, W. (1988). Microscopia plasmonica di superficie. Natura 332, 615-617. doi: 10.1038/332615a0
CrossRef Full Text/Google Scholar
Smith, J. T., Tomfohr, JK, Wells, MC, Beebe, TP, Kepler, TB, e Reichert, WM (2004). Misura della migrazione cellulare su gradienti di fibronectina legati alla superficie. Langmuir 20, 8279-8286. doi: 10.1021 | la0489763
PubMed Abstract/CrossRef Full Text/Google Scholar
Su, YW, e Wang, W. (2018). Rilevamento della risonanza plasmonica di superficie: da biomolecole purificate a cellule intatte. Anale. Bioanale. Chimica. 410, 3943–3951. doi: 10.1007 / s00216-018-1008-8
PubMed Abstract / CrossRef Full Text/Google Scholar
Thavarajah, R., Mudimbaimannar, VK., Elizabeth, J., Rao, Regno Unito, e Ranganathan, K. (2012). Basi chimiche e fisiche della fissazione di routine della formaldeide. J. Maxillofac orale. Pathol. 16, 400–405. doi: 10.4103/0973-029X.102496
PubMed Abstract / CrossRef Full Text / Google Scholar
Wang, S., Shan, X., Patel, U., Huang, X., Lu, J., Li, J., et al. (2010). Imaging senza etichette, rilevamento e misurazione della massa di singoli virus mediante risonanza plasmonica superficiale. Proc. Natl. Acad. Sic. U. S. A. 107, 16028-16032. doi: 10.1073 / pnas.1005264107
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Wang, S., Liu, Q., Wu, J., e Tao, N. (2012a). Mappatura delle interazioni unicellulare-substrato mediante microscopia a risonanza plasmonica superficiale. Langmuir 28, 13373-13379. doi: 10.1021/la301712h
PubMed Abstract | CrossRef Full Text/Google Scholar
Wang, W., Yang, Y., Wang, S., Nagaraj, VJ, Liu, Q., Wu, J., et al. (2012b). Misurazione e mappatura senza etichetta della cinetica di legame delle proteine di membrana in singole cellule viventi. NAT. Chimica. 4, 846–853. doi: 10.1038 / nchem.1434
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, W., Yin, L., Gonzalez-Malerva, L., Wang, S., Yu, X., Eaton, S., et al. (2014). Cinetica di legame farmaco-recettore in situ in singole cellule: uno studio quantitativo senza etichetta della resistenza ai farmaci antitumorali. Sic. Rep. 4: 6609. doi: 10.1038/srep06609
PubMed Abstract / CrossRef Full Text/Google Scholar
Wang, Y., Zhang, S., Xu, T., Zhang, T., Mo, Y., Liu, J., et al. (2018). Rilevamento ultra-sensibile e ultra-veloce di risposte di cellule tumorali viventi intere senza etichetta al paclitaxel con un biosensore a base di grafene. Sens. Actuat. B Chem. 263, 417–425. doi: 10.1016 / j.bns.2018.02.095
CrossRef Full Text | Google Scholar
Yanase, Y., Hiragun, T., Ishii, K., Kawaguchi, T., Yanase, T., Kawai, M., et al. (2014). Risonanza plasmonica di superficie per la diagnosi clinica cellulare. Sensori 14, 4948-4959. doi: 10.3390 | s140304948
PubMed Abstract / CrossRef Full Text/Google Scholar
Yanase, Y., Hiragun, T., Kaneko, S., Gould, H. J., Greaves, M. W., e Hide, M. (2010). Rilevazione delle variazioni dell’indice di rifrazione nelle singole cellule viventi mediante risonanza plasmonica superficiale. Bioseni. Bioelettrone. 26, 674–681. doi: 10.1016 / j.bios.2010.06.065
PubMed Abstract | CrossRef Full Text/Google Scholar
Yang, Y., Yu, H., Shan, X., Wang, W., Liu, X., Wang, S., et al. (2015). Tracciamento senza etichetta del trasporto di singoli organelli nelle cellule con precisione nanometrica utilizzando una tecnica di imaging plasmonico. Piccolo 11, 2878-2884. doi: 10.1002 / smll.201403016
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhang, F., Wang, S., Yin, L., Yang, Y., Guan, Y., Wang, W., et al. (2015). Quantificazione del livello di espressione del recettore del fattore di crescita epidermico e cinetica di legame sulle superfici cellulari mediante risonanza plasmonica superficiale. Anale. Chimica. 87, 9960–9965. doi: 10.1021 / acs.analchem.5b02572
PubMed Abstract / CrossRef Full Text / Google Scholar