Molecolare Espressioni di Microscopia Primer: Fluorescenza – Photobleaching – Tutorial Interattivo
- Microscopia di Fluorescenza di Tutorial Interattivi
- Photobleaching
- Domande o commenti? Inviaci una e-mail.
- © 1998-2021 di Michael W. Davidson e la Florida State University. Tutti i diritti riservati. Nessuna immagine, grafica, script o applet può essere riprodotta o utilizzata in qualsiasi modo senza il permesso dei titolari del copyright. L’utilizzo di questo sito web significa che l’utente accetta tutti i Termini e le condizioni legali stabiliti dai proprietari.
- Questo sito web è gestito dal nostro Graphics&Team di programmazione Webin collaborazione con la microscopia ottica presso il National High Magnetic Field Laboratory.
- Ultima modifica: lunedì 12 settembre 2016 alle ore 13: 58
- Numero di accessi dal 10 giugno 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Microscopia di Fluorescenza di Tutorial Interattivi
Photobleaching
Il fenomeno di photobleaching (anche comunemente indicato come la dissolvenza) si verifica quando un fluoroforo permanentemente perde la capacità di reagire a causa del fotone-indotta danni chimici e modificazione covalente. Al passaggio da uno stato di singoletto eccitato allo stato di tripletta eccitato, i fluorofori possono interagire con un’altra molecola per produrre modifiche covalenti irreversibili. Lo stato di tripletta è relativamente longevo rispetto allo stato di singoletto, consentendo così alle molecole eccitate un lasso di tempo molto più lungo per subire reazioni chimiche con componenti nell’ambiente. Il numero medio di cicli di eccitazione ed emissione che si verificano per un particolare fluoroforo prima del photobleaching dipende dalla struttura molecolare e dall’ambiente locale. Alcuni fluorofori candeggiano rapidamente dopo aver emesso solo pochi fotoni, mentre altri che sono più robusti possono subire migliaia o milioni di cicli prima dello sbiancamento. Questo tutorial interattivo esplora le variazioni nei tassi di photobleaching in campioni di fluorescenza etichettati singoli, doppi e moltiplicati.
Il tutorial si inizializza con una coppia di immagini di fluorescenza identiche che appaiono nelle finestre Immagine non sbiancata e Immagine Photobleached. Al fine di utilizzare il tutorial, fare clic sul pulsante di scatto per aprire l’otturatore virtuale e consentire l’immagine Photobleached immagine a svanire o photobleach ad una velocità notevolmente esagerata su un periodo di tempo fisso. Lo sbiadimento può essere interrotto in qualsiasi punto facendo clic sul pulsante Pausa (che diventa un pulsante Start), quindi ripreso facendo clic sul pulsante Start. Nei campioni con doppia e tripla etichetta, i vari tassi di sbiancamento dei fluorofori individuali possono essere visualizzati individualmente utilizzando le caselle di controllo Canali colore (l’impostazione predefinita è tutti i canali attivati). Ad esempio, facendo clic sulla casella di controllo Rossa per un campione con tripla etichettatura verrà visualizzato solo il canale di colore rosso. Due o tutti e tre i canali di colore possono essere mescolati insieme in campioni etichettati moltiplicare utilizzando la casella di controllo Aggiungi. È possibile selezionare un nuovo campione utilizzando il menu a discesa Scegli un campione. I nomi dei campioni includono le seguenti informazioni sull’etichettatura del fluoroforo: FITC, isotiocianato di fluoresceina; Triplo, un fluoroforo rosso, verde e blu; Doppio, due fluorofori; DAPI,4′, 6-diamidino-2-fenilindolo; MitoTracker, una sonda mitocondriale; Alexa 488, un fluoroforo verde; e Auto, autofluorescenza. Il tutorial è progettato per alterare in modo casuale i tassi di photobleaching per i singoli fluorofori al momento del ricaricamento, in modo che facendo clic sul pulsante di scatto ripetutamente dimostrerà come l’immagine appare come il tasso di sbiancamento fluorescenza cambia per ciascuno dei segnali di colore.
Poiché il photobleaching, un fenomeno molto poco conosciuto, porta a una drammatica perdita di intensità di emissione di fluorescenza nella maggior parte dei campioni, controllare l’artefatto è fondamentale per catturare con successo immagini soddisfacenti. Come esempio per un tipico fluorocromo, la resa quantistica per photobleaching di fluoresceina a medio-alta intensità di illuminazione impone che una molecola media emetterà tra 30 a 40 mila fotoni durante la sua vita utile (prima di diventare permanentemente disabilitata). Inoltre, il numero di cicli di eccitazione ed emissione è costante per un determinato fluoroforo indipendentemente da come viene erogata l’energia di eccitazione, sia in impulsi discreti che attraverso l’illuminazione continua. Pertanto, riducendo il livello di luce di eccitazione utilizzando filtri a densità neutra non impedisce photobleaching, si limita a ridurre la velocità.
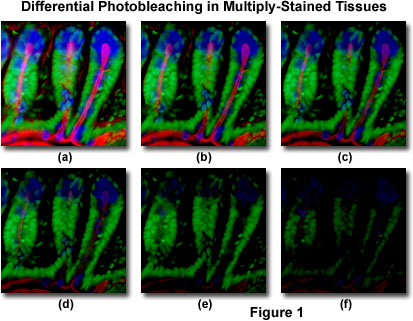
Presentato in Figura 1 è un tipico esempio di photobleaching (fading) osservato in una serie di immagini digitali catturate in diversi punti temporali per una sezione sottile criostato a macchie multiple (16 micrometri) dell’intestino del topo. I nuclei sono stati colorati con Sytox verde (fluorescenza verde), mentre il muco delle cellule caliciformi e l’actina filamentosa nel bordo del pennello sono stati colorati con Alexa Fluor 350 germe di grano agglutinina (fluorescenza blu) e Alexa Fluor 568 falloidina (fluorescenza rossa), rispettivamente. I punti di tempo sono stati presi a intervalli di due minuti utilizzando una combinazione di filtri a fluorescenza con larghezze di banda sintonizzate per eccitare simultaneamente i tre fluorofori e registrare anche i segnali di emissione combinati. Si noti che tutti e tre i fluorofori hanno un’intensità relativamente elevata nella Figura 1 (a), ma le intensità Alexa Fluor 350 e 568 (blu e rosso) iniziano a scendere rapidamente a due minuti e sono quasi completamente sparite a sei minuti. I nuclei colorati di verde sono più resistenti al photobleaching, ma anche la loro intensità diminuisce costantemente nel corso della sequenza temporale (10 minuti). Un’ampia varietà di reagenti antifade sintetici ridurrà significativamente il tasso di photobleaching.
Un’importante classe di eventi di fotobleaching sono fotodinamici, nel senso che implicano l’interazione del fluoroforo con una combinazione di luce e ossigeno. Le reazioni tra fluorofori e ossigeno molecolare distruggono permanentemente la fluorescenza e producono una specie di ossigeno singoletto di radicali liberi che può modificare chimicamente altre molecole nelle cellule viventi. La quantità di photobleaching dovuto gli eventi fotodinamici è una funzione della concentrazione molecolare dell’ossigeno e della distanza prossimale fra il fluoroforo, le molecole dell’ossigeno ed altri componenti cellulari. Il photobleaching può essere ridotto limitando il tempo di esposizione dei fluorofori all’illuminazione o abbassando l’energia di eccitazione. Tuttavia, queste tecniche riducono anche il segnale di fluorescenza misurabile. In molti casi, soluzioni di fluorofori o sospensioni cellulari possono essere deossigenate, ma questo non è fattibile per cellule e tessuti viventi. Forse la migliore protezione contro il photobleaching è limitare l’esposizione del fluorocromo all’illuminazione intensa (utilizzando filtri a densità neutra) accoppiato con l’uso giudizioso di reagenti antifade disponibili in commercio che possono essere aggiunti alla soluzione di montaggio o al mezzo di coltura cellulare.
In determinate circostanze, l’effetto photobleaching può anche essere utilizzato per ottenere informazioni specifiche che altrimenti non sarebbero disponibili. Ad esempio, nel recupero della fluorescenza dopo esperimenti di fotobleaching (FRAP), i fluorofori all’interno di una regione bersaglio vengono intenzionalmente sbiancati con livelli eccessivi di irradiazione. Quando nuove molecole di fluoroforo si diffondono nella regione sbiancata del campione (recupero), l’intensità dell’emissione di fluorescenza viene monitorata per determinare i tassi di diffusione laterale del fluoroforo bersaglio. In questo modo, la mobilità traslazionale delle molecole fluorescenti etichettate può essere accertata all’interno di una regione molto piccola (da 2 a 5 micrometri) di una singola cellula o sezione di tessuto vivente.
Autori
Brian Herman – Dipartimento di biologia cellulare e strutturale, University of Texas Health Science Center, 7703 Floyd Curl Drive, San Antonio, Texas 78229.
Matthew J. Parry-Hill, Ian D. Johnson e Michael W. Davidson – National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., Florida State University, Tallahassee, Florida, 32310.
TORNA ALLA FLUORESCENZA INTRODUZIONE
TORNA ALLA MICROSCOPIA A FLUORESCENZA
Domande o commenti? Inviaci una e-mail.
© 1998-2021 di Michael W. Davidson e la Florida State University. Tutti i diritti riservati. Nessuna immagine, grafica, script o applet può essere riprodotta o utilizzata in qualsiasi modo senza il permesso dei titolari del copyright. L’utilizzo di questo sito web significa che l’utente accetta tutti i Termini e le condizioni legali stabiliti dai proprietari.
Questo sito web è gestito dal nostro
Graphics&Team di programmazione Web
in collaborazione con la microscopia ottica presso il
National High Magnetic Field Laboratory.
Ultima modifica: lunedì 12 settembre 2016 alle ore 13: 58
Numero di accessi dal 10 giugno 2003: 116208
![]()
![]()
![]()
![]()