Molecular Expressões Microscopia Primer: Fluorescência Photobleaching – Tutorial Interativo
- Microscopia de Fluorescência Tutoriais Interativos
- Photobleaching
- © 1998-2021 by Michael W. Davidson and the Florida State University. Todos Os Direitos Reservados. Nenhuma imagem, Gráficos, scripts ou applets podem ser reproduzidos ou usados de qualquer forma sem a permissão dos detentores de direitos autorais. O uso deste site significa que você concorda com todos os Termos e condições legais estabelecidos pelos proprietários.
- This website is maintained by our Graphics & Web Programming Team in collaboration with Optical Microscopy at the National High Magnetic Field Laboratory.
- última modificação: segunda-feira, 12 de Setembro de 2016 às 01:58 PM
- número de acesso desde 10 de junho de 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Microscopia de Fluorescência Tutoriais Interativos
Photobleaching
O fenômeno da photobleaching (também comumente conhecido como fading) ocorre quando um fluoróforo permanentemente perde a capacidade de fluorescência devido a fótons induzida por danos causados por produtos químicos e modificação covalente. Após a transição de um estado de singlet excitado para o estado de tripleto excitado, os fluoróforos podem interagir com outra molécula para produzir modificações covalentes irreversíveis. O estado tripleto é relativamente de longa duração em relação ao estado singlet, permitindo assim que moléculas excitadas passem por reações químicas com componentes no ambiente. O número médio de ciclos de excitação e emissão que ocorrem para um fluoróforo específico antes da fotobleaching depende da estrutura molecular e do ambiente local. Alguns fluoróforos descoloram rapidamente após emitirem apenas alguns fotões, enquanto outros que são mais robustos podem passar por milhares ou milhões de ciclos antes do branqueamento. Este tutorial interativo explora variações nas taxas de fotobleaching em espécimes de fluorescência com rótulo único, duplo e multiplicado.
o tutorial inicializa com um par de imagens fluorescentes idênticas aparecendo nas janelas de imagens não branqueadas e Fotoblefachadas. A fim de operar o tutorial, clique no botão Obturador para abrir o obturador virtual e permitir que a imagem de imagem Fotoblefachada se desvaneça ou o photobleach a uma taxa muito exagerada ao longo de um período de tempo fixo. O desvanecimento pode ser interrompido em qualquer ponto, clicando no botão de pausa (que se torna um botão de início), e então retomado, clicando no botão de início. Em espécimes com etiquetas duplas e triplas, as várias taxas individuais de branqueamento de fluoróforos podem ser vistas individualmente usando as opções dos canais de cores (a configuração padrão é todos os canais ligados). Por exemplo, se carregar na opção vermelha para um espécime com etiquetagem tripla, irá mostrar apenas o canal de cores vermelhas. Dois ou todos os três canais de cores podem ser misturados em espécimes multiplicados rotulados usando a opção Adicionar. Um novo espécime pode ser selecionado usando o menu Escolher um espécime pull-down. Os nomes dos espécimes incluem as seguintes informações de rotulagem fluoróforos: FITC, isotiocianato de fluoresceína; Triple, a vermelho, verde e fluoróforo azul; Dual, two fluoróforos; DAPI, 4′, 6-diamidino-2-fenilindol; MitoTracker, uma sonda mitocondrial; Alexa 488, um fluoróforo verde; e Auto, auto-fluorescência. O tutorial é projetado para alterar aleatoriamente as taxas de fotobleaching para fluoróforos individuais ao Recarregar, de modo que clicando no botão Obturador repetidamente irá demonstrar como a imagem aparece como a taxa de branqueamento de fluorescência muda para cada um dos sinais de cor.devido à fotobleaching, um fenômeno muito mal compreendido, levar a uma perda dramática de intensidade de emissão de fluorescência na maioria das amostras, controlar o artefato é fundamental para capturar com sucesso imagens satisfatórias. Como exemplo para um fluorocromo típico, o rendimento quântico para fotobleaching de fluoresceína em intensidade média a alta iluminação dita que uma molécula média emitirá entre 30 a 40 mil fótons durante sua vida útil (antes de ficar permanentemente desativada). Além disso, o número de ciclos de excitação e emissão é constante para um dado fluoróforo, independentemente de como a energia de excitação é fornecida, seja em pulsos discretos ou através de iluminação contínua. Portanto, reduzir o nível de luz de excitação usando filtros de densidade neutra não impede o fotobleaching, simplesmente reduz a taxa.
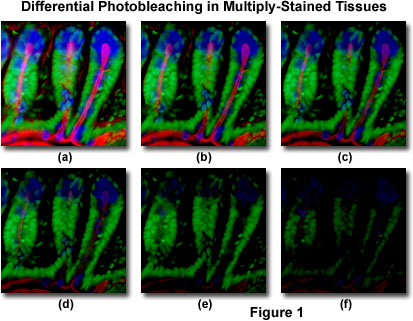
apresentado na Figura 1 é um exemplo típico de fotobleaching (desvanecimento) observado numa série de imagens digitais captadas em diferentes pontos temporais para uma secção fina criostática com manchas múltiplas (16 micrómetros) do intestino do rato. Os núcleos estavam manchados com verde de Sytox (fluorescência verde), enquanto o muco das células do cálice e a actina filamentosa na borda do pincel estavam manchados com aglutinina do gérmen de trigo Alexa Fluor 350 (fluorescência azul) e alsca Fluor 568 faloidina (fluorescência vermelha), respectivamente. Os pontos temporais foram obtidos em intervalos de dois minutos usando uma combinação de filtro de fluorescência com larguras de banda ajustadas para excitar os três fluoróforos simultaneamente, enquanto também gravavam os sinais de emissão combinados. Note que todos os três fluoróforos têm uma intensidade relativamente alta na Figura 1(A), mas as intensidades Alexa Fluor 350 e 568 (azul e vermelho) começam a cair rapidamente em dois minutos e estão quase completamente fora em seis minutos. Os núcleos corados de verde são mais resistentes ao fotobleaching, mas sua intensidade também cai de forma constante ao longo da sequência cronometrada (10 minutos). Uma grande variedade de reagentes antifade sintéticos irá reduzir significativamente a taxa de fotobleaching.
Reações entre fluoróforos e oxigênio molecular destroem permanentemente a fluorescência e produzem uma espécie de oxigênio radical livre que pode modificar quimicamente outras moléculas em células vivas. A quantidade de fotobleaching devido a eventos fotodinâmicos é uma função da concentração de oxigênio molecular e da distância proximal entre o fluoróforo, moléculas de oxigênio e outros componentes celulares. O fotobleaching pode ser reduzido através da limitação do tempo de exposição dos fluoróforos à iluminação ou através da redução da energia de excitação. No entanto, estas técnicas também reduzem o sinal de fluorescência mensurável. Em muitos casos, soluções de fluoróforos ou suspensões celulares podem ser desoxigenadas, mas isso não é viável para células e tecidos vivos. Talvez a melhor protecção contra o fotobleaching seja limitar a exposição do fluorocromo a iluminação intensa (utilizando filtros de densidade neutra), juntamente com a utilização judiciosa de reagentes antifade disponíveis comercialmente que podem ser adicionados à solução de montagem ou ao meio de cultura celular.
em certas circunstâncias, o efeito de fotobleaching também pode ser utilizado para obter informações específicas que de outra forma não estariam disponíveis. Por exemplo, na recuperação de fluorescência após experiências de fotobleaching (FRAP), os fluoróforos numa região-alvo são intencionalmente branqueados com níveis excessivos de irradiação. À medida que novas moléculas fluoróforas se difundiram na região branqueada da amostra (recuperação), a intensidade de emissão de fluorescência é monitorada para determinar as taxas de difusão lateral do fluoróforo alvo. Desta forma, a mobilidade translacional de moléculas marcadas fluorescentemente pode ser verificada dentro de uma região muito pequena (2 a 5 micrômetro) de uma única célula ou seção de tecido vivo.Brian Herman-Department of Cellular and Structural Biology, University of Texas Health Science Center, 7703 Floyd Curl Drive, San Antonio, Texas 78229.Matthew J. Parry-Hill, Ian D. Johnson , and Michael W. Davidson-National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., The Florida State University, Tallahassee, Florida, 32310.identificação do
Introdução à fluorescência
microscopia à fluorescência
perguntas ou comentários? Envie-nos um e-mail.
© 1998-2021 by Michael W. Davidson and the Florida State University. Todos Os Direitos Reservados. Nenhuma imagem, Gráficos, scripts ou applets podem ser reproduzidos ou usados de qualquer forma sem a permissão dos detentores de direitos autorais. O uso deste site significa que você concorda com todos os Termos e condições legais estabelecidos pelos proprietários.
This website is maintained by our
Graphics & Web Programming Team
in collaboration with Optical Microscopy at the National High Magnetic Field Laboratory.
última modificação: segunda-feira, 12 de Setembro de 2016 às 01:58 PM
número de acesso desde 10 de junho de 2003: 116208
![]()
![]()
![]()
![]()