Molekulare Fluoreszenz Mikroskopie Primer: Fluoreszenz-Photobleaching-Interaktive Tutorial
- Fluoreszenz Mikroskopie Interaktive Tutorials
- Photobleaching
- Fragen oder Anmerkungen? Senden Sie uns eine E-Mail.
- © 1998-2021 von Michael W. Davidson und der Florida State University. Alle Rechte vorbehalten. Keine Bilder, Grafiken, Skripte oder Applets dürfen ohne Genehmigung der Urheberrechtsinhaber reproduziert oder in irgendeiner Weise verwendet werden. Durch die Nutzung dieser Website erklären Sie sich mit allen von den Eigentümern festgelegten rechtlichen Bedingungen einverstanden.
- Diese Website wird von unseremGraphics & Webprogrammierteamin Zusammenarbeit mit Optical Microscopy amNational High Magnetic Field Laboratory gepflegt.
- Letzte Änderung: Montag, 12.September 2016 um 01:58 Uhr
- Zugriffszahl seit 10.Juni 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Fluoreszenz Mikroskopie Interaktive Tutorials
Photobleaching
Das phänomen der photobleaching (auch allgemein bezeichnet als verblassen) tritt auf, wenn ein fluorophor dauerhaft verliert die fähigkeit zu fluoreszieren aufgrund zu photoneninduzierter chemischer Schädigung und kovalenter Modifikation. Beim Übergang von einem angeregten Singulettzustand in den angeregten Triplettzustand können Fluorophore mit einem anderen Molekül interagieren, um irreversible kovalente Modifikationen zu erzeugen. Der Triplett-Zustand ist relativ langlebig in Bezug auf den Singulett-Zustand, so dass angeregte Moleküle einen viel längeren Zeitrahmen haben, um chemische Reaktionen mit Komponenten in der Umgebung zu durchlaufen. Die durchschnittliche Anzahl der Anregungs- und Emissionszyklen, die für einen bestimmten Fluorophor vor dem Photobleichen auftreten, hängt von der Molekülstruktur und der lokalen Umgebung ab. Einige Fluorophore bleichen schnell, nachdem sie nur wenige Photonen emittiert haben, während andere, die robuster sind, vor dem Bleichen Tausende oder Millionen von Zyklen durchlaufen können. In diesem interaktiven Lernprogramm werden Variationen der Photobleichungsraten in einzel-, doppel- und mehrfach markierten Fluoreszenzproben untersucht.
Das Tutorial wird mit einem Paar identischer Fluoreszenzbilder initialisiert, die in den Fenstern Ungebleichtes Bild und Photogebleichtes Bild angezeigt werden. Um das Tutorial zu bedienen, klicken Sie auf den Auslöser, um den virtuellen Verschluss zu öffnen und das Photobleached Image-Bild über einen festen Zeitraum mit einer stark übertriebenen Rate zu verblassen oder zu photobleachen. Das Ausblenden kann jederzeit durch Klicken auf die Schaltfläche Pause (die zur Schaltfläche Start wird) angehalten und dann durch Klicken auf die Schaltfläche Start fortgesetzt werden. Bei doppelt und dreifach markierten Proben können die verschiedenen einzelnen Fluorophorbleichraten einzeln über die Kontrollkästchen Farbkanäle angezeigt werden (die Standardeinstellung ist alle Kanäle aktiviert). Wenn Sie beispielsweise auf das rote Kontrollkästchen für eine Probe mit dreifacher Kennzeichnung klicken, wird nur der rote Farbkanal angezeigt. Mit dem Kontrollkästchen Hinzufügen können entweder zwei oder alle drei Farbkanäle in mehrfach beschrifteten Proben zusammengemischt werden. Eine neue Probe kann über das Pulldown-Menü Probe auswählen ausgewählt werden. Probennamen enthalten die folgenden Fluorophormarkierungsinformationen: FITC, Fluoresceinisothiocyanat; Dreifach, ein roter, grüner und blauer Fluorophor; Dual, zwei Fluorophore; DAPI, 4′, 6-Diamidino-2-phenylindol; MitoTracker, eine Mitochondriensonde; Alexa 488, ein grüner Fluorophor; und Auto, Autofluoreszenz. Das Tutorial wurde entwickelt, um zufällig Photobleaching Raten für einzelne Fluorophore beim Nachladen zu ändern, so dass ein wiederholtes Klicken auf den Auslöser zeigt, wie das Bild erscheint, wenn sich die Fluoreszenzbleichrate für jedes der Farbsignale ändert.Da Photobleaching, ein sehr wenig verstandenes Phänomen, bei den meisten Proben zu einem dramatischen Verlust der Fluoreszenzemissionsintensität führt, ist die Kontrolle des Artefakts entscheidend, um zufriedenstellende Bilder erfolgreich aufzunehmen. Als Beispiel für ein typisches Fluorochrom schreibt die Quantenausbeute für das Photobleichen von Fluorescein bei mittlerer bis hoher Beleuchtungsintensität vor, dass ein durchschnittliches Molekül während seiner Nutzungsdauer zwischen 30 und 40 Tausend Photonen emittiert (bevor es dauerhaft deaktiviert wird). Darüber hinaus ist die Anzahl der Anregungs- und Emissionszyklen für einen gegebenen Fluorophor konstant, unabhängig davon, wie die Anregungsenergie entweder in diskreten Pulsen oder durch kontinuierliche Beleuchtung abgegeben wird. Daher verhindert die Reduzierung des Anregungslichtpegels durch Verwendung von Neutraldichtefiltern nicht die Photobleichung, sondern reduziert lediglich die Rate.
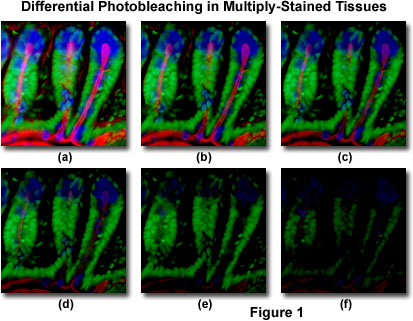
In Abbildung 1 ist ein typisches Beispiel für Photobleaching (Fading) dargestellt, das in einer Reihe von digitalen Bildern beobachtet wurde, die zu verschiedenen Zeitpunkten für einen mehrfach gefärbten Kryostat-Dünnschnitt (16 Mikrometer) des Mausdarms aufgenommen wurden. Die Kerne wurden mit Sytoxgrün (grüne Fluoreszenz) angefärbt, während der Schleim der Becherzellen und das filamentöse Aktin im Bürstenrand mit Alexa Fluor 350 Weizenkeimagglutinin (blaue Fluoreszenz) bzw. Alexa Fluor 568 Phalloidin (rote Fluoreszenz) angefärbt wurden. Zeitpunkte wurden in Zwei-Minuten-Intervallen unter Verwendung einer Fluoreszenzfilterkombination mit Bandbreiten aufgenommen, die so abgestimmt waren, dass sie die drei Fluorophore gleichzeitig anregten und gleichzeitig die kombinierten Emissionssignale aufzeichneten. Beachten Sie, dass alle drei Fluorophore in Abbildung 1 (a) eine relativ hohe Intensität aufweisen, die Alexa Fluor 350- und 568-Intensitäten (blau und rot) jedoch nach zwei Minuten schnell abfallen und nach sechs Minuten fast vollständig verschwunden sind. Die grün gefärbten Kerne sind resistenter gegen Photobleichung, aber ihre Intensität sinkt auch stetig im Laufe der zeitlichen Sequenz (10 Minuten). Eine Vielzahl synthetischer Antifade-Reagenzien reduziert die Photobleichungsrate erheblich.
Eine wichtige Klasse von Photobleaching-Ereignissen ist photodynamisch, dh sie beinhalten die Wechselwirkung des Fluorophors mit einer Kombination aus Licht und Sauerstoff. Reaktionen zwischen Fluorophoren und molekularem Sauerstoff zerstören die Fluoreszenz dauerhaft und ergeben eine Singulett-Sauerstoffspezies mit freien Radikalen, die andere Moleküle in lebenden Zellen chemisch modifizieren kann. Die Menge an Photobleichung aufgrund photodynamischer Ereignisse ist eine Funktion der molekularen Sauerstoffkonzentration und des proximalen Abstands zwischen dem Fluorophor, Sauerstoffmolekülen und anderen zellulären Komponenten. Die Photobleichung kann reduziert werden, indem die Belichtungszeit von Fluorophoren auf Beleuchtung begrenzt wird oder indem die Anregungsenergie verringert wird. Diese Techniken reduzieren jedoch auch das messbare Fluoreszenzsignal. In vielen Fällen können Lösungen von Fluorophoren oder Zellsuspensionen desoxygeniert werden, dies ist jedoch für lebende Zellen und Gewebe nicht möglich. Der vielleicht beste Schutz gegen Photobleaching besteht darin, die Exposition des Fluorochroms bei intensiver Beleuchtung (unter Verwendung von Neutraldichtefiltern) in Verbindung mit der vernünftigen Verwendung von im Handel erhältlichen Antifade-Reagenzien zu begrenzen, die der Montagelösung oder dem Zellkulturmedium zugesetzt werden können.
Unter bestimmten Umständen kann der Photobleaching-Effekt auch genutzt werden, um spezifische Informationen zu erhalten, die sonst nicht verfügbar wären. Beispielsweise werden bei der Fluoreszenzrückgewinnung nach Photobleaching-Experimenten (FRAP) Fluorophore innerhalb einer Zielregion absichtlich mit übermäßiger Bestrahlung gebleicht. Wenn neue Fluorophormoleküle in den gebleichten Bereich der Probe diffundieren (Rückgewinnung), wird die Fluoreszenzemissionsintensität überwacht, um die lateralen Diffusionsraten des Zielfluorophors zu bestimmen. Auf diese Weise kann die Translationsbeweglichkeit fluoreszenzmarkierter Moleküle innerhalb eines sehr kleinen (2 bis 5 Mikrometer) Bereichs einer einzelnen Zelle oder eines Abschnitts lebenden Gewebes ermittelt werden.Brian Herman – Abteilung für Zell- und Strukturbiologie, University of Texas Health Science Center, 7703 Floyd Curl Drive, San Antonio, Texas 78229.Matthew J. Parry-Hill, Ian D. Johnson und Michael W. Davidson – National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., Die Florida State University, Tallahassee, Florida, 32310.
ZURÜCK ZUR FLUORESZENZEINFÜHRUNG
ZURÜCK ZUR FLUORESZENZMIKROSKOPIE
Fragen oder Anmerkungen? Senden Sie uns eine E-Mail.
© 1998-2021 von Michael W. Davidson und der Florida State University. Alle Rechte vorbehalten. Keine Bilder, Grafiken, Skripte oder Applets dürfen ohne Genehmigung der Urheberrechtsinhaber reproduziert oder in irgendeiner Weise verwendet werden. Durch die Nutzung dieser Website erklären Sie sich mit allen von den Eigentümern festgelegten rechtlichen Bedingungen einverstanden.
Diese Website wird von unserem
Graphics & Webprogrammierteam
in Zusammenarbeit mit Optical Microscopy am
National High Magnetic Field Laboratory gepflegt.
Letzte Änderung: Montag, 12.September 2016 um 01:58 Uhr
Zugriffszahl seit 10.Juni 2003: 116208
![]()
![]()
![]()
![]()