Imprimación de Microscopía de expresiones Moleculares: Tutorial Interactivo de Fluorescencia – Fotoblanqueo
- Tutoriales Interactivos de Microscopía de fluorescencia
- Fotoblanqueo
- ¿Preguntas o comentarios? Envíenos un correo electrónico.
- © 1998-2021 por Michael W. Davidson y la Universidad Estatal de Florida. Todos los Derechos Reservados. No se pueden reproducir ni utilizar de ninguna manera imágenes, gráficos, scripts o applets sin el permiso de los titulares de los derechos de autor. El uso de este sitio web significa que acepta todos los Términos y Condiciones Legales establecidos por los propietarios.
- Este sitio web es mantenido por nuestro Graphics & Equipo de programación web en colaboración con Optical Microscopy en elNational High Magnetic Field Laboratory.
- Última modificación: Lunes, 12 de septiembre de 2016 a las 01: 58 PM
- Recuento de accesos Desde el 10 de junio de 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Tutoriales Interactivos de Microscopía de fluorescencia
Fotoblanqueo
El fenómeno del fotoblanqueo (también conocido comúnmente como desvanecimiento) ocurre cuando un fluoróforo pierde permanentemente la capacidad de fluorescencia debido al daño químico inducido por fotones y la modificación covalente. Tras la transición de un estado singlete excitado al estado triplete excitado, los fluoróforos pueden interactuar con otra molécula para producir modificaciones covalentes irreversibles. El estado triplete tiene una vida relativamente larga con respecto al estado singlete, lo que permite que las moléculas excitadas tengan un período de tiempo mucho más largo para experimentar reacciones químicas con componentes en el medio ambiente. El número medio de ciclos de excitación y emisión que se producen para un fluoróforo en particular antes de la fotoblanqueo depende de la estructura molecular y del entorno local. Algunos fluoróforos se blanquean rápidamente después de emitir solo unos pocos fotones, mientras que otros que son más robustos pueden sufrir miles o millones de ciclos antes del blanqueamiento. Este tutorial interactivo explora las variaciones en las tasas de fotoblanqueo en muestras de fluorescencia etiquetadas simples, dobles y múltiples.
El tutorial se inicializa con un par de imágenes de fluorescencia idénticas que aparecen en las ventanas de Imagen sin Blanquear y de Imagen con blanqueamiento fotográfico. Para utilizar el tutorial, haga clic en el botón del obturador para abrir el obturador virtual y permitir que la imagen fotolaceada se desvanezca o se vuelva fotolaceada a una velocidad muy exagerada durante un período de tiempo fijo. El desvanecimiento se puede detener en cualquier punto haciendo clic en el botón de Pausa (que se convierte en un botón de inicio), y luego se reanuda haciendo clic en el botón de inicio. En muestras con doble y triple etiqueta, las distintas tasas de blanqueamiento de fluoróforos individuales se pueden ver individualmente utilizando las casillas de verificación Canales de color (la configuración predeterminada es todos los canales activados). Por ejemplo, al hacer clic en la casilla de verificación Roja para una muestra con etiquetado triple, solo se mostrará el canal de color rojo. Dos o los tres canales de color se pueden mezclar en muestras con etiquetas múltiples utilizando la casilla de verificación Agregar. Se puede seleccionar una nueva muestra utilizando el menú desplegable Elegir una muestra. Los nombres de las muestras incluyen la siguiente información de etiquetado de fluoróforos: FITC, isotiocianato de fluoresceína; fluoróforo triple, a rojo, verde y azul; Doble, dos fluoróforos; DAPI, 4′, 6-diamidino-2-fenilindol; MitoTracker, una sonda mitocondrial; Alexa 488, un fluoróforo verde; y Auto, autofluorescencia. El tutorial está diseñado para alterar aleatoriamente las tasas de fotolimpieza de fluoróforos individuales al recargar, de modo que al hacer clic en el botón del obturador repetidamente se demostrará cómo aparece la imagen a medida que cambia la velocidad de blanqueo de fluorescencia para cada una de las señales de color.
Debido a que el fotoblanqueo, un fenómeno muy poco conocido, conduce a una pérdida dramática de la intensidad de emisión de fluorescencia en la mayoría de las muestras, el control del artefacto es crítico para capturar imágenes satisfactorias con éxito. Como ejemplo para un fluorocromo típico, el rendimiento cuántico para el fotoblanqueo de fluoresceína a una intensidad de iluminación media a alta dicta que una molécula promedio emitirá entre 30 y 40 mil fotones durante su vida útil (antes de desactivarse permanentemente). Además, el número de ciclos de excitación y emisión es constante para un fluoróforo dado, independientemente de cómo se entregue la energía de excitación, ya sea en pulsos discretos o a través de iluminación continua. Por lo tanto, reducir el nivel de luz de excitación mediante el uso de filtros de densidad neutra no impide el fotoblanqueo, simplemente reduce la velocidad.
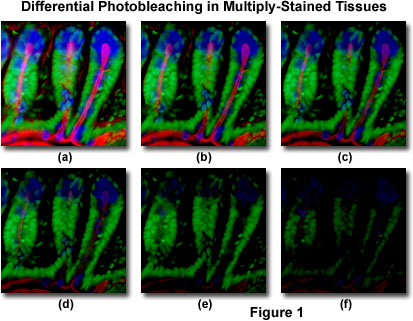
Se presenta en la Figura 1 un ejemplo típico de fotoblanqueo (decoloración) observado en una serie de imágenes digitales capturadas en diferentes puntos de tiempo para una sección delgada de criostato con tinción múltiple (16 micrómetros) de intestino de ratón. Los núcleos se teñieron con Verde Sytox (fluorescencia verde), mientras que el moco de las células de la copa y la actina filamentosa en el borde del cepillo se teñieron con aglutinina de germen de trigo Alexa Fluor 350 (fluorescencia azul) y faloidina Alexa Fluor 568 (fluorescencia roja), respectivamente. Los puntos de tiempo se tomaron en intervalos de dos minutos utilizando una combinación de filtros de fluorescencia con anchos de banda ajustados para excitar los tres fluoróforos simultáneamente mientras también se registraban las señales de emisión combinadas. Tenga en cuenta que los tres fluoróforos tienen una intensidad relativamente alta en la Figura 1(a), pero las intensidades de Alexa Fluor 350 y 568 (azul y rojo) comienzan a disminuir rápidamente a los dos minutos y desaparecen casi por completo a los seis minutos. Los núcleos teñidos de verde son más resistentes al fotoblanqueo, pero su intensidad también disminuye constantemente a lo largo de la secuencia cronometrada (10 minutos). Una amplia variedad de reactivos antifadados sintéticos reducirá significativamente la tasa de fotoblanqueo.
Una clase importante de photobleaching eventos son fotodinámica, lo que significa que implican la interacción del fluoróforo con una combinación de la luz y el oxígeno. Las reacciones entre fluoróforos y oxígeno molecular destruyen permanentemente la fluorescencia y producen una especie de oxígeno singlete de radicales libres que puede modificar químicamente otras moléculas en las células vivas. La cantidad de fotoblanqueo debido a eventos fotodinámicos es una función de la concentración molecular de oxígeno y la distancia proximal entre el fluoróforo, las moléculas de oxígeno y otros componentes celulares. El fotoblanqueo se puede reducir limitando el tiempo de exposición de los fluoróforos a la iluminación o reduciendo la energía de excitación. Sin embargo, estas técnicas también reducen la señal de fluorescencia medible. En muchos casos, las soluciones de fluoróforos o las suspensiones celulares se pueden desoxigenar, pero esto no es factible para las células y los tejidos vivos. Quizás la mejor protección contra el fotoblanqueo es limitar la exposición del fluorocromo a una iluminación intensa (utilizando filtros de densidad neutra) junto con el uso juicioso de reactivos antifaz disponibles en el mercado que se pueden agregar a la solución de montaje o al medio de cultivo celular.
Bajo ciertas circunstancias, el efecto de fotoblanqueo también se puede utilizar para obtener información específica que de otro modo no estaría disponible. Por ejemplo, en la recuperación de fluorescencia después de experimentos de fotoblanqueo (FRAP), los fluoróforos dentro de una región objetivo se blanquean intencionalmente con niveles excesivos de irradiación. A medida que las nuevas moléculas de fluoróforo se difunden en la región blanqueada de la muestra (recuperación), se monitoriza la intensidad de emisión de fluorescencia para determinar las tasas de difusión lateral del fluoróforo objetivo. De esta manera, la movilidad traslacional de moléculas etiquetadas fluorescentemente se puede determinar dentro de una región muy pequeña (de 2 a 5 micrómetros) de una sola célula o sección de tejido vivo.
Autores colaboradores
Brian Herman-Departamento de Biología Celular y Estructural, Centro de Ciencias de la Salud de la Universidad de Texas, 7703 Floyd Curl Drive, San Antonio, Texas 78229.Matthew J. Parry-Hill, Ian D. Johnson y Michael W. Davidson-Laboratorio Nacional de Alto Campo Magnético, 1800 East Paul Dirac Dr., Universidad Estatal de Florida, Tallahassee, Florida, 32310.
VOLVER A LA INTRODUCCIÓN DE LA FLUORESCENCIA
VOLVER A LA MICROSCOPÍA DE FLUORESCENCIA
¿Preguntas o comentarios? Envíenos un correo electrónico.
© 1998-2021 por Michael W. Davidson y la Universidad Estatal de Florida. Todos los Derechos Reservados. No se pueden reproducir ni utilizar de ninguna manera imágenes, gráficos, scripts o applets sin el permiso de los titulares de los derechos de autor. El uso de este sitio web significa que acepta todos los Términos y Condiciones Legales establecidos por los propietarios.
Este sitio web es mantenido por nuestro
Graphics & Equipo de programación web
en colaboración con Optical Microscopy en el
National High Magnetic Field Laboratory.
Última modificación: Lunes, 12 de septiembre de 2016 a las 01: 58 PM
Recuento de accesos Desde el 10 de junio de 2003: 116208
![]()
![]()
![]()
![]()