Molecular Expressions Mikroskopi Primer: Fluorescens – Photobleaching – Interaktiv Tutorial
- Fluorescens Mikroskopi Interaktive Tutorials
- Photobleaching
- Spørsmål eller kommentarer? Send oss en e-post.
- © 1998-2021 Av Michael W. Davidson Og Florida State University. Alle Rettigheter Reservert. Ingen bilder, grafikk, skript eller applets kan reproduseres eller brukes på noen måte uten tillatelse fra rettighetshaverne. Bruk av dette nettstedet betyr at du godtar Alle De Juridiske Vilkårene som er angitt av eierne.
- dette nettstedet vedlikeholdes av Vår Grafikk & Web Programmering Team i samarbeid Med Optisk Mikroskopi på National High Magnetic Field Laboratory.
- Siste endring: mandag, September 12, 2016 på 01: 58 PM
- Tilgang Teller siden juni 10, 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
Fluorescens Mikroskopi Interaktive Tutorials
Photobleaching
fenomenet photobleaching (også ofte referert til som falming) oppstår når en fluorofor permanent mister sin levetid.Evne Til Å Fluorescere På Grunn Av Foton-Indusert Kjemisk Skade Og Kovalent modifikasjon. Ved overgang fra en opphisset singlet-tilstand til den opphissede triplett-tilstanden, kan fluoroforer interagere med et annet molekyl for å produsere irreversible kovalente modifikasjoner. Tripletttilstanden er relativt lang levetid med hensyn til singlet-tilstanden, og gir dermed spente molekyler en mye lengre tidsramme for å gjennomgå kjemiske reaksjoner med komponenter i miljøet. Det gjennomsnittlige antall eksitasjons – og utslippssykluser som oppstår for en bestemt fluorofor før fotobleking, er avhengig av molekylstrukturen og det lokale miljøet. Noen fluoroforer blekner raskt etter å ha sendt ut bare noen få fotoner, mens andre som er mer robuste, kan gjennomgå tusenvis eller millioner sykluser før bleking. Denne interaktive opplæringen utforsker variasjoner i photobleaching priser i single, dual, og multiplisere merket fluorescens prøver.
opplæringen initialiseres med et par identiske fluorescensbilder som vises i Det Ublegede Bildet og Fotoblegede Bildevinduene. For å betjene opplæringen, klikk På Lukkerknappen for å åpne den virtuelle lukkeren og la Det Fotoblekede Bildebildet falme eller photobleach i en sterkt overdrevet hastighet over en fast tidsperiode. Fading kan stoppes når som helst ved å klikke På Pause-knappen (som blir En Start-knapp), og deretter gjenopptas ved å klikke På Start-knappen. I dobbelt-og trippelmerkede prøver kan de forskjellige individuelle fluoroforblekingshastighetene vises individuelt ved hjelp Av Fargekanaler-avmerkingsboksene (standardinnstillingen er alle kanaler slått på). Hvis du for eksempel klikker På Den Røde avmerkingsboksen for et eksemplar med trippelmerking, vises bare den røde fargekanalen. Enten to eller alle tre fargekanalene kan blandes sammen i multipliser merkede prøver ved Hjelp Av Legg Til-boksen. Et nytt eksemplar kan velges ved hjelp Av Rullegardinmenyen Velg Et Eksemplar. Prøvenavnene inkluderer følgende fluoroformerkingsinformasjon: FITC, fluoresceinisotiocyanat; Trippel, en rød, grønn og blå fluorofor; Dual, to fluoroforer; DAPI, 4′, 6-diamidino-2-fenylindol; MitoTracker, en mitokondriell sonde; Alexa 488, en grønn fluorofor; og Auto, autofluorescens. Opplæringen er utformet for å tilfeldig endre photobleaching priser for individuelle fluoroforer ved omlasting, slik at å klikke På Utløserknappen gjentatte ganger vil demonstrere hvordan bildet vises som fluorescens bleking endringer for hver av fargesignalene.fordi photobleaching, en svært dårlig forstått fenomen, fører til en dramatisk tap av fluorescens utslipp intensitet i de fleste eksemplarer, kontrollere gjenstanden er kritisk for å kunne fange tilfredsstillende bilder. Som et eksempel på et typisk fluorokrom dikterer kvanteutbyttet for fotobleking av fluorescein ved middels til høy belysningsintensitet at et gjennomsnittlig molekyl vil avgi mellom 30 og 40 tusen fotoner i løpet av sin brukstid (før de blir permanent deaktivert). I tillegg er antall eksitasjons-og utslippssykluser konstant for en gitt fluorofor uavhengig av hvordan eksitasjonsenergien leveres, enten i diskrete pulser eller gjennom kontinuerlig belysning. Derfor reduserer eksitasjonslysnivået ved å bruke nøytrale tetthetsfiltre ikke fotobleking, det reduserer bare hastigheten.
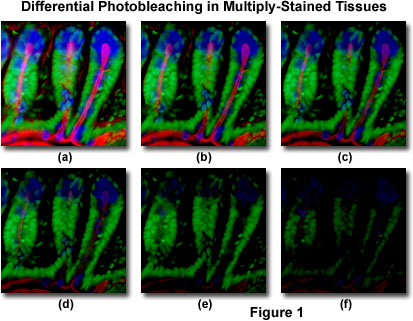
Presentert I Figur 1 er et typisk eksempel på fotobleking (fading) observert i en serie digitale bilder tatt på forskjellige tidspunkter for en multiply-farget kryostat tynn seksjon (16 mikrometer) av musetarmen. Kjernene ble farget Med Sytox Grønn (grønn fluorescens), mens slim av bobelceller og det filamentøse aktin i børstegrensen ble farget Med Henholdsvis Alexa Fluor 350 hvetekim agglutinin (blå fluorescens) og Alexa Fluor 568 phalloidin (rød fluorescens). Tidspunkter ble tatt i to minutters intervaller ved hjelp av en fluorescensfilter kombinasjon med båndbredder innstilt for å opphisse de tre fluoroforene samtidig, samtidig som de registrerer de kombinerte utslippssignalene. Merk at Alle tre fluoroforene har en relativt høy intensitet I Figur 1(a), Men Alexa Fluor 350 og 568 (blå og rød) intensiteter begynner å falle raskt på to minutter og er nesten helt borte på seks minutter. De grønnfargede kjernene er mer motstandsdyktige mot fotobleking, men intensiteten deres faller også jevnt i løpet av den tidsbestemte sekvensen (10 minutter). Et bredt utvalg av syntetiske antifade reagenser vil redusere hastigheten på fotobleking betydelig.
en viktig klasse av fotoblekingshendelser er fotodynamiske, noe som betyr at de involverer samspillet mellom fluoroforen med en kombinasjon av lys og oksygen. Reaksjoner mellom fluoroforer og molekylært oksygen ødelegger permanent fluorescens og gir en fri radikal singlet oksygenart som kjemisk kan modifisere andre molekyler i levende celler. Mengden fotobleking på grunn av fotodynamiske hendelser er en funksjon av molekylær oksygenkonsentrasjon og den proksimale avstanden mellom fluoroforen, oksygenmolekylene og andre cellulære komponenter. Fotobleking kan reduseres ved å begrense eksponeringstiden for fluoroforer til belysning eller ved å senke eksitasjonsenergien. Imidlertid reduserer disse teknikkene også det målbare fluorescenssignalet. I mange tilfeller kan løsninger av fluoroforer eller cellesuspensjoner deoksygeneres, men dette er ikke mulig for levende celler og vev. Kanskje den beste beskyttelsen mot fotobleking er å begrense eksponeringen av fluorokrom til intens belysning (ved hjelp av nøytrale tetthetsfiltre) kombinert med fornuftig bruk av kommersielt tilgjengelige antifade-reagenser som kan legges til monteringsløsningen eller cellekulturmediet.
under visse omstendigheter kan fotoblekingseffekten også brukes til å skaffe spesifikk informasjon som ellers ikke ville være tilgjengelig. For eksempel, i fluorescensgjenoppretting etter fotobleking (FRAP) eksperimenter, blir fluoroforer i en målregion forsettlig bleket med for høye nivåer av bestråling. Når nye fluoroformolekyler diffunderer inn i det blekede området av prøven (gjenvinning), overvåkes fluorescensutslippsintensiteten for å bestemme laterale diffusjonshastigheter for målfluoroforen. På denne måten kan den translasjonelle mobiliteten av fluorescerende merkede molekyler fastslås innenfor en svært liten (2 til 5 mikrometer) region av en enkelt celle eller del av levende vev.Brian Herman-Institutt For Cellulær Og Strukturell Biologi, University Of Texas Health Science Center, 7703 Floyd Curl Drive, San Antonio, Texas 78229.Matthew J. Parry-Hill, Ian D. Johnson og Michael W. Davidson-Nasjonalt Høyt Magnetfeltlaboratorium, 1800 East Paul Dirac Dr., Florida State University, Tallahassee, Florida, 32310.
TILBAKE TIL FLUORESCENS INTRODUKSJON
TILBAKE TIL FLUORESCENSMIKROSKOPI
Spørsmål eller kommentarer? Send oss en e-post.
© 1998-2021 Av Michael W. Davidson Og Florida State University. Alle Rettigheter Reservert. Ingen bilder, grafikk, skript eller applets kan reproduseres eller brukes på noen måte uten tillatelse fra rettighetshaverne. Bruk av dette nettstedet betyr at du godtar Alle De Juridiske Vilkårene som er angitt av eierne.
dette nettstedet vedlikeholdes av Vår
Grafikk & Web Programmering Team
i samarbeid Med Optisk Mikroskopi på
National High Magnetic Field Laboratory.
Siste endring: mandag, September 12, 2016 på 01: 58 PM
Tilgang Teller siden juni 10, 2003: 116208
![]()
![]()
![]()
![]()