Molekylære udtryk mikroskopi Primer: fluorescens – Photobleaching – Interactive Tutorial
- fluorescensmikroskopi interaktive Tutorials
- Photobleaching
- spørgsmål eller kommentarer? Send os en mail.
- 1998-2021 af Michael V. Davidson og Florida State University. Alle Rettigheder Forbeholdes. Ingen billeder, grafik, scripts eller applets må gengives eller bruges på nogen måde uden tilladelse fra indehaverne af ophavsretten. Brug af denne hjemmeside betyder, at du accepterer alle de juridiske vilkår og betingelser, der er angivet af ejerne.
- denne hjemmeside vedligeholdes af vores Graphics& programmering Teami samarbejde med optisk mikroskopi på National High Magnetic Field Laboratory.
- sidste ændring: mandag, Sep 12, 2016 på 01: 58 PM
- adgang tæller siden juni 10, 2003: 116208
- For more information on microscope manufacturers,use the buttons below to navigate to their websites:
fluorescensmikroskopi interaktive Tutorials
Photobleaching
fænomenet fotobleaching (også almindeligvis omtalt som fading) opstår, når en fluorophore permanent mister sin evne til at Evne til at fluorescere på grund af Fotoninduceret kemisk skade og kovalent modifikation. Ved overgang fra en ophidset singlettilstand til den ophidsede triplettilstand kan fluoroforer interagere med et andet molekyle for at producere irreversible kovalente modifikationer. Triplettilstanden er relativt langvarig med hensyn til singlettilstanden, hvilket tillader ophidsede molekyler en meget længere tidsramme at gennemgå kemiske reaktioner med komponenter i miljøet. Det gennemsnitlige antal eksitations-og emissionscyklusser, der forekommer for en bestemt fluorofor før fotoblegning, afhænger af molekylstrukturen og det lokale miljø. Nogle fluorophorer bleges hurtigt efter kun at have udsendt et par fotoner, mens andre, der er mere robuste, kan gennemgå tusinder eller millioner af cyklusser inden blegning. Denne interaktive tutorial udforsker variationer i fotoblegningshastigheder i enkelt -, dobbelt-og multiplicer mærkede fluorescensprøver.
vejledningen initialiseres med et par identiske fluorescensbilleder, der vises i det ublegede billede og Fotoblegede billedvinduer. For at betjene selvstudiet skal du klikke på udløserknappen for at åbne den virtuelle lukker og lade det Fotoblegede billedbillede falme eller fotobleach med en meget overdrevet hastighed over en fast tidsperiode. Fading kan standses når som helst ved at klikke på pauseknappen (som bliver en startknap) og derefter genoptages ved at klikke på startknappen. I dobbelt-og tredobbeltmærkede prøver kan de forskellige individuelle fluorophore-blegningshastigheder ses individuelt ved hjælp af afkrydsningsfelterne farvekanaler (standardindstillingen er alle kanaler tændt). Hvis du for eksempel klikker på Det Røde afkrydsningsfelt for en prøve med tredobbelt mærkning, vises kun den røde farvekanal. Enten to eller alle tre af farvekanalerne kan blandes sammen i multiplicer mærkede prøver ved hjælp af afkrydsningsfeltet Tilføj. En ny prøve kan vælges ved hjælp af rullemenuen Vælg en prøve. Prøvenavne inkluderer følgende fluoroformærkningsoplysninger: FITC, fluoresceinisothiocyanat; tredobbelt, en rød, grøn og blå fluorofor; Dobbelt, to fluoroforer; DAPI, 4′,6-diamidino-2-phenylindol; MitoTracker, en mitokondriel probe; Aleksa 488, en grøn fluorofor; og Auto, autofluorescens. Vejledningen er designet til tilfældigt at ændre fotoblegningshastigheder for individuelle fluoroforer ved genindlæsning, så klik på udløserknappen gentagne gange viser, hvordan billedet vises, når fluorescensblegningshastigheden ændres for hvert af farvesignalerne.
fordi fotoblegning, et meget dårligt forstået fænomen, fører til et dramatisk tab af fluorescensemissionsintensitet i de fleste prøver, er styring af artefakten kritisk for med succes at fange tilfredsstillende billeder. Som et eksempel på et typisk fluorokrom dikterer kvanteudbyttet til fotoblegning af fluorescein ved medium til høj belysningsintensitet, at et gennemsnitligt molekyle udsender mellem 30 og 40 tusind fotoner i løbet af dets nyttige levetid (før det bliver permanent deaktiveret). Derudover er antallet af eksitations-og emissionscyklusser konstant for en given fluorofor, uanset hvordan eksitationsenergien leveres, enten i diskrete impulser eller gennem kontinuerlig belysning. Derfor forhindrer reduktion af eksitationslysniveauet ved hjælp af neutrale densitetsfiltre ikke fotoblegning, det reducerer blot hastigheden.
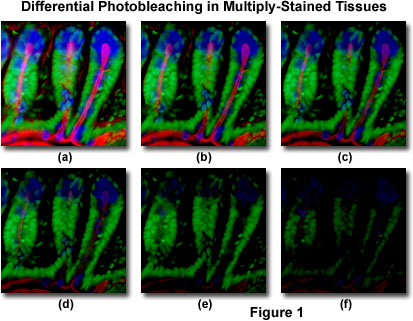
præsenteret i Figur 1 er et typisk eksempel på fotoblegning (fading) observeret i en række digitale billeder taget på forskellige tidspunkter for en multipliceret farvet cryostat Tynd sektion (16 mikrometer) af musetarm. Kernerne blev farvet med Sytoksgrøn (grøn fluorescens), mens slim fra bægerceller og den filamentøse actin i børstegrænsen blev farvet med henholdsvis aleksafluor 350 hvedekimagglutinin (blå fluorescens) og Aleksafluor 568 phalloidin (rød fluorescens). Tidspunkter blev taget i to minutters intervaller ved hjælp af en fluorescensfilterkombination med båndbredder indstillet til at begejstre de tre fluoroforer samtidigt, mens de også registrerede de kombinerede emissionssignaler. Bemærk, at alle tre fluoroforer har en relativt høj intensitet i Figur 1 (a), men aleksafluor 350 og 568 (blå og rød) intensiteter begynder at falde hurtigt efter to minutter og er næsten helt væk efter seks minutter. De grønfarvede kerner er mere modstandsdygtige over for fotoblegning, men deres intensitet falder også støt i løbet af den tidsbestemte sekvens (10 minutter). En bred vifte af syntetiske AntiFade reagenser vil reducere hastigheden af fotoblegning betydeligt.
en vigtig klasse af fotoblegningshændelser er fotodynamiske, hvilket betyder, at de involverer fluoroforens interaktion med en kombination af lys og ilt. Reaktioner mellem fluoroforer og molekylært ilt ødelægger permanent fluorescens og giver en fri radikal singlet iltart, der kemisk kan modificere andre molekyler i levende celler. Mængden af fotoblegning på grund af fotodynamiske begivenheder er en funktion af den molekylære iltkoncentration og den proksimale afstand mellem fluorophoren, iltmolekylerne og andre cellulære komponenter. Fotoblegning kan reduceres ved at begrænse eksponeringstiden for fluoroforer til belysning eller ved at sænke eksitationsenergien. Imidlertid reducerer disse teknikker også det målbare fluorescenssignal. I mange tilfælde kan opløsninger af fluorophorer eller cellesuspensioner afgiftes, men dette er ikke muligt for levende celler og væv. Den bedste beskyttelse mod fotoblegning er måske at begrænse eksponeringen af fluorochrome for intens belysning (ved hjælp af neutrale densitetsfiltre) kombineret med den fornuftige anvendelse af kommercielt tilgængelige AntiFade-reagenser, der kan tilsættes til monteringsopløsningen eller cellekulturmediet.
under visse omstændigheder kan fotoblegningseffekten også bruges til at opnå specifik information, der ellers ikke ville være tilgængelig. For eksempel i fluorescensgenvinding efter fotoblegning (frap) eksperimenter bleges fluoroforer inden for et målområde med vilje med for store bestrålingsniveauer. Da nye fluoroformolekyler diffunderer ind i det blegede område af prøven (genopretning), overvåges fluorescensemissionsintensiteten for at bestemme de laterale diffusionshastigheder for målfluoroforen. På denne måde kan den translationelle mobilitet af fluorescerende mærkede molekyler konstateres inden for et meget lille (2 til 5 mikrometer) område af en enkelt celle eller sektion af levende væv.
bidragende forfattere
Brian Herman – Institut for Cellulær og strukturel biologi, University of Southern Health Science Center, 7703 Floyd Curl Drive, San Antonio, 78229.Parry-Hill, Ian D. Johnson, og Michael Davidson – National High Magnetic Field Laboratory, 1800 East Paul Dirac Dr., Florida State University, Tallahassee, Florida, 32310.
Tilbage til fluorescens introduktion
Tilbage til fluorescensmikroskopi
spørgsmål eller kommentarer? Send os en mail.
1998-2021 af Michael V. Davidson og Florida State University. Alle Rettigheder Forbeholdes. Ingen billeder, grafik, scripts eller applets må gengives eller bruges på nogen måde uden tilladelse fra indehaverne af ophavsretten. Brug af denne hjemmeside betyder, at du accepterer alle de juridiske vilkår og betingelser, der er angivet af ejerne.
denne hjemmeside vedligeholdes af vores
Graphics& programmering Team
i samarbejde med optisk mikroskopi på
National High Magnetic Field Laboratory.
sidste ændring: mandag, Sep 12, 2016 på 01: 58 PM
adgang tæller siden juni 10, 2003: 116208
![]()
![]()
![]()
![]()